提示:内容已经过期谨慎付费,点击上方查看最新答案
物理化学基础
- 双液电池包含两种不同的电解质溶液或同一电解质但浓度不同的溶液。在电解液相接触的界面处能产生一定的电势差,称为液接电势,对于液接电势的认识,下面说法中正确的是( )
在298K、pq下,两瓶含萘的苯溶液,第一瓶为2dm3 (溶有0.5mol萘),第二瓶为1dm3 (溶有0.25mol萘),若以μ1和μ2 分别表示两瓶中萘的化学势,则有( )
- 下列各式哪个表示了偏摩尔量:( )
- 用铂作电极电解一些可溶性碱的水溶液, 在阴、阳两电极上可分别获得氢气和氧气。所得各种产物的量主要决定于( )
- 江、河水中含的泥沙悬浮物在出海口附近都会沉淀下来,原因有多种,其中与胶体化学有关的是( )
在一定温度和压力下,对于一个化学反应,能用以判断其反应方向的是:( )
反应
 在25℃平衡常数Kcq为4.0,今以
在25℃平衡常数Kcq为4.0,今以 及
及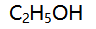 各1 mol混合进行反应,则达平衡常数最大产率为:( )
各1 mol混合进行反应,则达平衡常数最大产率为:( )- 质量数为 210的钚同位素进行β放射,经14天后,同位素活性降低6.85%。此同位素的半衰期为( )
- 关于节流膨胀, 下列说法正确的是( )
- 绝热条件下,273.15K的NaCl加入273.15K的碎冰中,体系的温度将如何变化? ( )
加入惰性气体对哪一个反应能增大其平衡转化率?( )
已知反应
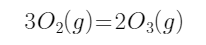 在25℃时
在25℃时  =-280 J·mol-1,则对该反应有利的条件是:( )
=-280 J·mol-1,则对该反应有利的条件是:( )- 下述过程,体系的ΔG何者为零?( )
- NaCl(s), NaCl水溶液及水蒸汽平衡共存时, 系统的自由度( )
- 电解质水溶液的离子平均活度系数受多种因素的影响, 当温度一定时, 其主要的影响因素是( )
- 体系的状态改变了,其内能值: ( )
- 下面的说法符合热力学第一定律的是( )
- 用化学方法测定反应速率的主要困难是( )
理想气体反应
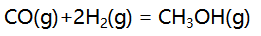 的
的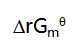 与温度T的关系为:
与温度T的关系为: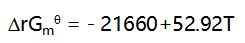 ,若要使反应的平衡常数
,若要使反应的平衡常数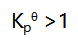 ,则应控制的反应温度:( )
,则应控制的反应温度:( )- 离子的迁移数是指正负两种离子在作电迁移运动时各自的导电份额或导电的百分数, 因此, 离子的运动速度直接影响离子的迁移数。它们的关系是( )
- 对于孤立体系中发生的实际过程,下式中正确的是( )
- 对韦斯登标准电池,下列叙述正确的是( )
- 下列说法中,不正确的有( )
- 下列物系中为胶体的是:( )
- 对于物理吸附和化学吸附的关系,以下描述不正确的是( )
- 关于克劳修斯-克拉佩龙方程下列说法正确的是( )
- 表面活性剂是针对某种特定的液体或溶液而言的,关于表面活性剂的实质性作用,以下说法错误的是( )
- 关于表面活性物质使用时的注意事项,下列说法不正确的是( )
- Clapeyron方程适用于以下哪些体系中?( )
- 关于亨利系数,下列说法中不正确的是:( )
- 常见的一些亚稳现象都与表面现象有关,下面说法不正确的是( )
- 以下各系统中不属单相的是( )
- 与物质的生成热有关的下列表述中正确的是( )
- 关于杠杆规则的适用对象, 下面的说法中正确的是( )
- 关于反应分子数的正确说法是( )
- 对于理想气体,下列关系中哪些是正确的:( )
- 对于电动电位的描述,正确的是:( )
- 液体对光滑表面的润湿程度常用接触角来量度,下面说法中不正确的是( )
- 对于非电解质溶液,下述说法中不正确的是: ( )
- 以下自然现象与表面现象密切相关的是( )
- 由纯组分混合成理想液态混合物时没有热效应,故混合熵等于零。( )
- 热力学第三定律可以表示为:在0℃时,任何完整晶体的熵等于零。( )
- 自然界中,风总是从化学势高的地域吹向化学势低的地域。( )
- 讨论固体对气体等温吸附的朗格缪尔(Langmuir) 吸附理论最重要的基本假设为:固体表面不均匀。( )
- 精镏过程中只有传热过程。( )
- 质量作用定律只适用于基元反应。( )
- 非挥发性溶质溶于溶剂中形成稀溶液时,将引起熔点升高。( )
- 某反应, 无论反应物初始浓度为多少, 在相同时间和温度时, 反应物消耗的浓度为定值, 此反应是零级反应。( )
- 朗格谬尔吸附等温式适用于单分子层吸附和多分子层吸附。( )
- 链反应一般都有自由基或自由原子参加 。( )
- 某放热反应在T=800K,压力p下进行,达平衡后产物的百分含量是50%,若反应在T=200K,压力p下进行,平衡时产物的百分含量将增大。( )
- 当溶液中表面活性剂的浓度足够大时,表面活性剂分子便开始以不定的数目集结,形成所谓胶束,胶束的出现标志着表面活性剂降低表面张力的作用下降。( )
- 环境的熵变与过程有关。( )
- 求任一不可逆绝热过程的熵变dS,可以通过始终态相同的可逆非绝热过程求得。( )
- 链反应开始时的速率都很大。( )
- 凡是被物质吸收了的光都能引起光化反应。( )
- 主要决定于溶解在溶液中粒子的数目,而不决定于这些粒子的性质的特性叫一般特性。( )
- 在工业上,从反应体系中将产物移出,从而促使化学平衡正向移动提高产率。( )
- 气体反应的碰撞理论的要点是一对反应分子具有足够的能量的迎面碰撞才能引起反应。( )
- 法拉弟于1834年根据大量实验事实总结出了著名的法拉弟电解定律。它说明的问题是通过电解池的电量与发生电极反应的物质的量之间的关系。( )
A:迄今为止,既难于用实验测定又不能准确地计算 B:其值可以通过电极电势的能斯特公式和离子迁移数进行准确计算 C:可以采用盐桥完全消除 D:可用对消法(或补偿法)测量其大小
答案:难于实验测定也难于计算AI参考:正确选项为D:可用对消法(或补偿法)测量其大小。液接电势是指双液电池中两种不同电解质溶液或同一电解质但浓度不同溶液之间存在电势差,其值可以通过对消法(或补偿法)测量其大小。这种方法是通过改变电解质溶液的浓度或加入某种添加剂,使得两个电极之间的电位差减小或消失,从而实现对液接电势的测量。因此,选项D是正确的。其他选项要么无法准确计算或测量液接电势,要么无法完全消除液接电势。'
A:μ1 = 2μ2 B:μ1 = 1/2μ2 C:μ1 = 10μ2 D:μ1 = μ2
答案:μ1=μ2
A: B: C: D:
答案:https://p.ananas.chaoxing.com/star3/origin/39acbda5163980aa1dc895d35d719cc5.png
A:电解液浓度 B:通过电极的电量 C:电解温度和压力 D:电解液的本性
答案:通过电极的电量
A:盐析作用 B:电解质聚沉作用 C:破乳作用 D:溶胶互沉作用
答案:电解质聚沉作用
A:∆rHm B: ∆rGmq C:Kp D:∆rGm
A:0.334% B:66.7% C:50.0% D:33.4%
AI参考:正确答案是:B:66.7%。根据题意可知,反应在25℃平衡常数Kc为4.0,即反应物浓度商为4,所以当达到平衡时产物的最大产率为66.7%。答案为B。'
A:135.9 天 B:3.6 天 C:270.8 天 D:7.2 天
A:节流过程中多孔塞两边的压力不断变化 B:节流膨胀中系统的内能变化 C:节流膨胀是绝热可逆过程 D:节流膨胀中系统的焓值改变
A:不变 B:升高 C:降低 D:不能确定
A: B: C: D:
A:升温升压 B:降温升压 C:温降压 D:升温降压
AI参考:正确答案是:D:升温降压。已知反应$3O_{2}(g) = 2O_{3}(g)$在25℃时$K = - 280J cdot mol^{- 1}$,该反应是放热反应,降温平衡正向移动,因此温度不利于反应正向进行,答案选D。升温升压使反应体系有利的趋势。升温气体体积膨胀压强降低不利于平衡正向进行;降压即减少体积也使气体体积膨胀,有利于平衡正向进行。故答案选D。注意:本题考查化学平衡的影响因素,难度不大。注意把握影响因素对化学平衡的影响。另外,需要注意的是,本题中给出的$K$为标准态下的平衡常数,不能确定平衡常数与温度的关系,需要根据已知的$K$计算$K_{θ}$并与题目给定的$K$比较才能确定。'
A:在100℃,101325Pa下1mol水蒸发成水汽 B:孤立体系的任意过程 C:理想气体的等温膨胀 D:绝热可逆过程
A:F=2 B:F=3 C:F=1 D:F=0
A:离子的本性 B:电解质的强弱 C:离子浓度及离子电荷数 D:共存的它种离子的性质
AI参考:正确答案是C:离子浓度及离子电荷数。电解质水溶液的离子平均活度系数受多种因素的影响,其中当温度一定时,主要受离子浓度及离子电荷数的影响。离子浓度越大,离子间的相互作用力越强,导致离子的有效碰撞次数减少,因此离子平均活度系数减小;离子电荷数越高,电离程度越大,导致离子的有效碰撞次数增加,因此离子平均活度系数增大。因此,正确选项为C。其他选项如离子的本性、电解质的强弱、共存的它种离子的性质等也会对电解质水溶液的离子平均活度系数产生影响,但不是主要影响因素。'
A:必定改变 B:状态与内能无关 C:不一定改变 D:必定不变
A:在无功过程中, 内能变化等于过程热, 这表明内能增量不一定与热力学过程无关 B:在一完全绝热且边界为刚性的密闭容器中发生化学反应时,其内能一定变化 C:封闭系统在指定的两个平衡态之间经历绝热变化时, 系统所做的功与途径无关 D:气体在绝热膨胀或绝热压缩过程中, 其内能的变化值与过程完成的方式无关
A:不易控制温度 B:不能使反应在指定的时刻完全停止 C:混合物很难分离 D:很难同时测定各物质浓度
A:必须低于409.3K B:必须高于409.3K C:必须等于409.3K D:必须低于409.3℃
AI参考:正确答案是:A:必须低于409.3K。根据题意,反应的平衡常数与温度有关,温度升高平衡常数增大,所以要使平衡常数不变,应控制反应温度低于409.3K。因此,答案为A。'
A:无论什么离子,它们的运动速度愈大, 迁移的电量就愈多,迁移数也愈大 B:同一种离子的运动速度是一定的, 故它在不同的电解质溶液中, 迁移数相同 C:在只含某种电解质的溶液中, 离子运动的速度愈大, 迁移数就愈大 D:在任何电解质溶液中,离子运动的速度愈大, 迁移数就愈大
A:dh = 0 B:Q = 0 C:dS> 0 D:W = 0
A:温度系数小 B:为可逆电池 C:电池电动势保持长期稳定不变 D:正极为含12.5%镉的汞齐
AI参考:正确选项为:A:温度系数小;C:电池电动势保持长期稳定不变。韦斯登标准电池是一个内阻较小的电池系统,它的特点在于温度系数小、电压稳定。同时,由于韦斯登标准电池使用了含镉汞齐的负极,使得电池反应是不可逆的。因此,韦斯登标准电池也具有极高的精确度和稳定性。综上所述,正确答案为A和C。选项B和D描述的是韦斯登标准电池的特点,但并不全面,因此不正确。'
A:平衡移动了,平衡常数也一定改变 B:所有标准平衡常数都是无量纲的 C:某一反应的平衡常数是一个不变的常数 D:已达平衡的化学反应,只有当标准平衡常数改变时,平衡才会移动
AI参考:正确答案是:A:平衡移动了,平衡常数也一定改变。平衡常数只与温度有关,温度不变,平衡常数不变,BCD选项正确。平衡移动了,平衡常数不一定改变,如增大反应物浓度平衡正向移动,平衡常数不变,A选项错误。综上,本题答案为A。'
A:雾 B:空气 C:灭火泡沫 D:珍珠
AI参考:正确答案是A、C、D。雾、灭火泡沫和珍珠都属于胶体。胶体是一种分散系,其分散质粒子在1nm~100nm之间,能产生丁达尔效应。而空气不是胶体,因为其分散质粒子大于这个范围。'
A:即使改变条件,物理吸附和化学吸附也不能相互转化 B:在适当温度下,任何气体都可在任何固体表面上发生物理吸附 C:升高温度对物理吸附和化学吸附都有利 D:Langmuir吸附等温式只适用于物理吸附
AI参考:正确选项为:B:在适当温度下,任何气体都可在任何固体表面上发生物理吸附分析如下:1. A选项:物理吸附和化学吸附是两种不同的吸附方式,物理吸附无法转化为化学吸附,反之亦然。A选项描述正确。2. B选项:物理吸附发生在固体表面与气体分子之间,当气体分子的能量不足以支持化学键合时,就会发生物理吸附。并不是任何气体在任何固体表面上都可以发生物理吸附,这与气体的能量和固体表面的化学性质有关。B选项描述错误。3. C选项:升高温度可以增加气体分子的能量,使其更容易与固体表面发生物理吸附。因此,升高温度对物理吸附有利。但是,对于化学吸附来说,升高温度可能会使化学键变得不稳定,从而促进化学反应的发生。C选项描述正确。4. D选项:Langmuir吸附等温式是一个适用于物理吸附的吸附等温线模型,它描述了气体在固体表面上的吸附平衡状态。D选项描述正确。综上,此题答案为B选项。注意问题中的描述是不正确的选项,而不是无关项,因此B选项的描述与题目要求不符。'
A:该方程仅适用于液-气平衡 B:该方程假定气体的体积远大于液体或固体的体积 C:该方程既适用于液-气平衡又适用于固-气平衡 D:该方程假定与固相或液相平衡的气体为理想气体
AI参考:关于克劳修斯-克拉佩龙方程,正确选项为:B: 该方程假定气体的体积远大于液体或固体的体积D: 该方程假定与固相或液相平衡的气体为理想气体克劳修斯-克拉佩龙方程是热力学中的方程,用于描述温度、压力和组成之间的平衡关系。它假定气体的体积远大于液体或固体的体积,因此适用于气体体积远大于固体或液体的情况。同时,它假定与固相或液相平衡的气体为理想气体,这意味着气体被视为没有分子间相互作用力,只有分子动能。所以选项B和D是正确的。然而,该方程并没有说明它适用于液-气平衡还是固-气平衡,因为这取决于具体的应用场景。所以选项C是不正确的。选项A也不完全正确,因为克劳修斯-克拉佩龙方程的应用范围并不仅限于液-气平衡。'
A:乳化作用 B:降低表面张力 C:增加表面张力 D:增溶作用
A:阳离子型和非离子型表面活性剂不能混用 B:两性型和非离子型表面活性剂不能混用 C:阴离子型表面活性剂不能在酸性环境中使用 D:阳离子型和阴离子型表面活性剂不能混用
AI参考:关于表面活性物质使用时的注意事项,下列说法不正确的是:B、C、D。阳离子型和非离子型、阴离子型和非离子型表面活性剂可以混用。A、C两项的表述较为复杂,不展开,因为不是主要的考察内容。表面活性剂分很多种类型,主要包括阴离子型、阳离子型、两性型以及非离子型,每一种类型的表面活性剂之间,可以在一定的条件下混合使用。选项D说法较为绝对化,如选用合适比例搭配的阴、阳离子型表面活性剂是可以混用的。以上就是关于表面活性物质使用时的注意事项的相关内容,选择题可能存在多种可能性,以上回答仅供参考。'
A:理想溶液中任一组分的液-气可逆相变 B:纯物质在等温等压下的不可逆相变 C:纯物质固-气可逆相变 D:纯物质固(α)=纯物质固(β)可逆相变
A:其值与温度、浓度和压力有关 B:其值与温度、溶质和溶剂性质及浓度的标度有关 C:其值与温度、溶质性质和浓度有关 D:其值与温度、溶剂性质和浓度有关
AI参考:关于亨利系数,下列说法中不正确的是:C、其值与温度、溶质性质和浓度有关。亨利系数是用来描述物质在两相(通常是气相和液相)之间的分配情况常数,其值与温度、溶质和溶剂的性质、浓度以及压力等条件有关。根据亨利定律,某物质的摩尔分数与其所处压力下该物质的饱和蒸汽压成正比。因此,温度、溶质和溶剂的性质以及浓度都会影响亨利系数。因此,C选项是不正确的。其它选项,如A、B、D,都是正确的。A选项指出亨利系数与温度、浓度和压力有关;B选项指出亨利系数与温度、溶质和溶剂性质及浓度的标度有关;D选项指出亨利系数与温度、溶剂性质和浓度有关。这些说法都是亨利系数的常见解释和应用。'
A:过饱和蒸气是由于小液滴的蒸气压小于大液滴的蒸气压所致 B:人工降雨时在大气中撒入化学物质的主要目的是促进凝结中心形成 C:过热液体形成的原因是新相种子──小气泡的附加压力太小 D:饱和溶液陈化,晶粒长大是因为小晶粒溶解度比大晶粒的小
A:大小不一的一堆单斜硫碎粒 B:极细的斜方硫和单斜硫混合物 C:墨汁 D:漂白粉
AI参考:正确选项为:C:墨汁选项中,单相系统是指组成物质的分子结构比较简单,相互之间作用力较小,可以近似地看做单一物质组成的系统。而墨汁是由多种物质混合而成的,其中包含着多种物质成分和复杂的分子结构,因此不属于单相系统。其他选项中,单斜硫碎粒、极细的斜方硫和单斜硫混合物、漂白粉等都是单一物质组成的系统,属于单相系统。因此,正确选项为C。'
A:化合物的生成热一定不为零 B:通常所使用的物质的标准生成热数据实际上都是相对值 C:标准状态下单质的生成热都规定为零 D:很多物质的生成热都不能用实验直接测量
A:适用于三组分系统的两个平衡相 B:适用于二组分系统的两个平衡相 C:适用于二组分系统的任何相区 D:不适用于单组分系统
A:反应分子数一定是正整数 B:现在只发现单分子反应、双分子反应、三分子反应 C:反应分子数等于反应式中的化学计量数之和 D:反应分子数是个理论数值
AI参考:正确选项为C:反应分子数等于反应式中的化学计量数之和。反应分子数是化学反应中参与反应的粒子数,它等于反应式中的化学计量数之和。化学反应中的参与反应的粒子可以是分子、原子、离子等,因此反应分子数可以是正整数或负整数。反应分子数并不一定是正整数,也并不只局限于单分子、双分子或三分子反应,因此选项A和B是错误的。反应分子数是一个理论数值,用于描述化学反应中参与反应的粒子数量,但并不是一个实际存在的物理量,因此选项D是错误的。'
A: B: C: D:
AI参考:正确选项为:B: 理想气体状态方程:pV = nRTC: 理想气体等容变化下,压强与体积成反比D: 理想气体分子之间的相互作用力可以忽略不计,分子势能可以忽略不计A选项不太清楚题目意思,需要提供更多信息。'
A:电动电位表示了胶粒溶剂化界面到溶液本体内的电位差 B:电动电位的绝对值总是大于热力学电位 C:当双电层被压缩到与溶剂化层(或紧密层)相合时,电动电位变为零 D:电动电位值极易为少量外加电解质而变化
AI参考:正确选项为:A:电动电位表示了胶粒溶剂化界面到溶液本体内的电位差;C:当双电层被压缩到与溶剂化层(或紧密层)相合时,电动电位变为零。解释:电动电位是胶体溶液中,溶胶粒子表面的扩散层在静电引力作用下的电位差。扩散层在胶粒表面形成双电层,在外加电场作用下,双电层会受到压缩并发生电位变化。当双电层被压缩到与溶剂化层(或紧密层)相合时,电动电位变为零。电动电位的绝对值可能会大于热力学电位,但这并不是电动电位的描述中必须包含的内容。而选项B和D中提到的电动电位的绝对值总是大于热力学电位和电动电位值极易为少量外加电解质而变化,并不是电动电位的正确描述,因此不正确。'
A:θ= 0°时,液体对固体完全不润湿 B:0°< θ< 90°时,液体对固体润湿程度小 C:θ= 180°时,液体对固体完全润湿 D:θ= 90°时,是润湿与不润湿的分界线
A:在一定温度下,溶液的蒸气压一定小于纯溶剂的蒸气压 B:在有限浓度范围内,真实溶液的某些热力学性质与理想溶液相近似 C:溶液就是多种液态物质组成的混合物 D:溶液浓度选择不同标度时,其化学势也不同
A:不同浓度的蔗糖水溶液混合 B:微小液滴自动呈球形 C:气体在固体上的吸附 D:微小固体在溶剂中溶解
AI参考:正确选项是:B:微小液滴自动呈球形。微小液滴自动呈球形属于表面现象,因为它涉及到液体与气体之间的界面作用,如表面张力等。而其他选项如蔗糖水溶液混合、气体在固体上的吸附和微小固体在溶剂中溶解更多地涉及到物质的物理和化学性质,与表面现象关系相对较小。'
A:对 B:错
A:对 B:错
A:对 B:错
A:对 B:错
A:对 B:错
AI参考:答案:B。精馏过程中除了传热过程,还有蒸发、冷凝、混合、分离等过程。'
A:错 B:对
AI参考:答案是B:对。质量作用定律适用于所有反应,包括基元反应和非基元反应。'
A:错 B:对
A:错 B:对
A:对 B:错
A:对 B:错
AI参考:正确答案是A,链反应一般都有自由基或自由原子参加。链反应是指化学反应中,通过一系列自由基或自由原子的反应,形成新的物质或能量的过程。在链反应中,自由基或自由原子通常扮演着重要的角色,它们可以相互结合形成新的物质,也可以与其他物质发生化学反应产生能量。因此,链反应一般都有自由基或自由原子参加。'
A:对 B:错
A:对 B:错
A:对 B:错
AI参考:环境的熵变与过程有关,所以选项A是正确的。在封闭系统中,环境的熵变主要取决于过程的熵变,也就是说过程对于环境的熵变有直接的影响。此外,环境熵变的计算还需要考虑物质的自由度,因此答案为A。'
A:对 B:错
AI参考:正确答案是A:对。根据热力学第二定律,熵是描述系统无序程度的物理量,不可逆绝热过程是一个熵增加的过程。对于一个不可逆绝热过程,可以通过始终态相同的可逆非绝热过程求得熵变dS,因为可逆过程具有更高的对称性和更小的熵增加。因此,本题判断题的说法是正确的。'
A:对 B:错
AI参考:B:错。链反应开始时的速率不一定很大,取决于初始条件和反应机制。在某些情况下,链反应的初始速率可能较小,随着反应的进行逐渐增加。因此,这个判断题是错误的。'
A:错 B:对
A:对 B:错
A:错 B:对
AI参考:正确答案是B:对。在工业上,从反应体系中将产物移出,从而促使化学平衡正向移动可以提高产率。因此,这个判断题是正确的。'
A:错 B:对
A:对 B:错
温馨提示支付 ¥2.35 元后可查看付费内容,请先翻页预览!

