提示:内容已经过期谨慎付费,点击上方查看最新答案
工科化学基础与化学分析
- 在一个多电子原子中,具有下列各组量子数(n,l,m,ms)的电子,能量最大的电子具有的量子数是 ( )。
- 常压下将1.0 L气体的温度从0℃变到273℃,其体积将变为 ( )。
- 石墨中的C原子层与层之间的作用力是 ( )。
- 下列各数中有效数字位数为四位的是( )。
- 已知电对Cl2/Cl-,Br2/Br-,I2/I-的EӨ各为1.36V、1.07V、0.54V,,EӨ(MnO2/Mn2+) = 1.23 V,EӨ(Fe3+/Fe2+) = 0.77 V,EӨ(Cu2+/Cu) = 0.34 V,标态时有Cl-、Br-、I-的混合溶液,欲使I-氧化成I2,而Cl-,Br-不被氧化,应选择下列氧化剂中的( )。
- 酸碱滴定中选择指示剂的原则是 ( )。
- 用配位(络合)滴定法测定石灰石中CaO的含量,经四次平行测定,得ω(CaO)=27.50%,若真实含量为27.30%,则27.50% - 27.30% = +0.20%,称为( )。
- 下列反应中,反应的ΔrHmӨ等于产物的ΔfHmӨ的是 ( )。
- 某配离子[M(CN)4]2-的中心离子M2+以(n-1)d-ns-np轨道杂化与CN-形成配位键,则有关该配离子的类别、构型正确的是( )。
- 计算一组数据:2.01,2.02,2.03,2.04,2.06,2.00的相对标准偏差为( )。
- 反应2 NO(g) + 2 H2(g)
 N2(g) + 2 H2O(g) 的速率常数k的单位是L·mol-1·s-1,则此反应级数是 ( )。
N2(g) + 2 H2O(g) 的速率常数k的单位是L·mol-1·s-1,则此反应级数是 ( )。 - 反应FeCl3 + SnCl2
 2 FeCl2 + SnCl4、2 KMnO4 + 10 FeSO4 + 8 H2SO4
2 FeCl2 + SnCl4、2 KMnO4 + 10 FeSO4 + 8 H2SO4  2 MnSO4 + 5 Fe2(SO4)3 + K2SO4 + 8 H2O,在标准状态下能正向进行,则可判断以下电对电极电势由大到小顺序正确的是( )。
2 MnSO4 + 5 Fe2(SO4)3 + K2SO4 + 8 H2O,在标准状态下能正向进行,则可判断以下电对电极电势由大到小顺序正确的是( )。 - 可见光分光光度法所包括的入射光波长范围为( )。
- 将固体NH4NO3溶于水中,溶液变冷,则该过程的ΔG,ΔH,ΔS的符号依次是( )。
- 在吸收光谱曲线上,如果其他条件都不变,只增加溶液的浓度,则λmax的位置和峰的高度将( )。
- 根据反应Cd + 2H+ →Cd2+ + H2 构成原电池,其电池符号为( )。
- 若NH3·H2O及其共轭酸的离解常数分别表示为
 和
和 ,则下列关系式中正确的是( )。
,则下列关系式中正确的是( )。 - 下列物质中,熔点由低到高排列的顺序应该是 ( )。
- ① 用 0.03 mol·L-1 KMnO4溶液滴定 0.1 mol·L-1Fe2+溶液;②用 0.003 mol·L-1 KMnO4溶液滴定 0.01 mol·L-1 Fe2+溶液。①与②两种情况下的滴定突跃将是( )。
- 已知下列反应的反应热分别为:(1)A+B→C+D,ΔrHmӨ,1=x kJ·mol-1,(2)2C+2D→E,ΔrHmӨ,2=y kJ·mol-1,则反应(3)E→2A+2B的ΔrHmӨ,3等于 ( )。
- 下列哪一种物质的标准生成吉布斯自由能为零 ( )。
- 下列酸碱滴定中,哪种方法由于滴定突跃不明显而不能用直接滴定法进行容量分析(已知:
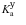 (HAc) = 1.8×10-5;
(HAc) = 1.8×10-5; (HCN)= 4.9×10-10;
(HCN)= 4.9×10-10;  (H3PO4)= 7.5×10-3;
(H3PO4)= 7.5×10-3;  (H3PO4)= 6.2×10-8;
(H3PO4)= 6.2×10-8; (H3PO4) =2.2×10-13;
(H3PO4) =2.2×10-13;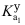 (H2CO3) = 4.2×10-7;
(H2CO3) = 4.2×10-7; (H2CO3) = 5.6×10-11)( )。
(H2CO3) = 5.6×10-11)( )。 - H2O的沸点是373 K,H2Se的沸点是231 K,这可用下列哪一种理论来解释( )。
- 某元素的+2氧化态离子的核外电子结构为1s22s22p63s23p63d5,此元素在周期表中的位置是 ( )。
- 下列叙述中不正确的有 ( )。
- 温度升高反应速率加快的原因有 ( )。
- 下列叙述中正确的有 ( )。
- 用EDTA直接滴定有色金属离子,终点所呈现的颜色组成是( )。
- 对于关系式
 =1.23×10-20来说,下列叙述中正确的有 ( )。
=1.23×10-20来说,下列叙述中正确的有 ( )。 - 有关稀有气体叙述不正确的有 ( )。
- 在氧化还原反应中,两电对的电极电势相对大小决定了氧化还原反应速率的大小。( )
- 非金属单质不生成金属键的结构,所以熔点比较低,硬度比较小,都是绝缘体。( )
- 冰在室温下自动融化成水,是熵增起重要作用的结果。( )
- 反应 NO(g)+CO(g)
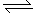
 N2 (g)+ CO2 (g),Δr HmӨ <0,欲使有害气体CO和NO获得最大转化率,应选择的条件是高温、低压。( )
N2 (g)+ CO2 (g),Δr HmӨ <0,欲使有害气体CO和NO获得最大转化率,应选择的条件是高温、低压。( ) - 绝对误差是指测定值与真实值之差。( )
- 催化剂只能改变反应的活化能,不能改变反应的热效应。( )
- EDTA滴定中,溶液的酸度对滴定没有影响。( )
- 符合比耳定律的有色溶液被稀释时,其最大吸收峰的波长位置不移动,但吸收峰降低。( )
- 银量法测定BaCl2中的Cl−时,宜选用K2CrO4来指示终点。( )
- 稀释可以使醋酸的解离度增大,因而可使其酸性增强。( )
- 不少显色反应需要一定时间才能完成,而且形成的有色配合物的稳定性也不一样,因此,光度测定必须在显色后一定时间内进行。( )
- 元素的金属性越强,则其相应氧化物水合物的碱性就越强;元素的非金属性越强,则其相应氧化物水合物的酸性就越强。( )
- 在滴定分析中,化学计量点必须与滴定终点完全重合,否则会引起较大的滴定误差。( )
- 吸光系数与入射光波长及溶液浓度有关。( )
- CrH为离子氢化物,在水溶液中能导电。( )
- 沉淀是否完全的标志是被沉淀离子是否符合规定的某种限度,不一定被沉淀离子在溶液中就不存在。( )
- 原子在基态时没有未成对电子,就肯定不能形成共价键。( )
- 在氢卤酸中,因为氟的非金属性强,所以氢氟酸的酸性最强。( )
- 浓度为0.10 mol·L-1的某一元弱酸不能用NaOH标准溶液直接滴定,则其0.10 mol·L-1的共轭碱一定能用强酸直接滴定。( )
- 原子核外有几个未成对电子,就能形成几个共价键。( )
A:3,1,-1,+ B:3,1,0,- C:3,2,+1,+ D:2,1,+1,-
答案:3,2,+1,+1/2
A:1.5 L B:1.0 L C:0.5 L D:2.0 L
答案:2 L
A:范德华力 B:共价键 C:配位共价键 D:自由电子型金属键
AI参考:正确答案是:B:共价键。石墨是混合型的晶体,它由层状的碳原子单质组成,层与层之间由范德华力连接,但主要形成的是共价键。故选B。'
A:CaO% = 25.30 B:0.0001 C:c (H+) = 0.0235 mol·dm-3 D:pH = 4.462
答案: 19.96%
A:KMnO4 B:MnO2 C:Fe2(SO4)3 D:CuSO4
答案:KMnO4;K2Cr2O7
A:指示剂应在pH = 7.00时变色 B:指示剂的变色范围应全部或部分落在pH突跃范围之内 C:指示剂的变色范围与化学计量点完全相符 D:指示剂变色范围应全部落在pH突跃范围之内
答案:指示剂的变色范围全部或者部分落入滴定的pH值突跃范围之内
A:相对误差 B:相对偏差 C:绝对误差 D:绝对偏差
A:NO(g) + 1/2 O2(g) NO2(g) B:C(金刚石) C(石墨) C:H2(g) + 1/2 O2(g) H2O(l) D:2 H2(g) + O2(g) 2 H2O(l)
A:内轨型,正四面体 B:内轨型,平面正方形 C:外轨型,平面正方形 D:外轨型,正四面体
AI参考:正确答案是D:外轨型,正四面体。由于配离子中M2+离子的价层电子排布为3d10,可见内层d轨道未满,为内轨型配合物。中心离子杂化方式为dsp2杂化,其形成的配位键是由四个轨道组成的正四面体结构,故正确答案为D。'
A:1.3% B:0.9% C:1.1% D:0.7%
AI参考:正确答案是B,0.9%。相对标准偏差(RSD)用于表示一组测量数据的离散程度,标准偏差越小,说明测量数据的集中趋势越高,反之则说明离散程度较高。本题中,数据为等差数列,其平均值为(2.01+2.02+2.03+2.04+2.06)/5=2.03,标准偏差为(2.06-2.03)^2+(2.04-2.03)^2+(2.03-2.03)^2/5=0.03846。所以相对标准偏差为RSD=(标准偏差/平均值)*100%=(0.03846/2.03)*100%=1.89%,即选项B。'
A:0 B:1 C:2 D:3
AI参考:答案:C。本题考察反应速率方程式的书写,已知反应2NO(g) + 2H2(g)
 N2(g) + 2H2O(g) 的速率常数k的单位是L·mol-1·s-1,那么这个反应是一个二级反应,因此本题选C。'
N2(g) + 2H2O(g) 的速率常数k的单位是L·mol-1·s-1,那么这个反应是一个二级反应,因此本题选C。'A:Fe3+/Fe2+ > MnO4-/Mn2+ > Sn4+/Sn2+ B:MnO4-/Mn2+ > Sn4+/Sn2+ > Fe3+/Fe2+ C:Fe3+/Fe2+ > Sn4+/Sn2+ > MnO4-/Mn2+ D:MnO4-/Mn2+ > Fe3+/Fe2+ > Sn4+/Sn2+−
AI参考:正确答案是:B:MnO4-/Mn2+ > Sn4+/Sn2+ > Fe3+/Fe2+。根据题意,反应正向进行,说明氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物。所以氧化性:MnO4->Fe3+>Sn4+>还原性:Mn2+<Fe2+<Sn2+,故电对的电极电势由大到小的顺序为B。故选B。'
A:400~760 nm B:500~840 nm C:400~560 nm D:10~200 nm
A:-、+、- B:+、-、- C:-、+、+ D:+、+、-
A:峰位不移动,峰高降低 B:峰位向短波方向移动,峰高增加 C:峰位不移动,峰高增加 D:峰位向长波方向移动,逢高增加
A:(-)Cd∣Cd2+ ‖ H+,H2∣Pt(+) B:(-)H2∣H+ ‖ Cd2+∣Cd(+) C:(-)Cd∣Cd2+ ‖ H+∣H2,Pt(+) D:(-)Pt, H2∣H+ ‖ Cd2+∣Cd(+)
A: =14- B: / = C: · =1 D: · =
AI参考:正确答案是C: · =1。根据电离平衡常数表达式可知,NH₃·H₂O的电离平衡常数表达式为Kb=c(NH₄⁺) × c(OH⁻) / c(NH₃·H₂O),由于水解是微弱的,则电离产物浓度比平衡浓度大,则平衡常数可视为反应产物浓度的比值,因此本题中该关系式应为c(NH₄⁺) × c(OH⁻) =c(NH₃·H₂O)。由于选项中只有C符合这个关系式,因此答案为C。'
A:NH3<KCl<PH3<SiO2 B:NH3<PH3<SiO2<KCl C:PH3<NH3<KCl<SiO2 D:PH3< NH3<SiO2<KCl
AI参考:正确答案是D:PH3< NH3<SiO2<KCl。氨气、氯化钾、磷酸和二氧化硅的熔点分别为:氨气:173K,氯化钾:770K,磷酸:80K,二氧化硅:1700K,熔点由低到高排列的顺序应为PH3<NH3<SiO2<KCl。所以选择D。需要注意氯化铝为共价化合物,不是盐,与钾不形成盐碱盐键作用力不如碱金属氧化物强,熔点反而较高。另外硅酸的熔点较高是由于分子内存在氢键作用力较强,因此该题考查了不同类型分子晶体熔沸点的影响因素及强弱比较。'
A:缺电位值,无法判断 B:②> ① C:①> ② D:一样大
A:x2y kJ·mol-1 B:-2x- y kJ·mol-1 C:1/ x2y kJ·mol-1 D:2 x+y kJ·mol-1
AI参考:正确答案是D:2x+y kJ·mol-1。根据盖斯定律,已知反应的反应热,可以求得任意反应的反应热。因此,对于反应E→2A+2B,可以由已知的反应(2)和(1)相加得到,即ΔrHmӨ,3=ΔrHmӨ,2+ΔrHmӨ,1=y+x=x+y+kJ·mol-1。因此选项D为正确答案。需要注意的是,本题中没有给出反应焓变符号,因此无法确定是吸热还是放热反应。如果题目中给出了反应焓变的正负号,则可以根据反应热效应的正负来判断反应是吸热还是放热。'
A:Br-(aq) B:Br2(g) C:Br2(l) D:Br2(aq)
A:用HCl溶液滴定NaCN溶液 B:用HCl溶液滴定NaAc溶液 C:用HCl溶液滴定Na2CO3溶液 D:用NaOH溶液滴定H3PO4溶液
A:范德华力 B:共价键 C:离子键 D:氢键
AI参考:答案是D:氢键。氢键对物质熔点沸点的影响是比较显著的,如果存在氢键,熔沸点变化的范围比较小。因为H₂O分子之间可以形成氢键,所以它的沸点较高,高于$H_{2}Se$。A项错误,范德华力对固体、液体和气体之间的界面张力起作用,对于液体的热稳定性有影响,但不是影响分子晶体熔沸点的决定因素。B项错误,共价键是化学键的一种,通过共用电子对形成,是原子间的主要作用力之一,与题干无关。C项错误,离子键是化学键的一种,通过阴阳离子间相互作用形成,与题干无关。因此本题选D。'
A:p区 第三周期 ⅤA族 B:d区 第四周期 ⅦB族 C:d区 第四周期 ⅤB族 D:d区 第四周期 Ⅷ族
A:某离子沉淀完全,是指离子完全转化为沉淀 B:混合离子的溶液中,溶度积小的沉淀者一定先沉淀 C:凡溶度积大的沉淀一定能转化成溶度积小的沉淀 D:当溶液中有关物质的离子积小于其溶度积时,该物质就会溶解
AI参考:不正确的有:A:某离子沉淀完全,是指离子完全转化为沉淀实际上,沉淀的完全并不能保证离子一定转化为沉淀。这是因为一些沉淀可能是微量存在或者因为条件限制,它们可能会残留在溶液中。因此选项A是错误的。B:混合离子的溶液中,溶度积小的沉淀者一定先沉淀溶度积小的沉淀不一定先沉淀,因为溶度积小的沉淀可能会在溶液中存在更多的离子时溶解,或者在混合离子溶液中,不同的离子浓度可能不同,导致不同的沉淀物溶解度不同。C:凡溶度积大的沉淀一定能转化成溶度积小的沉淀不是所有溶度积大的沉淀都能转化成溶度积小的沉淀。有些物质在转化过程中可能会发生化学变化,导致溶度积发生变化。D:当溶液中有关物质的离子积小于其溶度积时,该物质就会溶解当溶液中有关物质的离子积小于其溶度积时,该物质溶解。这句话是正确的。但是溶解的原因不仅仅是因为离子积小于溶度积,还可能是因为温度、浓度、pH值等因素的影响。所以答案是:B和C。'
A:活化分子百分数增大 B:分子运动速度加快 C:反应是吸热 D:反应活化能减小
AI参考:正确答案是:AB。温度升高反应速率加快的原因有活化分子百分数增大和分子运动速度加快。温度升高反应速率加快,与反应是吸热还是放热无关,与反应活化能大小无关。因此,本题答案为AB。'
A:反应级数与反应分子数必定相等 B:通常,反应活化能越小,反应速率常数越大,反应越快 C:反应温度升高,活化分子百分数降低,反应加快 D:加入正催化剂,使Ea正和Ea逆减小相同倍数
A:指示剂-金属离子配合物的颜色 B:有色金属离子的颜色 C:游离指示剂的颜色 D:EDTA-金属离子配合物的颜色
A:此式说明了平衡时H+、S2-和H2S三者浓度之间的关系 B:此式表明,通过调节c(H+)可以调节S2-离子浓度 C:此式表示了氢硫酸在溶液中按下式解离:H2S 2 H+ + S2- D:由于H2S二级解离产生的c(H+)很小,体系中的c(H+) ≈ c(HS-),,因此c(S2-) ≈
AI参考:正确答案是:D:由于H2S二级解离产生的c(H+)很小,体系中的c(H+) ≈ c(HS-),因此c(S2-) ≈ 。本题为文字型题目,无需做任何计算或推理,根据题目给出的关系式可知,该式描述了氢硫酸在溶液中按下式解离:H2S H+ + HS-,并进一步说明了由于H2S二级解离产生的c(H+)很小,体系中的c(H+) ≈ c(HS-),因此c(S2-) ≈ 。A选项描述的是平衡时H+、S2-和H2S三者浓度之间的关系,但题目中并未给出三者浓度之间的关系,故无法判断是否正确;B选项表明通过调节c(H+)可以调节S2-离子浓度,这与题目中的关系式并无直接关联,因此不能直接从关系式中得到;C选项则表达的是氢硫酸的解离过程,也并非直接从题目中给出的关系式得出。因此只有D选项与题目中给出的关系式相符合,为正确选项。综上,答案为D。'
A:常温下都是气态 B:常温下密度都较大 C:常温下在水中的溶解度较大 D:都具有8电子稳定结构
AI参考:有关稀有气体叙述不正确的有BCD。A选项正确:稀有气体在常温下都是气态,这个叙述是正确的。C选项正确:在水中溶解度的问题,一般来说,极性溶剂容易溶解极性物质,而非极性溶剂容易溶解非极性物质。稀有气体是非极性分子,所以在水中溶解度较大。D选项正确:稀有气体原子中都有电子,并且每个原子都达到最外层8电子稳定结构。而B选项错误,因为不是所有的稀有气体密度都较大,比如氦气在常温下是气态,并且是所有元素中密度最小的气体。所以,有关稀有气体叙述不正确的有BCD。'
A:对 B:错
A:错 B:对
A:对 B:错
A:错 B:对
AI参考:答案是B,对。根据题目给出的反应方程式,反应方向为放热且熵减的反应,ΔrHmӨ<0。要使有害气体CO和NO获得最大转化率,应该选择使平衡正向移动的条件。根据勒夏特列原理,如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。因此,应该选择低温高压的条件,以使平衡正向移动,提高CO和NO的转化率。所以选项B是正确的。高温会使平衡逆向移动,低压会使反应速率降低,都不利于提高CO和NO的转化率。因此,选项A是错误的。'
A:错 B:对
AI参考:答案是【对】。绝对误差是指测定值与真实值之差,它反映测量值与真实值之间的绝对关系。'
A:对 B:错
A:错 B:对
A:对 B:错
A:错 B:对
AI参考:答案:B:对。银量法测定BaCl2中的Cl-时,由于Cl-和CrO42-的变价电势相近,故常用K2CrO4作指示剂,终点时析出的银铬矾(Ag2CrO4)呈深红色,与原来的无色溶液对比很明显。因此本题答案为B,即对。'
A:对 B:错
A:错 B:对
A:错 B:对
AI参考:正确答案是B:对。元素的金属性越强,其相应氧化物水合物的碱性就越强;元素的非金属性越强,则其相应氧化物水合物的酸性就越强。这是因为金属性越强,金属原子在水溶液中越容易失去电子,相应氧化物水合物中的碱性就越强;而非金属性越强,非金属原子在水中越容易得到电子,相应氧化物水合物中的酸性就越强。因此,这个判断题是正确的。'
A:错 B:对
A:错 B:对
AI参考:答案:A:错。吸光系数与入射光波长及溶液浓度有关,但与溶液的性质、溶剂等有关,而与溶液浓度无关。因此,判断题的说法是错误的。'
A:错 B:对
AI参考:答案是B:对。CrH是离子氢化物,在水溶液中能导电,因为CrH在水溶液中能电离产生氢离子和铬离子,分别具有自由移动的电子和离子,能够导电。因此,该判断题是正确的。'
A:对 B:错
A:对 B:错
A:对 B:错
A:对 B:错
AI参考:答案是B:错。这个题目考察的是酸碱滴定的基本原理。一元弱酸不能被直接滴定的原因是其存在酸式电离平衡,当加入过量的碱时,会生成相应的盐和氢离子,但由于酸式电离平衡的存在,氢离子浓度相对较小,不足以中和大部分的氢氧根离子,因此无法准确滴定。而对于共轭碱,由于其与弱酸盐是等价的,其不能被滴定的原因也类似。但是当碱浓度过高时,强酸能够与其中和的部分碱进行酸式电离,也就是说一部分氢氧根离子可能被中和掉了,剩余的氢氧根离子数量会低于0.10mol·L⁻¹。因此这种情况下无法保证足够的滴定剂浓度进行准确滴定。因此本题答案为B。即判断错误。'
A:对 B:错
温馨提示支付 ¥1.80 元后可查看付费内容,请先翻页预览!

