1.对于塔菲尔公式η = a + blgj,下列叙述不正确的是( )
A:对大多数金属来说,b = 0.10~0.14 V
B:适用于氢、氧等气体在金属电极(阴极和阳极)上的析出
C:a为单位电流密度的过电势,与电极材料有很大关系
D:气体析出的过电势与温度无关
答案:AI参考:D:气体析出的过电势与温度无关。\n\n在塔菲尔公式η = a + blgj中,a为单位电流密度的过电势,与电极材料有很大关系。b为比例系数,取决于金属的性质和所涉及的电子的数目。该公式适用于氢、氧等气体在金属电极(阴极和阳极)上的析出,特别是在析氢腐蚀条件下。在应用塔菲尔公式时,需要考虑温度的影响,因为过电势会随着温度的变化而变化。因此,选项D不正确,而其他选项都是正确的描述。'
2.
有以下四种溶液:(a)0.1 mol·dm–3 NaNO3;(b)0.1 mol·dm–3 NaCl;(c)H2O;(d)0.1 mol·dm–3 Ca(NO3)2。AgCl在这些溶液中的溶解度的递增次序为:( )。
A:(c)<(b)<(a)<(d) B:(a)<(b)<(c)<(d) C:(c)<(a)<(b)<(d) D:(b)<(c)<(a)<(d)
答案:AI参考:答案:B\n解析:\n对于难溶盐来说,盐的类型是影响溶解度的因素之一。一般规律是,含有相同阴离子的盐,溶解度相近或稍大;阴离子不同,溶解度逐渐增大。硝酸银易溶于水,生成的沉淀只有一种即AgCl,其溶解度在各溶液中按下列次序减小:(a)NaNO3溶液<(b)NaCl溶液<(c)水<(d)Ca(NO3)2溶液。\n\n所以答案是B。'
3.
速率常数的实验值与简单碰撞理论的计算值比较,一般计算值远大于实验值。这种差别的公认解释是由于理论处理中( )。
A:作了Ec=Ea近似 B:未考虑分子大小的影响 C:碰撞数计算不准 D:未考虑空间影响因素
答案:AI参考:正确选项为【B:未考虑分子大小的影响】。\n\n简单碰撞理论是在理想条件下建立的,即忽略了分子大小的影响。而实验值通常会受到分子大小的影响,因为实验中涉及到的分子可能比理论模型中的分子更大,这会导致实验值比理论值略小。因此,对于速率常数的差别,通常是因为理论处理中未考虑分子大小的影响。其他选项中,A选项的Ec=Ea近似是一个特定的近似条件,它不会导致速率常数的差别;C选项的碰撞数计算不准和D选项的空间影响因素通常不会导致理论值远大于实验值的情况。因此,B选项未考虑分子大小的影响是正确的解释。'
4.
下面哪一个公式表示了离子独立移动定律:( )。
A:Λ∞m,+ = t∞++Λ∞m B:Λm =κ/c C:α=Λm/Λ∞m D:Λ∞m、+ =Λ∞m-Λ∞m、-
答案:AI参考:正确答案是D:Λ∞m、+ =Λ∞m-Λ∞m、-。\n\n离子独立移动定律是指溶液中每个离子都按照各自的热力学定律进行运动,不受其他离子影响。选项D中的公式表示了离子独立移动定律,即溶液中正离子和负离子的浓度差决定了它们的运动方向,而其他离子对它们的运动没有影响。因此,选项D是正确答案。其他选项不符合离子独立移动定律的定义。'
5.
已知Tl3+,Tl+ïPt的电极电势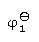 =1.250 V,Tl+ïTl的电极电势
=1.250 V,Tl+ïTl的电极电势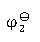 =-0.336 V,则电极Tl3+ïTl的电极电势
=-0.336 V,则电极Tl3+ïTl的电极电势 为( )。
为( )。
A:1.586 V B:0.914 V C:0.305 V D:0.721 V
答案:AI参考:根据题目中的信息,已知 Tl3+,ïPt 的电极电势为 1.250 V,ïTl 的电极电势为 -0.336 V。根据电极电势的计算公式,可以得出 Tl+ïTl 的电极电势为 Tl3+ïPt 的电极电势减去 ïTl 的电极电势的相反数。因此,电极 Tl3+ïTl 的电极电势为 1.250 - ( - 0.336) = 1.586 V。因此,正确答案是 A:1.586 V。'
6.
在298 K时,浓度为0.1和0.01 mol/kg的HCl溶液的液接电势Ej(1),浓度相同而换用KCl溶液,则其液接电势为Ej(2),两者关系为()。
A:Ej(1)=Ej(2) B:Ej(1)>Ej(2) C:Ej(1)
7.
按SI制,如下单位不正确的是:( )。
A:离子摩尔电导率:S•m2/mol B:电导:S C:电导率:S/m D:摩尔电导率:S/(m•mol)
答案:AI参考:正确答案是:B:电导:S。\n按SI制,电导单位为S/m,选项B不正确。离子摩尔电导率单位为S•m2/mol,摩尔电导率单位为S/(m•mol),选项ACD正确。因此,本题答案为B。'
8.在相同条件下,氢析出时超电势最小的是( )
A:镀铂黑的铂电极 B:金电极 C:光亮铂电极 D:银电极
答案:镀铂黑的铂电极
9.同一系统,表面自由能和表面张力都用σ表示,它们( )
A:前者是标量,后者是矢量 B:量纲和单位完全相同 C:物理意义相同,数值相同 D:物理意义相同,单位不同
答案:前者是标量,后者是矢量
10.电解时,在阳极上首先发生氧化作用而放电的是( )
A:标准还原电势最大者 B:考虑极化后,实际上的不可逆还原电势最小者 C:考虑极化后,实际上的不可逆还原电势最大者 D:标准还原电势最小者
答案:考虑极化后,实际上的不可逆还原电势最小者
11.用铜电极电解CuCl2的水溶液,在阳极上会发生( )。
A:析出氯气 B:析出铜 C:铜电极溶解 D:析出氧气 12.离子电迁移率的单位可表示成:( )。
A:m·s–1·V–1 B:m2·s–1·V–1 C:m·s–1 D:s–1 13.某等容反应的热效应为Qv=50 kJ·mol-1,则反应的实验活化能Ea值为( )。
A:无法确定 B:Ea=-50 kJ·mol-1 C:Ea≥50 kJ·mol-1 D:Ea<50 kJ·mol-1 14.化学反应速率常数的Arrhenius式子能成立的范围是( )
A:对任何反应在任何温度范围内 B:对某些反应在一定温度范围内 C:对任何反应在一定温度范围内 D:对某些反应在任何温度范围内 15.电池在恒温、恒压和可逆条件下放电,则其与环境间的热交换为下列何者( )
A:一定为零 B:为TDS C:为DH D:与DH和TDS均无关 16.相同反应级数的平行反应,其总速率常数等于各反应的速率常数之和。( )
A:错误 B:正确 17.符合质量作用定律的反应一定是基元反应。( )
A:错误 B:正确 18.表面活性物质是指那些加人到溶液中,可以降低溶液表面张力的物质。( )
A:对 B:错 19.表面吉布斯函数是指恒温、恒压下,当组成不变时可逆地增大单位表面积时,系统所增加的吉布斯函数,表面张力则是指表面单位长度上存在的使表面张紧的力。所以表面吉布斯函数与表面张力是两个根本不同的概念。( )
A:错误 B:正确 20.只有在298.15K,标准氢电极的电势才规定为零。( )
A:错误 B:正确 21.负极的电极电势随电流密度的增加而减小。( )
A:错误 B:正确 22.“三分子反应”不一定是三级反应。( )
A:错误 B:正确 23.恒温、恒压下,凡能使系统表面吉布斯函数降低的过程都是自发过程。( )
A:错 B:对 24.电极Pt|Cl2(p)|Cl-(a)属于第二类电极。( )
A:对 B:错 25.若算的电池反应的电池电动势为负值时,表明此电池反应不可能进行。( )
A:正确 B:错误 26.极化和过电位是同一个概念。( )
A:错 B:对 27.产生物理吸附的力是范德华力,作用较弱,因而吸附速度慢,不易达到平衡。( )
A:错 B:对 28.对于Weston标准电池为可逆电池,温度系数小,且电池电动势长期保持稳定不变。( )
A:错误 B:正确 29.无限稀时HCl、KCl和NaCl三种溶液在相同温度、相同浓度、相同单位电场强度下,Cl–的迁移数相同。( )
A:错 B:对 30.用Pt电极电解CuCl2水溶液,阳极上放出Cl2。( )
A:错 B:对 31.电池Zn(s)ïZn2+(a=0.1)ïïNi2+(a=0.1)ïNi(s)是自发性电池。( )
A:错误 B:正确 32.在一定温度下稀释电解质溶液,摩尔电导率增大,而电导率的变化不一定增大。( )
A:正确 B:错误 33.德拜—休克尔公式对于一切强电解质溶液均能使用。( )
A:错误 B:正确 34.若某电池反应的热效应是负值,此电池进行可逆工作时,与环境交换的热为放热。( )
A:错误 B:正确 35.能证明科尔劳乌施经验式(Λm = Λ∞ - Ac1/2)的理论是阿仑尼乌斯(Arrhenius)的电离理论。( )
A:正确 B:错误
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!

