- 电对的氧化型形成沉淀 ,则该电对的E升高。
- ⅥB族中各元素的价层电子构型为(n-1)d5ns1。
- 在CS2、C2H2分子中,均有σ键和π键。( )
- 稀有气体分子中不存在化学键。
- 铬的最高氧化值等于其族序数。
- 铍和其同组元素相比,离子半径小,极化作用强,所以形成键具有较多共价性。( )
- 多酸是由多个酸分子组成的含氧酸。
- 由Li至Cs的原子半径逐渐增大,所以其第一电离能也逐渐增大。( )
- 硅和硼在周期表中处于对角线位置上,它们的化合物表现出相似性。( )
- 具有极性键的分子都是极性分子。( )
- 配合物的CFSE的大小,是衡量配合物稳定性重要因素。()
- 对于弱碱溶液,当加水稀释时,pH值减小。 ( )
- 所有内轨型配合物都呈反磁性,所有外轨型配合物都呈顺磁性。()
- 硼砂的化学式为Na2B2O7 。( )
- H2O之间存在的分子间作用力有()。
- 用能斯特方程式计算Br2/Br-电对的电极电势E值,下列叙述不正确的是:
- 下列试剂所参与的化学反应,可以在铂制器皿中进行的是( )
- 下列分子中,最可能存在的氮化物是 ( )
- 质量摩尔浓度均为0.02 mol·kg-1的KCl溶液,Na2SO4溶液,HF溶液,C6H1206(葡萄糖)溶液,蒸气压最低的是( )
- 下面物理量,都属于状态函数的是:( )
- 反应A+B→C的速率方程式是v=k[c(A)]1/2c(B),如果A、B浓度都增大到原来的4倍,那么反应速率将增大到原来的( )
- 将氟气通入水中,生成的产物不可能( )
- 给定下列溶液:A. 5 % 蔗糖(C12H22O11)、B. 5 % 葡萄糖(C6H12O6)、C. 5 % 乙二醇 (C2H6O2)、D. 5% NaCl溶液,最先沸腾的是:( )
- 下列物质与K2Cr2O7溶液反应没有沉淀生成的是( )
- 某反应的活化能Ea越大,速率系数k越小,温度升高,k变 ( ),反应物浓度增大,k ( )
- 微溶化合物Ag3AsO4在水中的溶解度是1升水中3.5×10-7g, 摩尔质量为462.52 g ·mol –1,微溶化合物Ag3AsO4的溶度积为( )。
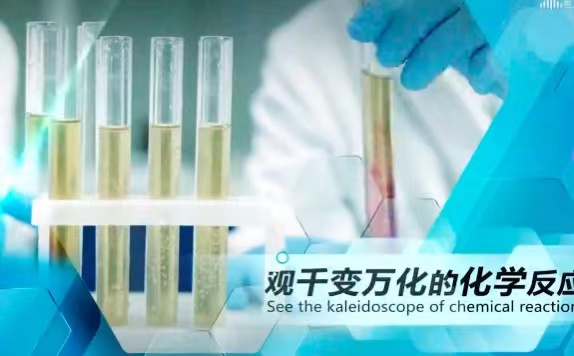
- 关于物质标准摩尔生成焓的描述,正确的是( )
- 下列化合物中,在水中溶解度最小的是 ( )

- 下列酸中为一元酸的是( )

- 下列元素中,第一电子亲和能最大的是 ( )
- 空间构型不是正四面体的配离子是 ( )
- 在氨水中不能将HCHO氧化的是 ( )
- SiCl4在潮湿空气中冒“白烟”,这是因为( )
- 反应X+2Y→Z是一个二级反应,下面的速率方程式中,肯定不对的是( )
- BeCl2分子中Be原子的杂化轨道类型是
- 某容器中盛有H2、N2、CO2和CH3OH的混合气体,各气体的质量相同,则哪种组分气体的压力最大?( )
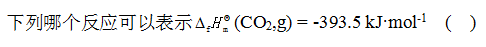
- 为了使某种离子沉淀得很完全,所加沉淀剂越多,则沉淀得越完全。
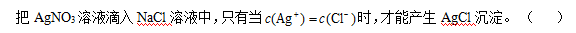
- NaCl、MgCl2、AlCl3三种物质的熔点依次降低,表明键的共价程度依次增大。( )
- 钴(Ⅲ)盐不稳定而其配离子稳定,钴(Ⅱ)盐则相反。
- 热的NaOH溶液与过量的硫粉反应可生成Na2S2O3。( )
- 金属的最典型、最常见的三种晶体结构类型有()。
- 正八面体场中,d轨道能级分裂为两组,其中能量较低的一组称为t2g,包括下列哪些轨道()
- 氨、联氨和羟胺具有的共同性质是( )
- E θ (Cu2+/CuI2-) 与 E θ (Cu2+/Cu+)相比:
- 在下列化合物中,属于杂多酸盐的是( )
- 对下列单质有关性质判断正确的是( )
- 3. 对于Zn2+/Zn电对,增大Zn2+的浓度,则其标准电极电势将:
- 下列有关分子轨道的叙述中错误的是( )
- 下列离子中,半径最小的是 ( )
- 下列各对物质在酸性溶液中能共存的是( )
- 下列化合物中,其水溶液的pH值最高的是( )
- 加热分解可以得到金属单质的是( )
- 下列分子中,空间构型为V形的是( )
- 下列分子或离子中,属于平面三角形的是( )
- 分子筛是一类多孔性的( )
- 下列各物质按照酸性排列正确的是( )
- 在水分子之间存在的各种相互作用由强到弱的顺序是( )。
- 在质量摩尔浓度为2.00mol·kg-1的水溶液中,溶质的摩尔分数为()
- 下列因素会导致纯液体饱和蒸汽压改变的有:()
- 反应A2+B2→2AB的速率方程为v=kc(A2)c(B2),此反应( )
- 下列试剂中可用于鉴定Ni2+存在的是( )
- 当体系放出了60kJ热,并对环境做了40kJ功,则体系热力学能减少100J。
- PH3和 AsH3三种分子中键角最大的是AsH3。
- 价层电子对互斥理论推测NH4+的几何形状是四面体。
- 强电解质在溶液中都是全部离解的,故离解度为100%。 ( )
- HgCl2为直线型分子,其中心金属原子以sp杂化轨道形式成键。
- HAc和NaAc 1:1的混合溶液加水稀释,其pH值基本保持不变。 ( )
- 不确定原理表明,同时准确测定电子的位置和运动速率是不可能的。
- 催化剂不影响化学平衡。
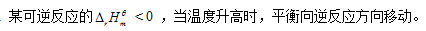
- 因为镧系收缩,第六周期元素的原子半径全比第五周期同族元素半径小。
- 在[Cu(CN)4]2-溶液中通入H2S气体,不生成Cu2S黑色沉淀;而向[Ag(CN)2]-溶液中通入H2S气体,则能生成Ag2S黑色沉淀。
- 19号元素基态原子的E4s大于E3d。
- SO2和CO2的中心原子杂化轨道类型是sp2和sp。
- 浓度为10-9 mol·L-1 的HCl溶液中,pH为9。 ( )
- [Fe(CN)6]3-是内轨型配合物,呈反磁性,磁矩为0。()
- 配合物的化学键理论主要有哪些()。
- 某反应的活化能Ea越大,速率系数k越小,温度升高,k变 ( ),反应物浓度增大,k ( )
- 下列分子中,具有配位键的是( )
- 下列有关分子轨道理论和杂化轨道理论的叙述中,正确的是( )
- 下列关于状态函数描述不正确的是:( )
- 下列分子为顺磁性的是( )

- SrCO3在下列溶液中溶解度最大的是( )。
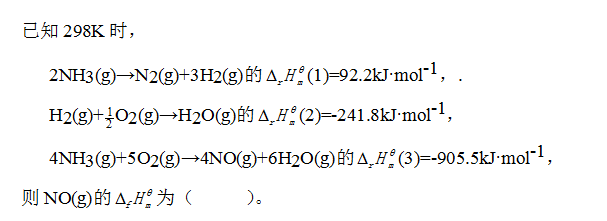
- BaSO4在NaNO3溶液中的溶解度比在纯水中的大,原因是( )。
- Al3+可与EDTA形成( )
- 下列质量分数为5%的溶液:A. 蔗糖(C12H22O11);B.葡萄糖(C6H12O6);C. 乙二醇 (C2H6O2);D. NaCl溶液;溶液蒸气压由高到低排列顺序为:( )

- 升高同样温度,一般化学反应速率增加倍数较多的是( )
- pH为1.0和pH为3.0的两种强酸的水溶液等体积混合之后,溶液的pH值为( )
- 以电对Fe3+ /Fe2+ 为正极,Cu2+/Cu为负极组成原电池,电动势为EMF1,将氨水加入Cu2+/Cu电极后,测得电动势为EMF2,可推断:
- 不影响反应速率系数的因素是( )
- 已知下列各晶体:NaF、SeN、TiC、MgO,它们的核间距相差不大,试推测并排出这些化合物熔点高低、硬度大小的次序( )。
- 在20oC和101.325kPa下,10.0L某气体的质量为50.0g,则它的摩尔质量为 ( )
- PCl5的分解反应:PCl5(g) = PCl3(g) + Cl2(g),2000C达到平衡时有48.5%分解,3000C达到平衡时有97%分解。则下列说法正确的是( )
- 下列关于配合物的叙述中错误的是( )。

- 某一化学反应,正反应速率系数为k1,逆反应速率系数为k2,当加入催化剂时,将会导致( )
- 用来描述气体状态的四个物理量分别是(用符号表示)()
- 下列说法正确的是 ( )
- 在金属晶体的面心立方堆积中,金属原子的配位数为( )。

- 某溶剂在海南海边和云贵高原的沸点分别为T1和T2,则:( )
- 某容器中充有28g N2和44g CO2, 在273K下混合气体的总压力为101.325kPa,则N2的体积为 ( )
- 测得某金属离子所形成的八面体配合物的磁矩,有5.9B.M.,也有1.7B.M.。则该金属离子最可能是下列中的()。
- 下列叙述错误的是( )。
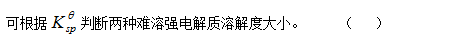
- 用NaOH中和pH相同、体积相等的HAc和HCl溶液,所需NaOH的量相等。 ( )
- 电子出现概率的大小决定于概率密度和体积,因此概率密度大,概率不一定大。
- 同族元素金属的活泼性是随着原子序数的增大而增大。
- 四面体配合物大多是低自旋配合物。()
- 所有硫化物沉淀都能溶于强酸中。
- 取向作用只存在于极性分子之间。( )
- ClO3-在碱性溶液中的氧化性弱于在酸性溶液中的氧化性。

- 价层电子对互斥理论推测,CO2、BeCl2、HgI2均具有直线形构型。
- 在氧化还原反应中,氧化值降低的物种是还原剂。
- 凡中心原子采用sp3杂化轨道成键的分子,其几何构型皆是正四面体。
- 价电子为ns2的元素都是碱土金属。( )
- 电极反应的配平系数不同,不影响其电对的Eθ。
- 24号元素的电子排布式为 [Ar]3d54S1
- 根据酸碱质子理论,水是两性物质。 ( )
- 在多电子原子中,钻穿效应造成能级交错。
- 标准电极电势表中的标准电极电势都是相对值。
- 立方晶系包括的布拉维晶格有()。
- 根据组成晶体的粒子的种类及粒子之间作用力的不同,将晶体分

- 将物质的量浓度相等的NaOH和HAc溶液等体积混合后,混合液中有关离子的物质的量浓度间确定存在的关系是_x001f_( )
- F2、Cl2、Br2、I2的熔点、沸点依次升高的原因是由于( )依次增强所导致的结果。

- 下列分子中,中心原子采取sp2杂化的是:
- 对于反应 I2 + 2ClO3- = 2IO3- + Cl2 ,下列说法不正确的是:
- 酸碱质子理论认为,下列物质中全部是酸的是( )
- 按照标状态的规定,下列物质不处于标状态的是:()
- 对于溶液中无固态物质的反应,标准态含义正确的是 ( )。
- 欲使Mg(OH)2溶解,可加入( )。
- 下列各组化合物在水中溶解度大小顺序中错误的是( )。
- 向HAc溶液中加一些NaAc,会使( )
- 对基态原子来说,在主量子数n=2的电子层中,最多能容纳8个电子,所根据的原理是( )
- 某反应的活化能Ea值为190 kJ mol-1,设加入催化剂以后,活化能Ea降为136 kJ mol-1,设加入催化剂前后指数前因子A值保持不变,则在773K时,加入催化剂后反应速率常数k¢是原来k值的多少倍 ( )
- 已知[Co(NH3)6]3+的μ= 0 ,则下列叙述中错误的是( )。
- 溴的水溶液和丙酮的反应方程式为:CH3COCH3+Br2→CH3COCH2Br+HBr,此反应对于溴来说是零级反应,由此可以推断出( )

- 判断氧化还原反应进行的方向可依据:
- 将HClO4、HI、HCl、HNO3放入下列溶剂中,具有区分效应的溶剂是( )
- 若把某基态原子核外电子排布写成1s22s22p63s23p04s2时,则违背了下列哪条原理:

- 某一族元素都是金属,其原子最外层只有一个l=0的电子,且可呈现+1以外的氧化值。根据以上情况,该族元素属于( )
- 下列气体在相同条件下,哪种气体偏离理想气体行为最多?( )
- 下列四种络合物中,d-d跃迁能量最低的是()。
- 弱酸的强度主要与它在水溶液中的哪一种数据有关( )
- 下列溶液的沸点与0.36%的葡萄糖(相对分子质量为180)溶液近似相等的是: ( )
- 一个2p电子可能被描述为下列六套量子数之一:① 2,1,1,+1/2 ② 2,1,1,-1/2③ 2,1,0,+1/2 ④ 2,1,0,-1/2⑤ 2,1,-1,+1/2 ⑥ 2,1,-1,-1/2氧的四个2p电子可能的各套量子数是:
- 下列说法不正确的是:( )
- 若体系经过一系列变化又回到初始状态,则体系( )
- 一反应物在某条件下的最大转化率为50%,若在相同条件下,加入正催化剂,则它的转化率将( )
- 已知在298K时,H2(g)与O2(g)反应生成1.0molH2O(l)和1.0molH2O(g)的反应热分别为-285.8kJ·mol-1和-241.8kJ·mol-1,则H2O(l)→H2O(g)的反应热为( )
- 下列叙述中,正确的是( )
- 两种溶液,一种为3.6克葡萄糖(C6H12O6)溶于200克水中, 另一种为20克未知物溶于500克水中,这两种溶液在同温度下结冰,则未知物的摩尔质量为:( )
- 下列离子中,极化率最大的是( )。
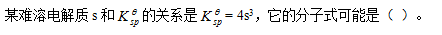
- 下列电对的电极电势E值随介质H+浓度的增大而增大的是 :
- 加入稀HCl溶液,两种离子均能生成沉淀的是 ( )
- 硝酸银极易溶于水,它是所有固体物中在水中溶解度最大的。
- 将Cu(OH)2持续加热,最终的产物是( )
- 向Hg2(NO3)2溶液中加入NaOH溶液,生成的沉淀是( )
- 向Hg2(NO3)2溶液中滴加氨水时,生成物的颜色为( )
- 欲除去ZnSO4溶液中所含有的少量CuSO4,应选用下列物种中的( )
- 水溶液中,铬、钼、钨都是高氧化态的化合物稳定,都可以形成同多酸或杂多酸,其它副族元素无此共性。
- 欲使软锰矿(MnO2)转变为K2MnO4应选择的试剂是( )
- 在酸性介质中,Ti(IV)的存在形式是 ( )
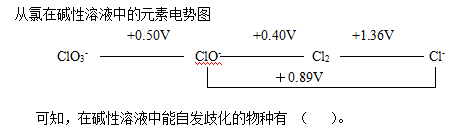
- 从锰在酸性溶液中的元素电势图判断下面离子中可自发歧化的是( )
- 金属铪能溶于下列哪中酸 ( )
- 下列关于铁系元素的叙述中下确的是( )
- KMnO4溶液需存放在棕色瓶中,原因是光照下能反应生成 K2MnO4与O2。
- 溴和碘都能与磷作用,反应生成物分别为( )
- 卤素单质中,与水不发生水解反应的是( )
- 卤素的氧化物中,热稳定性最高的是( )

- XeF2与H2O2的反应产物是 ( )
- 在周期表中氡(Rn原子序数86)以下的另一个未发现的稀有气体元素的原子序数应是 ( )
- 下列各对试剂混合后能产生氯气的是( )
- 下列物质中,酸性最强的是( )
- 磷的同素异形体常见的有白磷、红磷、黑磷;其中最活泼的是白磷,分子式为P4。
- 在砷、锑、铋的硫化物中,能溶于Na2S的是砷、锑。
- H3PO3为二元酸,H3PO4为三元酸,H4P2O7为四元酸,酸性由弱到强依次为H3PO4 < H3PO3>
- 下列各组硫化物中,难溶于稀盐酸,但能溶于浓盐酸的是( )
- B2H6和C2H6分子中,中心原子B和C都是采取sp2的杂化方式,分子的空间构型也一样。( )
- Sn(Ⅳ)比Sn(Ⅱ)的化合物稳定,而对铅来说,则Pb(Ⅱ)比Pb(Ⅳ)的化合物稳定。( )
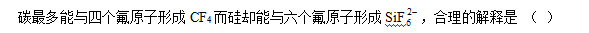
- 关于硼化合物的下列说法中正确的是 ( )
- 金属离子的极化作用愈强,其碳酸盐的分解温度就愈低,即碳酸盐愈不稳定。( )
- 关于硼和铝的卤化物的下列叙述中错误的是( )
- 天然硅酸盐的基本结构单元是( )
- SiO2为原子晶体,而固态CO2则为分子晶体。( )
- 石墨可以作润滑剂,是由于在石墨晶体中层与层之间存在( )
- 碱金属氢氧化物碱性强弱的次序为:LiOH < NaOH>
- 下列成对元素中化学性质最相似的是 ( )
- 在下列卤化物中,共价性最强的是 ( )
- 含有Ca、Mg的水叫做硬水。( )
- N2只能与碱土金属直接作用形成氮化物。( )
- 下列化合物用煤气灯火焰加热时,其分解产物不是氧化物、二氧化氮和氧气的是 ( )
- 由于s区元素的电负性小,所以都形成典型的离子型化合物。( )
- 碱金属和碱土金属很活泼,因此在自然界中没有它们的游离状态。( )
- 金属钙在空气中燃烧生成 ( )
- 下列碳酸盐中最易分解为氧化物的是 ( )
- [Fe(H2O]6]2+是外轨型配合物,则中心离子未成对电子数和杂化轨道类型是()。
- K3[FeF6]和K3[Fe(CN)6]都是呈顺磁性。
- 下列关于晶体场理论的斜述中,错误的是( )。
- 不论配合物的中心离子采取d2sp3或是sp3d2杂化轨道成键,其空间构型均为八面体。
- 价键理论认为,所有中心离子(或原子)都既能形成内轨型配合物又能形成外轨型配合物。
- 在八面体配合物中d电子从4—7时,强场和弱场具有相同的电子排布。
- 晶体场分裂能越大越易形成高自旋络合物。
- 某一晶体场的△ > P,则()。
- 已知[Ni(NH3)4]2+的μ= 2.8 B.M.,则中心离子的杂化轨道类型和配合物空间构型为()。
- 晶格的基本单元叫晶胞,晶胞在空间堆积形成晶体,所以晶格就是晶体。
- 金属键不是共价键,也不是离子键,而是一种特殊的离域共价键。
- 色散作用只存在于非极性分子之间。
- 下列物质中,熔点最低的是( )。
- 离子极化作用的大小取决于离子的极化力和变形性。
- 下列晶体中晶格结点间作用力以分子间作用力为主的是( )。
- 稀有气体是由原子组成的,但它们不属于原子晶体。
- 下列哪个分子的偶极矩不等于零( )。
- 熔化下列晶体,需要破坏共价键的是( )。
- NO3-离子的几何构型为( )
- 对于一个反键分子轨道,下列叙述中正确的是( )
- 按照价层电子对互斥理论推测,SiCl4、NH4+和BF4-的几何形状应该相同,都是四面体。
- SP3杂化轨道是由1S轨道和3P轨道混合形成四个SP3杂化轨道。
- 价层电子对互斥理论推测,CO2、BeCl2、HgI2、SnCl2均具有直线形构型。
- 下列键参数中可以描述共价键的离子性程度的是( )
- 下列分子中键角最大的是( )
- 下列分子或离子中为反磁性的是( )
- 中心原子价层中孤对电子的存在,对分子的键角有影响,可使键角减小。
- 分子轨道的中成键分子轨道能级低于相应的原子轨道
- 下列各量子数合理的是:( )
- 波函数是描述核外电子空间运动状态的函数式,每个波函数代表电子的一种空间运动状态。
- 元素的电离能越小,其金属性越弱。
- 下列离子中,半径最小的是 ( )
- 在同一原子中,绝不可能有两个电子的运动状态完全相同。
- 电子的钻穿能力越强,轨道的能量就越低。
- 元素周期表中第五、六周期的ⅣB、ⅤB、ⅣB族中各元素性质非常相似,这是由于 ( )
- 在多电子原子中,核外电子的能级只与主量子数n有关,n越大,能级越高。
- 估计一电子受屏蔽的总效应,一般要考虑下列哪一种情况电子的排斥作用 ( )
- 下列元素中,第一电离能最大的是( )
- 因为H2O2 的氧处在中间价态,所以 H2O2 参与电极反应时,溶液的酸碱度与该电极反应毫无关系。
- 氧化还原反应达平衡时,标准电动势和标准平衡常数都为零。
- 下列氧化剂中,氧化性随溶液中氢离子浓度的增大而增强的是( )。
- 氧化还原电对的标准电极电势越高,表示该电对的氧化态氧化还原能力越强。
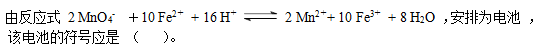
- 能组成原电池的反应都是氧化还原反应。
- 同种金属与其盐溶液也能组成原电池,其条件是两个半电池中离子浓度不同。
- 向原电池(-)Zn|Zn2+(1mol·L-1)||Cu2+(1mol·L-1)|Cu(+)的正极溶液中通入H2S气体,则原电池的电动势( )。
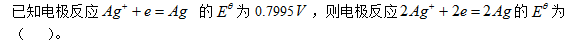
- 所谓沉淀完全,就是指溶液中这种离子的浓度为零。 ( )
- 对含有多种可被沉淀离子的溶液来说,当逐滴慢慢加入沉淀试剂时,不一定是浓度大的离子首先被沉淀出来。 ( )
- 以MnO2为原料制得的MnCl2溶液中常含有Cu2+、 Pb2+ 、Cd2+等金属离子,通过添加过量难溶电解质MnS可使这些金属离子转化为硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。可推知MnS具有的性质是( )。
- 用水稀释CaCO3的饱和溶液后,CaCO3的溶度积不变,溶解度增大。 ( )
- BaSO4和PbBr2的溶度积非常接近,皆约为10-8,故两者饱和溶液中,Ba2+及Pb2+离子的浓度近似相等。 ( )
- 为使沉淀损失减小,洗涤AgCl沉淀时不用蒸馏水,而用稀HCl。 ( )
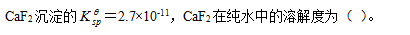
- 下列哪种原因可减少沉淀的溶解度( )。
- 在一定温度下,向PbI2饱和溶液中加水,下列叙述正确的是( )。
- 向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡沉淀变为黄色,再滴入一滴Na2S溶液并振荡沉淀变为黑色。则三种沉淀的溶解度关系为( )。

- 0.10mol·L-1弱酸溶液的pH是等于1。 ( )
- 酸碱反应的方向是强酸与强碱反应生成弱酸和弱碱。 ( )
- 相同浓度的下列盐溶液的pH值,由小到大的顺序是NaA NaB NaC NaD (A. B. C. D都为弱酸根),则各对应酸在同浓度同温度下,离解度最大的酸是( )
- 对于弱电解质溶液,同离子效应使其离解度减小,盐效应使其离解度增加。 ( )
- H2S水溶液中,最多的粒子是(H2O分子除外)( )
- 在多元弱酸的稀溶液中,其酸根的浓度近似等于其最后一级的离解平衡常数。 ( )
- 含有0.10 mol·L-1 HCl 的 0.10 mol·L-1 HAc溶液中,表示正确的是( )
- 1 mol·L-1 NaOH溶液里比1 mol·L-1 的NH3水中( )
- 用HCl溶液中和pH相同、体积相等的Ba(OH)2和NaOH溶液,所需HCl的量相等。( )
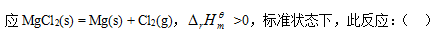
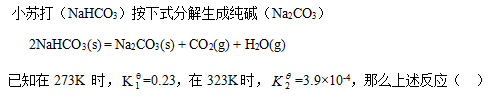
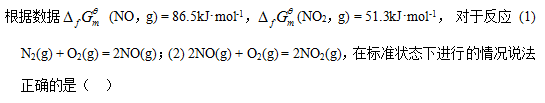
- 298 K时查得C (金刚石)的绝对熵为2.43 J·mol-1·K-1 ,则C (石墨)的绝对熵为零。
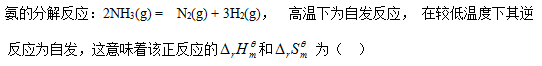
- 熵减小的反应(或过程)是( )
- 某化学反应在任何温度下都不能正向进行,则该反应的Δ H < 0>
- 体系中的自发过程必然是一个熵增的过程。
- 在298.15K和标准态时,下列反应均为非自发反应,其中在高温下仍为非自发反应的是( )
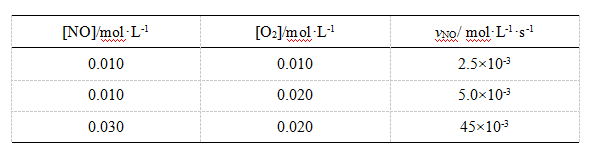
- 生物化学工作者常将37℃时的速率常数与27℃时的速率常数之比称为Q10。若某反应的Q10为2.5 , 则它的活化能(kJ·mol-1)为( )
- 下列叙述中正确的是( )
- 二级反应的速率系数k是( )
- 升高温度可以增加化学反应速率,主要是因为 ( )
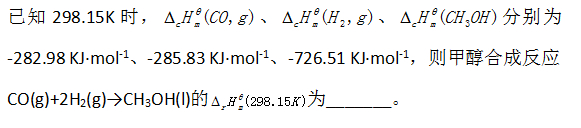


- 对于催化剂特性的描述,不正确的是( )

- 当体系放出了60kJ热,并对环境做了40kJ功,则体系热力学能减少100kJ。
- 同一体系在相同状态时,不可能有不相同的热力学能值。
- 热力学能U和焓H的绝对值不测定;但其变化值可测定。
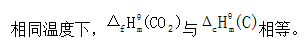
- 循环系统的∆U、∆H、∆Q均为0。
- 对于敞开系统而言,系统会有物质的交换,也有能量的交换。
- 下列物理量中不是状态函数的是 _______。
- 对于气体,热力学上的标准态是指_______。
- 反应N2(g) + 3H2(g) ─→ 2NH3(g)和1/2N2(g) + 3/2H2(g) ─→ NH3(g)在标准状态下反应的标准摩尔焓变相同。
- 下列纯态单质中,哪些单质的标准摩尔生成焓等于零:
- 质量摩尔浓度均为0.050 mol·kg-1的NaCl溶液,H2SO4溶液,HAc溶液,C6H1206(葡萄糖)溶液,蒸气压最高的是( )

- 将一定量的 He 与一定量的 Ar 放在一个密闭容器中混合均匀,在温度不变时,此混合气体的总压力为 ( )
- 关于溶液浓度表示方法,下面表述不正确的是( )
- 工业上利用加压膜技术进行溶液浓缩,是利用反渗透技术技术。
- 现有两溶液:A为0.1 mol·kg-1 氯化钠溶液;B为0.12mol·kg-1氯化钠溶液,下列说法正确的是:( )
- 乙二醇水溶液的凝固点( )
- 在相同体积,相同压力和相同温度下,两种气体的摩尔质量分别为M1和M2,M1 > M2,则( )
- 下列哪种条件下,真实气体接近于理想气体?( )
- 稀溶液在蒸发过程中,溶液的沸点不断升高直至溶液达到饱和。
答案:错
答案:错
答案:对
答案:对
答案:对
答案:对
答案:错
答案:错
答案:对
答案:错
答案:对
温馨提示支付 ¥5.00 元后可查看付费内容,请先翻页预览!