- 纯溶剂中加入非挥发性溶质后,沸点升高。该溶液中溶剂的化学势比未加溶质前降低。( )
- 原电池的负极是阳极,发生氧化反应。( )
- 表面活性剂具有增溶作用,增溶作用等同于溶解作用。( )
- Cp,m 恒大于 CV,m。( )
- 理想气体经可逆与不可逆两种绝热过程可以到达相同的终态。( )
- 在298K时,0.01mol/kg 糖水的渗透压与0.01mo/kg食盐水的渗透压相等。( )
- 若算得电池反应的电池电动势为负值时,表示此电池反应是逆向进行。 ( )
- 对于孤立系统中发生的实际过程,系统的ΔS > 0。( )
- 二组分理想溶液的总蒸气压大于任一组分的蒸气分压。( )
- 在同一理想稀溶液中组分B的浓度可用 xB, mB, cB 表示,其标准态的选择不同,则相应的化学势也不同。( )
- 同一固体, 大块颗粒和粉状颗粒, 其溶解度一样大。( )
- 溶液的化学势等于溶液中各组分的化学势之和。( )
- 已知水的下列 5 种状态:(1) 373.15 K, p$,液态 ;(2) 373.15 K,2p$,液态 ;(3) 373.15 K,2p$,气态;(4) 384.15 K, p$,液态 ;(5) 384.15 K, p$,气态 。下列 4 组化学势的比较,正确的是 ( )
- 对于一定量的理想气体,下列过程可能发生的是: ( )
- 封闭体系从A态变为B态,可以沿两条途径:①等温可逆膨胀;②等温不可逆膨胀。则下列关系式正确的是: ( )
- 液体的表面自由能可以表示为: ( )

- Mg3(PO4)2的化学势m 与Mg2+, PO43-的化学势m+ , m_之间的关系为( )
- 理想气体在等温条件下反抗恒定外压膨胀,该变化过程中体系的熵变ΔSsys 及环境的熵变ΔSsur 应为: ( )
- 在298 K、标准压力下,苯和甲苯形成理想液体混合物,第一份溶液体积为2 dm3,苯的摩尔分数为0.25,苯的化学势为μ1,第二份溶液的体积为1 dm3,苯的摩尔分数为0.5,化学势为μ2,则: ( )
- 能在毛细管中产生凝聚现象的物质是由于该物质的液体在毛细管中形成:(1) 凸面 (2) 凹面 (3) 平面其在毛细管内液面上的饱和蒸气压 p:(4) 大于平面的 (5) 等于平面的 (6) 小于平面的正确的答案是: ( )
- 在某温度下,当B溶解于A中形成溶液时,若纯B的摩尔体积大于溶液中B的偏摩尔体积时,设B的偏摩尔体积大于零。若增加压力,则B在A中的溶解度将: ( )
- 弱电解质溶液的摩尔电导率随溶液浓度的减小而增大的主要原因是( )
- 往液体 (1) 的表面滴加一滴与其不互溶的液体 (2),两种液体对空气的表面张力分别为 g 1, 3 和g 2, 3,两种液体间的界面张力为 g1, 2 。则液体 (2)能在液体 (1) 上铺展的条件为:( )
- 在 298 K 时,A和B两种气体单独在某一溶剂中溶解,遵守亨利定律,亨利常数分别为 kA和 kB,且知 kA> kB,则当 A 和 B 压力(平衡时的)相同时,在一定量的该溶剂中所溶解的关系为: ( )
- 在等温等压下,将某液体可逆地增加一定的表面积,以下正确的是( )
- 对于理想气体,下述结论中正确的是: ( )
- AgBr(s)在纯H2O和质量摩尔浓度都是0.1mol·kg-1 的下列电解质溶液中: (1) NaNO3 ; (2) NaI ; (3) Cu(NO3)2 ; (4) NaBr ; (5) H2O, 则按AgBr(s)溶解度由小到大排列的次序是( )
- 将 1 mol 甲苯在 101.325 kPa,110 ℃(正常沸点)下与 110 ℃的热源接触,使它向真空容器中气化,完全变成 101.325 kPa 下的蒸气。该过程的: ( )
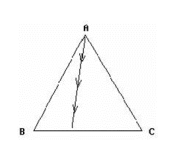
- 自然界中,有的高大树种可以长到 100 m以上,能够提供营养及水位到树冠的主要动力是什么?( )
- 乙醇水溶液的表面张力 g = (72 - 0.5a + 0.2a2) mN·m-1,若表面超额 G > 0,则活度: ( )
- 天空中的水滴大小不等, 在运动中, 这些水滴的变化趋势如何? ( )
- 有一飘荡空气中的肥皂泡,其直径为2×10-3m,在298K时,肥皂水的表面张力为0.05 N·m-1,则肥皂泡所受到的附加压力为 ( )
- 在某液体中加入表面活性物质后,则该液体的表面张力将 ( )
- 理性气体真空绝热膨胀后,它的温度将( )
- 某一物质X,三相点时的温度为293K, 压力为200kPa。下列说法不正确的是( )
- 使用盐桥,将反应 Fe2++Ag+ = Fe3++Ag 设计成的自发电池是: ( )
- 体温计打碎后,落在水泥地面上的水银基本呈球形,这说明: ( )
- 在一给定系统中,物种数可以因分析问题的角度的不同而不同,但独立组分数是一个确定的数。( )
- 稀溶液中溶质的化学势 , 式中是在温度T 和压强 p下,xB=1的真实态的化学势。
- 对于纯组分,则化学势等于其自由能。( )
- 任何纯物质的蒸发、熔化、升华等两相平衡系统都可以用Clausius-Clapeyron方程。( )
- 在263 K的过冷水凝结成263 K的冰, 则系统的ΔS < 0>
- 状态给定后,状态函数就有定值;状态函数固定后,状态也就固定了。( )
- 因为DU= QV,DH= Qp,,所以QV, Qp 是特定条件下的状态函数。
- 恒温过程一定是可逆过程。( )
- 状态函数改变后,状态一定改变。( )
- 在等压下,机械搅拌绝热容器中的液体,使其温度上升,则DH= Qp=0。( )
- 苯的沸点为80.1℃,环已烷的沸点为80.73 ℃,利用精馏可以有效实现两者完全分离。( )
- 二氧化碳的固液平衡线的斜率dp/ dT 值大于零。( )
- 恒温恒压下,将一液体分散成小颗粒液滴,该过程液体的熵值增大。( )
- 对于二组分体系,依据相律,恒沸混合物的沸点随外压的改变而改变。( )
- 在二组分理想液态混合物的相图中,气液两相平衡区的物系点是真实存在的相点。( )
- 偏摩尔量的值可以是正值,也可以是负值,也可以是零。( )
- 理想气体绝热变化过程中,W可逆 = CVDT,W不可逆 = CVDT,所以W绝热可逆 = W绝热不可逆。( )
- 不可能把热从低热源体吸出发给高温热源。( )
- 下列函数中为强度性质的是:( )
- 在标准压力p$下, 383.15 K 的水变为同温下的蒸气,吸热 Qp。该相变过程中,下列关系式是正确的有 ( )
- 理想气体的物质的量为 n ,从始态 A(p1,V1,T1) 变化到状态 B(p2,V2,T2) ,其熵变的计算公式可用:( )
- 下述各体系在等温等压过程中熵值减少的是: ( )
- 对于孤立体系中发生的实际过程,下列关系中正确的是: ( )
- 在 p$下,C(石墨) + O2(g)→ CO2(g) 的反应热为ΔrHm$ , 下列哪些是正确的?( )
- 将某理想气体从温度 T1 加热到 T2 。若此变化为非恒压过程,则其焓变 ΔH 应为何值? ( )
- 有三个大热源,其温度T3>T2>T1,现有一热机在下面两种不同情况下工作: (1) 从T3热源吸取 Q 热量循环一周对外作功W1,放给T1热源热量为(Q - W1) ;(2) T3热源先将 Q 热量传给 T2 热源,热机从 T2 热源吸取 Q 热量循环一周, 对外作功W2,放给T1热源 (Q -W2) 的热量 。则上述两过程中功的大小为: ( )
- 有两个电池,电动势分别为E1和E2:(1)Pt ︱H2(p$) ︱KOH(0.1mol·kg-1) ︱O2(p$) ︱Pt E1(2)Pt ︱H2(p$) ︱H2SO4(0.01mol·kg-1) ︱O2(p$) ︱Pt E2在相同温度下,两个电动势的关系为( )
- 1 mol 理想气体在室温下进行恒温不可逆膨胀 (Q = 0 ),使体系体积增大一倍,则ΔS体系,ΔS环境,ΔS隔离 (单位皆为 J·K-1·mol-1)为 : ( )
- 热力学第三定律可以表示为: ( )
- 水银完全不润湿玻璃表面,若将半径为 5×10-5 m 的玻璃毛细管插入水银中 (水银的密度 r = 13.6×103 kg·m-3,其表面张力g = 0.520 N·m-1),管内水银面将: ( )
- 用德拜-休克尔极限公式,计算298K时 0.01mol kg-1 的 NaNO3 和 0.001 mol kg-1 的 Mg(NO3)2 的混合溶液中 NaNO3 的平均活度系数为( )
- 戊烷的标准摩尔燃烧焓是 -3520 kJ·mol-1,CO2(g) 和 H2O(l) 的标准摩尔生成焓分别是 -395 kJ·mol-1和 -286 kJ·mol-1,则戊烷的标准摩尔生成焓为: ( )
- 在电极分类中,何者不属于氧化-还原电极? ( )
- 10 mol 单原子理想气体,在恒外压 0.987p$ 下由400 K, 2p$ 等温膨胀至0.987p$ , 系统对环境作功为( )。
- 在0℃到100℃的范围内,液态水的蒸气压 p 与 T 的关系为:lg(p/Pa)=-2265/T+11.101 ,某高原地区的气压只有59 995 Pa,则该地区水的沸点为: ( )
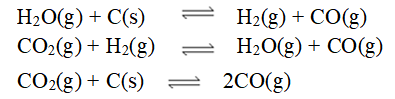
- 在空间轨道上运行的宇宙飞船中,漂浮着一个足够大的水滴,当用一根内壁干净、外壁油污的玻璃毛细管接触水滴时,将会出现: ( )
- 两液体A和B表面张力gA=3gB,密度rA=3rB,一毛细管插入A中液面上升2.0 cm,若将其插入B中液面上升的高度为: ( )
- 1 mol单原子分子理想气体,从始态p1= 202650 Pa、T1= 273 K,沿着 p/V=常数 的途径可逆变化到终态为 p2=405300 Pa,则ΔH 为 ( )
- 液体在毛细管中上升的高度与下列那一个因素无关: ( )
- 压力为106 Pa的 2 m3 理想气体进行绝热自由膨胀,直至体系压力达到5×105 Pa时为止。此变化中,该气体做功为 ( )
- 已知苯―乙醇双液体系中,苯的沸点是353.3 K,乙醇的沸点是351.6 K,两者的共沸组成为:含乙醇47.5%(摩尔分数),沸点为341.2 K。今有含乙醇77.5%的苯溶液,在达到气液平衡后,气相中含乙醇为y2,液相中含乙醇为x2。则两者的关系为: ( )
- 在 298 K 时,向甲苯的物质的量分数为 0.6 的大量的苯-甲苯理想溶液中,加入1 mol纯 苯,这一过程苯的 ΔG, ΔH, ΔS 为 ( )
- 在抽空容器中放置NH4Cl( s ), NH4Cl( s )部分分解为NH3( g )和 HCl( g )达平衡,其组分数,相数,自由度数为:( )
- 298 K时,石墨的标准摩尔生成焓Δf Hm$: ( )
- 在298K 时,向xA= 0.6的大量的A和B组成的理想溶液中,加入1 mol A,这一过程A的 ΔG为:( )
- 通过电动势的测定,可以求难溶盐的活度积,今欲求 AgCl 的活度积,则应设计的电池为 ( )
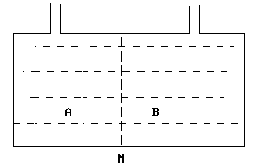
- 当用三角形坐标来表示三组分物系时,若某物系其组成在平行于底边BC的直线上变动时,则该物系的特点是: ( )
- 两只烧杯各有 2 kg水,向 A 杯中加入 0.01 mol 葡萄糖,向 B 杯内溶入0.01 mol KCl,两只烧杯按同样速度冷却降温,则有 ( )
- 硫酸与水可形成H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s)三种水合物, 问在 101 325 Pa 的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多有几种? ( )
- 凡是在孤立体系中进行的变化,其 ΔU 和ΔH 的值一定是:( )
- 已知纯水中 [H+]=[OH-]=10-7mol·dm-3,Lm∞(H2O)=5.5×10 -2 S·m2·mol-1 ,计算出纯水的电导率为( )
- 吉布斯自由能判据可以写作: ( )
- 体系经历一个不可逆循环后 ( )
- 已知 373.15 K 时,液体 A 的饱和蒸气压为 133.32 kPa,另一液体 B 可与 A 构成理想液体混合物。当 A 在溶液中的物质的量分数为 1/2 时,A 在气相中的物质量分数为2/3 时,则在373.15 K时,液体 B 的饱和蒸气压应为: ( )
- 为马拉松运动员沿途准备的饮料应该是哪一种? ( )
- 当表面活性物质加入溶剂后,所产生的结果是: ( )
- 有一露于空气中的球形液膜,若其直径为 2×10-3 m ,表面张力为 0.7 N/m,则该液膜所受的附加压力为: ( )
- 在农药中通常都要加入一定量的表面活性物质, 如烷基苯磺酸盐, 其主要目的是: ( )
- 多孔硅胶的强烈吸水性能说明硅胶吸附水后,表面自由能将: ( )
- 下面说法不正确的是: ( )
- 两液体A和B表面张力gA=gB,密度rA=2rB,一毛细管插入A中液面上升2.0 cm,插入B中液面上升多少?(假定两液体皆完全润湿管壁) ( )
- 把细长不渗水的两张白纸互相靠近(距离为 d ),平行地浮在水面上,用玻璃棒轻轻地在两纸中间滴一滴肥皂液,两纸间的距离将 ( )
- 将一毛细管端插入水中,毛细管中水面上升 5 cm,若将毛细管向下移动,留了3 cm 在水面,试问水在毛细管上端的行为是( )
- 已知某溶质溶于水后,溶液表面张力g 与活度 a 的关系为:g = g0- Aln(1 + ba ),其中 g0为纯水表面张力,A、b 为常数,则此溶液中溶质的表面过剩G 与活度 a 的关系为: ( )
- 质量摩尔浓度为1.0mol·kg-1的 K4[Fe(CN)6] 溶液的离子强度为( )
- 298K时,H2SO4当溶液的质量摩尔浓度从0.01 mol·kg-1增加到0.1 mol·kg-1时,其电导率 k 和摩尔电导率 Lm 将( )
- 在一定温度和浓度的水溶液中,一般情况是带相同电荷的Li+, Na+, K+, Rb+,它们的离子半径依次增大,但其离子摩尔电导率恰也依次增大,这是由于( )
- Al2(SO4)3的化学势 m 与 Al3+, SO42- 的化学势 m+ , m_之间的关系为( )
- 第二类导体又称离子导体,下面对它的特点描述不确的是( )
- 如果规定标准氢电极的电极电势为1V,则可逆电极的标准还原电极电势j$和电池的标准电动势 E$ 将如何变化( )
- 使2000A的电流通过一个铜电解器,在1h内,能得到铜的质量( )
- 下列电池中,哪个电池的电动势与Cl-的活度无关?( )
- 下列描述正确的是( )

- 对三组分体系而言,体系最多可以有几个自由度? ( )
- 液态氨的饱和蒸气压与温度的关系为 ln(p/pa) = 24.38 – 3063/(T/K) ,氨的熔化热 ΔfusHm= 5.7 kJ· mol-1,则氨的摩尔升华热ΔsubHm为( )
- FeCl3与水可生成FeCl3·2H2O, FeCl3·5H2O, FeCl3·6H2O,和FeCl3·7H2O,四种固体水合物,则在一定温度下与水蒸气平衡的含水盐最多为 ( )
- 将固体 NH4HCO3(s) 放入真空容器中,恒温到 400 K,NH4HCO3 按下式分解并达到平衡: NH4HCO3(s) = NH3(g) + H2O(g) + CO2(g),则下列正确的为: ( )
- 298 K 时,蔗糖水溶液与纯水达渗透平衡时,整个体系的组分数、相数、自由度数为: ( )
- 某一固体,在25℃和大气压力下升华,这意味着:( )
- A和B两液体混合物在T-x图上出现最低点,则该混合物对拉乌尔定律产生 ( )
- 对恒沸混合物的描述,下列各种叙述中哪一种是不正确的? ( )
- 在相图中,当系统处于下列哪一点时,只存在一个相 ( )
- 已知373 K时,液体A的饱和蒸气压为133.24 kPa,液体B的饱和蒸气压为66.62 kPa。设A和B形成理想液态混合物,当A在溶液中的摩尔分数为0.5时,在气相中A的摩尔分数为( )
- 在298K和标准压力下,有2.0 dm3 I2的苯溶液,这时的化学势和Gibbs自由能分别为 m1 和 G1。现取出1.0 dm3,则I2的化学势和Gibbs自由能分别为 m2 和 G2。下面正确的是( )
- 含有非挥发性溶质B的水溶液, 在101325 Pa 下,270.15 K时开始析出冰,已知水的kf =1.86 K·kg·mol-1,kb= 0.52 K·kg·mol-1,该溶液的正常沸点是 ( )
- 设373 K和100 kPa时,H2O(g)的化学势为m1,373 K和50 kPa时,H2O(g)的化学势为m2。如果两者有如下四个关系式(1)m1$ = m2$ ; (2)m2 - m1 = RTln2 ; (3)m2 - m1 = - RTln2 ; (4)m2 = m1 – RTln0.5则这些关系中正确的是( )
- 某溶液由2 mol A和1.5 mol B混合而成,总体积为 0.42 dm3。该溶液中已知A的偏摩尔体积VA=0.03 dm3· mol-1 ,则组分B的偏摩尔体积VB为( )
- 在一定的温度和大气压力下,纯溶剂A的饱和蒸气压、化学势和凝固点分别为pA*、mA*、Tf*。加入少量非挥发性溶质后形成理想的稀溶液,A的蒸气压、化学势和凝固点分别为pA、mA、Tf,两者的关系为( )
- 温度273 K,压力为1×106Pa下液态水和固态水的化学势 m(l) 和之间 m(s) 的关系为( )
- 两只烧杯各有1kg水,向A杯中加入0.01 mol蔗糖,向B杯中加入0.01 mol NaCl,两只烧杯按同样速度冷却降温,则有:( )
- 下列各量中,属于偏摩尔量的是 ( )
- 下列偏微分中,不是化学势表示式的是( )
- 2 mol H2和 2 mol Cl2在绝热钢筒内反应生成 HCl 气体,起始时为常温常压。则:( )
- 系统达到平衡时,熵值最大,吉布斯自由能最小。( )
- 热力学第三定律可以表述为:在0℃时,任何完整晶体的熵等于零。( )
- 在270K 和大气压力下,一定量的过冷水凝结为同温同压的冰,则系统和环境的熵变分别为( )
- 封闭体系中,若某过程的ΔG = 0,应满足的条件是: ( )
- 从热力学基本关系式可导出 (¶U/¶S)V 等于: ( )
- 单原子分子理想气体的CV,m=3/2R,温度由 T1 变到 T2 时,等压过程系统的熵变 ΔSp 与等容过程熵变 ΔSV 之比为 ( )
- 纯液体苯在其正常沸点等温汽化,则: ( )
- 公式 dG = -SdT + Vdp 可适用下述哪一过程: ( )
- 对于不做非体积功的隔离系统,熵判据为:( )
- 理想气体在恒定外压 p$下,从 10 dm3 膨胀到 16 dm3 ,同时吸热126 J。计算此气体的ΔU 为 ( )
- 苯在一个刚性的绝热容器中燃烧,C6H6(l) + (15/2)O2(g)→6CO2(g) + 3H2O(g) ,下面正确的是( )
- 一定量的理想气体从同一始态出发,分别经如下两个过程到达相同压力的终态,(1)等温压缩,其焓变为ΔH1,(2)绝热压缩,其焓变为ΔH2,两者之间的关系为( )
- 有一高压钢筒,打开活塞后气体喷出筒外,当筒内压力与筒外压力相等时关闭活塞,此时筒内温度将 ( )
- 石墨(C)和金刚石(C)在298K、标准压力下的标准燃烧焓分别为-393.4 kJ/mol和 -395.3 kJ/mol,则金刚石的标准摩尔生成焓Df Hm$(金刚石,298 K)为:( )
- 当5 mol H2(g)和4 mol Cl2(g)混合,最后生成2 mol HCl (g)。若以下式为基本单元H2(g)+Cl2(g) =2 HCl (g)。则反应进度x 应是( )
- 对于理想气体的热力学能,有下述4种说法,其中不正确的是( )
- 系统发生了一个等温变化,系统与环境之间( )
- 某理想气体的 g =Cp/CV =1.40,则该气体为几原子分子?( )
- 本课程主要介绍化学热力学的基本原理及在相关领域的应用。
答案:对
答案:对
答案:错
答案:错
答案:错
答案:错
答案:对
答案:对
答案:对
答案:错
答案:错
温馨提示支付 ¥5.00 元后可查看付费内容,请先翻页预览!







