提示:内容已经过期谨慎付费,点击上方查看最新答案
基础化学
用过量AgNO3和少量KI作用制备AgI溶胶,其胶团结构式为( )
电子构型为[Ar]3d5可以表示 ( )
下列对电动电势ζ不正确的描述是( )
下列原子中半径最大的是( )
表面活性物质是 ( )
将体积较大的物质分散成粉末或细雾时,做功所消耗的能量转变为 ( )
反应速率常数随温度变化的阿仑尼乌斯经验公式适用于 ( )
n=3,l=2时,该亚层中原子轨道的空间取向和最多容纳的电子数分别为( )
体系对环境作20 kJ的功,并失去10 kJ的热给环境,则体系内能的变化是( )
萘燃烧的化学反应方程式为:C10H8(s)+12O2(g)=10CO2(g)+4H2O(l),则在298K时,Qp与QV的差值(kJ·mol-1)是( )
下列叙述中正确的是( )
估计一电子受屏蔽的总效应,一般要考虑电子的排斥作用的是( )
升高温度使反应速度加快的主要原因是( )
物理吸附的作用力是( )
某反应的反应热为ΔH=-100 KJ/mol,则该反应的活化能 ( )

量子力学中所说的原子轨道是( )
某反应,以log(-dc/dt)对logc作图得直线,如果该反应为二级,则直线的( )
- 雾属于分散体系,其分散介质是( )
在有AgCl固体存在的AgCl饱和溶液中,当加入等体积的下列溶液时,能使AgCl的溶解度增大的是( )
下列叙述中正确的是 ( )
下列哪种波函数ψ(n, l, m)表示3d轨道 ( )
已知下列两个热化学方程:
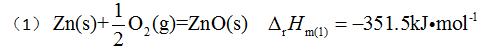
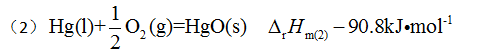 由此可知,反应
由此可知,反应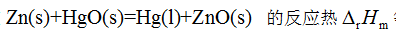 的反应热 等于 ( )
的反应热 等于 ( ) 25℃时NaCl在水中的溶解度约为6 mol·dm-3,若在1dm3水中加入1mol NaCl,则该过程的( )
若反应速率常数的量纲是:[浓度]·[时间]-1,则该反应是( )
氢原子的s轨道波函数 ( )

下列说法中正确的是 ( )
对于一个给定条件下的反应,随着反应的进行 ( )
对一级反应,反应物浓度c与时间t的关系是( )
将含0.012 mol·dm-3 NaCl和0.02 mol·dm-3 KCl的溶液10dm3和100dm3 mol·dm-3 0.005的AgNO3溶液混合制备溶胶,其胶粒在外电场的作用下电泳的方向是( )
下列元素的基态原子有3个半满的p轨道的是( )
溶液中产生正吸附时,溶液的表面张力增大,表面层中溶质分子数增多。( )
- 零级反应的反应速率不随反应物浓度变化而变化。
在标准压力和反应进行的温度时,由最稳定的单质合成1mol某化合物的反应热,称为该化合物的标准摩尔生成热。( )
- 最外层电子构型为ns1~2的元素都在s区。
液体在固体表面上的吸附可分为分子吸附和离子吸附。( )
- 溶胶在等电点时,其热力学电势和电动电势均为零。
同种物质的表面张力和比表面能都反映系统的表面特征,其物理意义不同,数值也不同。( )
- 原子轨道角度波函数中,电子在“+”号部分出现的概率大,在“-”号部分则没有电子运动。
- 不可逆过程就是过程发生后,系统不能再复原的过程。
- 丁铎尔效应是溶胶粒子对入射光的折射作用引起的。
- 催化剂在反应前后所有性质都不改变。
蛋白质是两性聚电解质,其分子的带电符号与溶液的pH有关。( )
- 1s电子在球形轨道上运动,2p电子在8字形轨道上运动。
化学吸附多为单分子层吸附。( )
正、负吸附现象是矛盾的对立统一,负吸附就是解吸。( )
- 吉布斯自由能减小的过程一定是自发过程。
- 将H原子的电子从1s轨道激发到3s所需要能量,和激发到3p所需要的能量相同。
- 主量子数n = 1时,有自旋方向相反的两个轨道。
氢原子只有一个电子,故基态氢原子只有一个1s轨道。
A:[(AgI)m•nNO3-•(n-x)Ag+]x-•xAg+ B:[(AgI)m•nK+•(n-x)I-] x+•xI- C:[(AgI)m•nAg+•(n-x)NO3-]x+•xNO3- D:[(AgI)m · nI-•(n-x)K+]x-•xK+
答案:第一空:AI参考:正确答案是【B:[(AgI)m•nK+•(n-x)I-] x+•xI-】。制备AgI溶胶时,由于碘化银溶解度小,所以碘离子过量,形成带负电荷的胶体粒子,因此胶团结构式为[(AgI)m·nK+·(n-x)I-]x+·xI-。选项B为正确答案。'
A:Fe2+ B:Ni2+ C: Co3+ D: Mn2+
AI参考:正确选项为【D】:Mn2+。电子构型为[Ar]3d5表示该元素的价电子构型为3d轨道上有5个电子,根据电子排布规律,该元素处于第四周期第ⅦB族,为锰元素。而选项A、B、C分别表示铁、镍、钴的离子价态,与题目所给电子构型不符。因此,正确选项为D:Mn2+。'
A:少量外加电解质易引起ζ电势值得变化 B:ζ电势的绝对值总是大于热力学电势 C:ζ电势表示胶粒溶剂化层界面到均匀液相内的电势 D:ζ电势的绝对值越大,溶胶越稳定
AI参考:正确答案是B:ζ电势的绝对值总是大于热力学电势。电动电势是胶体稳定性的一个重要参数,它表示胶粒溶剂化层界面到均匀液相内的电势,当ζ电势的绝对值越大时,溶胶越稳定。外加电解质可以改变胶粒所带的电荷,从而引起ζ电势的变化。同时,胶体溶胶和离子液体的稳定与否取决于其介稳体系性质,其中热力学电势是关键参数之一,其绝对值往往较小,而非热力学电势与胶体稳定性密切相关。因此,选项B是不正确的描述。其他选项A、C、D都与电动电势有关,描述正确。'
A: As B: P C: Mg D:Ca
答案:Cs
A: 选项A B: 选项B C: 选项C D: 选项D
答案:
A:能降低体系热力学能的物质 B:能显著降低溶液表面张力的物质 C:易溶于水的物质 D:能形成负吸附的物质
AI参考:正确答案是B:能显著降低溶液表面张力的物质。表面活性物质具有显著降低溶液表面张力的特性,使其具有润湿、乳化、起泡、渗透等多种重要的物理化学性质。因此,表面活性物质是能显著降低溶液表面张力的物质。其他选项中,A、C、D都与表面活性物质的特性不符。'
A:势能 B:体系热力学能 C:表面能 D:动能
AI参考:将体积较大的物质分散成粉末或细雾时,做功所消耗的能量转变为表面能。选项A、B、D都可能与做功和物质分散成粉末或细雾的过程有关,但是它们不能完全解释这个过程。在将体积较大的物质分散成粉末或细雾时,需要消耗能量,这个过程涉及到物质的表面分子被移动和分散,因此可以将这个过程看作是表面能的减少,而这个过程中所消耗的能量就转变为表面能。因此,正确答案是C:表面能。'
A:基元反应和大部分非基元反应 B:基元反应对峙反应 C:对峙反应 D:所有化学反应
AI参考:正确选项为A:基元反应和大部分非基元反应。反应速率常数随温度变化的阿仑尼乌斯经验公式适用于基元反应和大部分非基元反应。这个经验公式是通过实验数据拟合得到的,能够较好地描述反应速率与温度的关系。对于基元反应,每个步骤的反应速率都是独立的,因此可以更精确地应用这个经验公式。而对于非基元反应,虽然不是每个步骤都是独立的,但大多数情况下仍然可以适用。对峙反应和所有化学反应不是这个经验公式的适用范围。'
A: 1,2 B: 5,10 C: 7,14 D:3,6
AI参考:正确答案是C:7,14。n=3时,表示的是第三能层,s,p,d三个亚层。l=2时,p亚层有三个方向,分别是px,py,pz。当n=3,l=2时,代表的是第2个电子在p亚层,此时原子轨道的空间取向是平面正三角形。因此,原子轨道的空间取向为平面正三角形。根据泡利原理,每个亚层最多容纳的电子数为2n²个,因此第三能层最多可以容纳的电子数为2 × 3²=18个电子。但由于三个亚层只有第一层能级满数为8个电子后才开始屏蔽下一层排电子产生的电子之间的斥力影响电子运动的状态稳定性。而此时的三层实际上未填满或为1-7填充满了轨道;但是属于类氢结构及极类似电子组态的有其对应的周期位置关系式满足要求也可以直接认为第三个轨道处于完全满状态排列状态的价态排法也可对当主族主周期,由此得可以求得$s,p,d$各占1s轨道3个(都是排的第一个满电负态所以后面用减号号排序)+5个$p$轨道+7个$d$轨道共7个电子;由于只填充了三层;还有1s轨道填充了1个电子,所以一共填充了8个电子。因此答案为C。'
A:选项D B:选项C C:选项A D:选项B
答案:
A:-10 kJ B:30 kJ C:10 kJ D:-30 kJ
AI参考:正确答案是C,10 kJ。根据热力学第一定律,体系对外界作功,内能减少;失去热量,内能增加。因此,体系内能的变化为失去的热量减去对外界做的功,即10 kJ - 20 kJ = -10 kJ。所以,体系内能的变化是-10 kJ。'
A:4.95 B:-4.95 C:-2.48 D:2.48
AI参考:在化学反应中,燃烧属于放热反应,因此反应的热效应是放热的。具体来说,该反应的焓变是负值,也就是说反应是放热的。同时,对于萘的燃烧反应,这是一个固态反应物被氧化成气态二氧化碳和水的反应。反应前后气体的物质的量增加,即体系体积变大,这个过程也是放热的。在反应式中可以得出产物气体物质的量比反应物气体物质的量大。由这些信息,可以确定【单选题】
萘燃烧的化学反应方程式为:C10H8(s)+12O2(g)=10CO2(g)+4H2O(l),在298K时,Qp与QV的差值(kJ·mol-1)是(B):-4.95。
所以正确选项为B:-4.95。'A: B:因为焓是状态函数,而恒压反应焓变等于恒压反应热,故热也是状态函数 C:在恒压下,凡是自发的过程一定是放热的 D:在标准状态下、恒温恒压条件下,系统吉布斯自由能减少的过程都是自发进行的
AI参考:正确选项是【D:在标准状态下、恒温恒压条件下,系统吉布斯自由能减少的过程都是自发进行的】。解释:D选项是正确的。在标准状态下、恒温恒压条件下,系统吉布斯自由能减少的过程意味着系统的总能量变得更低,这是一个自发的过程。因为吉布斯自由能是一个描述系统能量可能的变化的函数,其变化量代表了系统进行某个过程时能量的净变化。当系统吉布斯自由能减少时,意味着系统总能量降低,因此这个过程是自发的。A选项是错误的,因为焓并不是一个状态函数,而恒压反应焓变是等于恒压反应热的。B选项是错误的,因为虽然焓是和反应的热有关,但是自发的过程并不一定都是放热的,还需要考虑熵的变化。C选项也是错误的,因为虽然一个自发的过程在恒压下可能是放热的,但是这并不意味着所有的自发过程都是放热的。例如,有些化学反应可能吸热。'
A:所有存在的电子对某电子 B:外层电子对内层电子 C:同层和内层电子对某电子 D:内层电子对外层电子
AI参考:正确选项为C:同层和内层电子对某电子。在估计电子受屏蔽的总效应时,需要考虑电子的排斥作用,而同层和内层电子对某电子的排斥作用更为明显。因此,C选项是正确的。其他选项中,A选项包含了所有存在的电子,但没有考虑到具体的排斥作用;B选项的外层电子对内层电子的排斥作用通常不太明显;D选项的内层电子对外层电子的屏蔽效应通常较弱。'
A:活化能降低 B:碰撞频率增加 C:活化分子百分数增加 D:活化能升高
答案:
A: 氢键力 B: 范德华力 C: 共价键力 D: 静电吸引力
A: Ea≤100KJ/mol B: Ea≥100KJ/mol C: Ea<100KJ/mol D: 无法判断
AI参考:反应的反应热为ΔH=-100 KJ/mol,说明反应是放热反应,即反应物能量高于生成物能量。根据能量守恒原理,反应物与生成物之间的能量差即反应的焓变。因此,当反应的焓变(ΔH)为负值时,说明反应为放热反应,即反应物能量高于生成物能量。根据化学反应速率与活化能的关系,活化能Ea描述的是反应物分子转变为活化分子所需要的最小能量。由于反应物的总能量高于生成物的能量,即反应是放热反应,所以反应物分子的能量高于活化分子所需要的能量,也就是说活化能Ea较低。因此,正确选项为C:Ea<100KJ/mol。'
A:(1/2)kA=kB=(1/2)kC B:kA=2kB=kC C:kA=kB=kC D:kA=(1/2)kB=kC
AI参考:正确选项是【C:kA=kB=kC】。根据题目中的描述,选项C中的kA、kB、kC都相等,符合题目中的条件。而其他选项中,要么只有部分相等,要么完全不相等,不符合题目中的条件。因此,选项C是正确答案。'
A:ψn,l,m, si (r,θ,φ) B:Y2l,m(r,θ,φ) C:ψ2(r,θ,φ) D:ψn,l,m (r,θ,φ)
AI参考:正确选项是D:ψn,l,m (r,θ,φ)。量子力学中的原子轨道是指描述电子在原子核外可能出现的概率密度分布的形状,它们是由量子力学中的波函数ψn,l,m(r,θ,φ)来描述的。其中,n表示能级,l表示轨道的角动量量子数,m表示轨道的磁量子数,r、θ、φ表示电子在三维空间中的位置坐标。因此,选项D是正确的描述。选项A、B、C都是错误的描述,因为它们没有给出完整的波函数描述,只涉及到轨道的概率密度分布或角度分布等部分信息。'
A:截距=2 B:截距=0.3010 C:截距/斜率=2 D:斜率=2
AI参考:正确选项是:D:斜率=2。解释:在反应速率常数与反应级数的关系中,我们知道反应级数与作图直线的斜率是呈线性关系的。在这个题目中,根据反应级数与对数曲线的关系,可知如果这个反应是二级反应,那么它的斜率就是2。所以答案为D。而截距通常是与温度相关的,题目中未提及温度条件,因此B、C选项均不可选。'
A:液体 B:固体 C:气体 D:气体或液体
AI参考:正确选项是【D:气体或液体】。雾属于气溶胶,是一种悬浮在气体或液体中的微小颗粒所形成的分散体系。因此,雾的分散介质是气体或液体。选项A、B、C都与雾的分散体系不符,只有选项D符合题意。'
A: lmol·L-1 NaNO3溶液 B:AgCl饱和溶液 C: lmol·L-1 NaCl溶液 D: lmol·L-1AgNO3溶液
AI参考:正确答案是:A:lmol·L-1 NaNO3溶液。本题考查影响溶解度的因素,在有AgCl固体存在的AgCl饱和溶液中,加入硝酸银溶液或氯化钠溶液均会生成沉淀,不能使AgCl的溶解度增大,而加入硝酸钠溶液可增大溶解度,答案为A。'
A:反应速率与反应物浓度的乘积成正比 B:凡速率方程式中各物质的浓度指数等于反应方程式中其化学计量数时,此反应必为基元反应 C:非基元反应是由若干基元反应组成的 D:反应级数等于反应物在反应方程式中的化学计量数之和
AI参考:正确答案是C:非基元反应是由若干基元反应组成的。反应速率与反应物浓度的乘积成正比,这个说法是不准确的,因为反应速率与反应物浓度和反应物本身的性质有关,不能简单地与浓度乘积成正比。B选项中的速率方程式中各物质的浓度指数等于反应方程式中其化学计量数时,此反应不一定是基元反应,因为基元反应是指反应物只有一步转化为生成物的反应,不一定是简单的化学计量数相乘的形式。D选项中的反应级数等于反应物在反应方程式中的化学计量数之和也是不准确的,因为反应级数是根据反应速率方程式中各物质的浓度指数来确定的,而不是化学计量数之和。因此,只有C选项是正确的,非基元反应是由若干基元反应组成的。'
A:ψ(3,0,0) B:ψ(3,1,0) C:ψ(3,3,0) D:ψ(3,2,0)
AI参考:正确选项为D:ψ(3,2,0)。根据题目要求,需要选择一个波函数表示3d轨道,而选项中只有D符合要求,即ψ(3,2,0)表示的是3d轨道。其他选项中的数值不符合3d轨道的要求。'
A: B: C: D:
AI参考:根据题目中的两个热化学方程式,可以得出以下结论:反应3的反应热等于反应1的反应热减去反应2的反应热。因此,正确选项为C:反应热的差值。'
A:△S>0,△G>0 B:△S<0,△G>0 C: △S>0,△G<0 D:△S<0,△G<0
AI参考:正确答案是C:△S>0,△G<0。在溶解过程中,体系的混乱度(熵)增加,即△S>0;由于溶解过程是自发的,所以这个过程是放热过程,即△H<0;根据吉布斯自由能公式△G=△H-T△S,由于T(温度)和△S都为正值,所以当T足够高时,△G<0,即这个过程可以自发进行。因此,在1dm3水中加入1molNaCl,该过程的△S>0,△G<0。'
A:三级反应 B:零级反应 C:二级反应 D:一级反应
AI参考:正确答案是C:二级反应。根据题意,反应速率常数的量纲是[浓度]·[时间] - 1,即反应速率与反应物浓度的二次方和时间的乘积成正比。这符合二级反应的特征,即反应速率与浓度的一次方成正比。因此,选项C是正确答案。一级反应和零级反应与此特征不符。'
A:与θ有关 B:与θ,φ有关 C:与r无关 D:与θ,φ无关
AI参考:正确选项为D:与θ,φ无关。氢原子的s轨道波函数是与电子在空间中的位置有关的函数,通常会涉及三个坐标轴上的位置信息,即r、θ和φ。但是在描述s轨道波函数时,主要考虑的是电子在空间中的径向距离r,因此与其他坐标轴上的角度θ和φ关系不大,即波函数与θ和φ无关。因此,正确答案是D:与θ,φ无关。'
A: B: C: D:
AI参考:正确选项是A:这是一个不完整的段落,缺少文本内容。由于题干中只给出了一个图片,而没有给出任何文本内容,因此无法确定选项。根据题目要求,只需要给出正确选项,因此选项A是最符合题目要求的答案。选项B、C、D都存在一定的问题,要么不符合题目要求,要么与图片内容不相关。'
A:对于任何化学反应,反应物浓度增加一倍,反应速度也增加一倍 B:催化剂使正反应的速度加快2倍,它的逆反应速度也同时加快2倍 C:温度升高,分子的碰撞次数增加,反应速度增加2~4倍 D:增加气相反应体系的总压,促使正反应速度加快
AI参考:正确答案是D:增加气相反应体系的总压,促使正反应速度加快。选项A错误,因为化学反应速率与反应物浓度之间并非简单的线性关系;选项B错误,催化剂对正逆反应速率的影响不同;选项C错误,温度升高,分子碰撞次数增加,但反应速度不一定增加2~4倍,而是增加反应速率常数;选项D正确,增加气相反应体系的总压,会使正反应方向的气体体积减小,从而促使正反应速度加快。因此,正确答案是D。'
A:平衡常数K变大 B:正反应速率降低 C:速率常数k变小 D:逆反应速率降低
AI参考:正确答案是【D:逆反应速率降低】。随着反应的进行,逆反应速率降低,因为反应物浓度降低,导致逆反应速率减小。而平衡常数K和速率常数k与反应物浓度无关,因此选项A和C不正确。正反应速率与反应物浓度和温度等因素有关,因此选项B不正确。'
A: 选项C B: 选项A C: 选项D D: 选项B
A:以lnc对t作图为直线 B:以1/c对t作图为直线 C:以c对1/t作图为直线 D:以c对t作图为直线
AI参考:正确选项是【D:以c对t作图为直线】。一级反应是指反应速率与反应物浓度无关,即反应速率常数不随时间或温度变化而变化。因此,对于一级反应,反应物浓度c与时间t的关系可以用反应速率常数乘以浓度来表示,即k*c=r*c,其中k为反应速率常数。因此,以c对t作图可以得到一条直线,其中纵坐标为反应速率常数k,横坐标为时间t。其他选项中,A选项中的lnc表示反应速率常数k的倒数,B选项中的1/c表示浓度倒数,C选项中的c对1/t表示时间倒数。因此,这些选项不符合一级反应的特征。D选项是符合题意的正确答案。'
A:不能确定 B:不做定向移动 C:向正极移动 D:向负极移动
A:16S B:15P C: 14Si D: 18Ar
A:对 B:错
A:对 B:错
A:错 B:对
A:错 B:对
A:错 B:对
A:对 B:错
AI参考:正确答案是B:错。溶胶在等电点时,其热力学电势为零,但电动电势不为零。这是因为溶胶中存在电荷的迁移运动,产生电动现象,所以溶胶在等电点时电动电势不为零。因此本题错误。'
A:对 B:错
A:错 B:对
AI参考:B:对。原子轨道角度波函数中,电子在“+”号部分出现的概率大,在“-”号部分只是代表概率低的地方,并不代表没有电子运动。所以答案是B:对。'
A:对 B:错
A:对 B:错
A:错 B:对
A:对 B:错
A:对 B:错
A:对 B:错
A:对 B:错
A:错 B:对
A:错 B:对
A:对 B:错
AI参考:正确答案是B:错。该题是一个图片标签的HTML代码,其中img标签的src属性指向了一个图片的URL,但题目中并没有给出任何关于该图片的信息,因此无法判断是否正确。'
A:错 B:对
AI参考:【答案】B.对。\r解析:主量子数n=1时,只有一个电子层,即轨道只有一个,不存在自旋方向相反的两个轨道。'
A:错 B:对
AI参考:答案:A解释:氢原子只有一个电子,但是氢原子有多个能级,每个能级上电子的轨道不同。氢原子的基态是指氢原子最稳定的状态,此时只有一个电子在1s轨道上,但是氢原子还有其他能级和电子轨道。因此,基态氢原子不只有一个1s轨道,而是只有一个1s能级,其中只有一个电子。所以这个说法是错误的。'







