陕西师范大学
- 简述绝热系统和隔离系统的熵增加原理。
- 简述状态函数焓的定义、性质及其与热量之间的联系。
- 在
 图上,两条可逆绝热线是不可能相交的,否则会违反热力学第一定律。 ( )
图上,两条可逆绝热线是不可能相交的,否则会违反热力学第一定律。 ( ) - 气缸内有一定量的理想气体,反抗一定外压作绝热膨胀,则
 。( )
。( ) - 依据相律,恒沸点混合物的沸点不随外压的改变而改变。( )
- 根据热力学第一定律,因为能量不能无中生有,所以一个系统若要对外做功,必须从外界吸收能量。 ( )
- 二组分的理想液态混合物的蒸气总压力介于二纯组分的蒸气压力之间。( )
- 碳的不完全然烧反应:2C + O2 = 2CO,
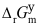 (J·mol−1) =232600167.8T,温度升高,
(J·mol−1) =232600167.8T,温度升高,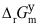 变得更负,因而反应进行得更完全。( )
变得更负,因而反应进行得更完全。( ) - 等熵等压过程ΔH=Wf,可逆相变过程ΔS环=ΔH/T。( )
- 根据C(石墨)=C(金刚石)的化学平衡原理。金刚石只有在高温高压下才能合成。( )
- 热力学第三定律的数学表达式为:lim S (T→0K)=0。( )
- 溶液的化学势等于溶液中各组分的化学势之和。( )
- 1 mol A与n mol B组成的溶液,体积为0.65 dm3,当xB = 0.8时,A的偏摩尔体积VA,m = 0.090 dm3·mol-1,那么B的偏摩尔VB,m 为( )
- 下列体系中自由度f = 2的是( )
- 液态苯在一绝热钢性的氧弹中燃烧,其化学反应为C6H6(l)+7.5O2(g) = 6CO2(g)+3H2O(g) ,则下面表示正确的是 ( )
- 在等容条件下,将100 dm3单原子理想气体从273 K,101.3 kPa加压到202.6 kPa,则其ΔU和ΔH分别为( )
- 两种理想气体在等温下混合( )
- https://image.zhihuishu.com/zhs/onlineexam/ansewerImg/202302/5cc107a3026f483c9bb258eba1ba3a6e.png
- 在298.2 K、101.3 kPa下,两瓶体积均为1 dm3的萘溶于苯的溶液,第一瓶中含萘1 mol;第二瓶中含萘0.5 mol。若以μ1及μ2分别表示两瓶萘的化学势,则( )
- 某一水溶液共有S种溶质,相互之间无化学反应。若该水溶液与纯水达到渗透平衡时,则该系统的自由度数为( )
- 下列哪个关系式不是化学势( )
- 各种运动形式的配分函数中与压力有关的是( )
- 二组分体系最多可平衡共存的相数为( )
- 一定量理想气体从同一始态出发,分别经两个过程达到相同压力的终态,①等温压缩,焓变∆H1,②绝热压缩,焓变为∆H2,两者之间的关系为 ( )
- 270 K、100 kPa时,1 mol水凝结为同温同压下的冰,则系统和环境的熵变分别为( )
- 设反应A(s)=D(g)+G(g)的
 (J·mol−1)=−4500+11T,要防止反应发生,温度必须( )
(J·mol−1)=−4500+11T,要防止反应发生,温度必须( ) - 在298 K,101.3 kPa下,2 mol甲苯与50 mol的苯组成混合物,其中甲苯的化学势为μ1;又4 mol 甲苯加100 mol 苯组成的混合物,其甲苯的化学势为μ2,则两者的关系为 ( )
- 某一固体在298 K和101.3 kPa下升华,这意味着( )
- https://image.zhihuishu.com/zhs/onlineexam/ansewerImg/202302/cea3f8b141294731ae6ecf5331ee0953.png
- https://image.zhihuishu.com/zhs/onlineexam/ansewerImg/202302/2bca89c9258847768dc79efd4accee37.png
- 在下列有关化学势的表达式中,正确的是 ( )
- 等温等压下正向反应自发进行时,下面关系正确的是( )
- 化学反应若严格遵循体系的“摩尔吉布斯自由能(G)-反应进度(ξ)”的曲线进行,则该反应最终处于( )
- https://image.zhihuishu.com/zhs/onlineexam/ansewerImg/202302/9a61d84b291e4979a88fc7700721db43.png
- 在298 K时,纯液体A的p*A=5
 104 Pa,纯液体B的p*B=6
104 Pa,纯液体B的p*B=6 104 Pa。假设两液体能形成理想液态混合物,当达到气液平衡时,液相中组成xA=0.4,在气相中B的摩尔分数yB则为 ( )
104 Pa。假设两液体能形成理想液态混合物,当达到气液平衡时,液相中组成xA=0.4,在气相中B的摩尔分数yB则为 ( ) - 体系对环境做功为负(W<0),环境对体系做功为正(W>0),则封闭体系的热力学第一定律数学表达式为( )
- 270 K和大气压下 1 mol 水凝结成冰,对该过程来是说,下面关系正确的是( )
- 理想气体从同一始态(p1, V1, T1)出发,分别经恒温可逆压缩和绝热可逆压缩,环境所做的功分别为WT和WA。若压缩至同一终态体积V2,下述表述中正确的是( )
- 下列过程中体系的熵减小的是( )
- 1 mol、373 K、100 kPa下的水经下列两个过程变为373 K、100 kPa下的水汽:①等温等压可逆蒸发;②向真空蒸发。则两个过程中功和热的关系为 ( )
- 硫存在着单斜、斜方、液态和蒸气四种不同的物态,故在硫的相图中三相点的数目可高达( )
- 气相反应 2NO(g) + O2(g) = 2NO2(g)的
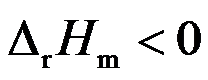 ,当反应达平衡后,若使平衡向右移动,可采用( )
,当反应达平衡后,若使平衡向右移动,可采用( ) - 一定量理想气体经等温恒外压压缩至终态,这时系统和环境的熵变应为 ( )
答案:绝热系统熵增加原理:在绝热过程中,如果过程是不可逆的,系统的熵会增加;如果是可逆过程,系统的熵则保持不变。 隔离系统熵增加原理:在隔离系统中,根据熵增加原理(热力学第二定律),系统的熵永远不会减少,总是增大或者保持不变。这意味着孤立系统自然倾向于向熵增的方向演化,不会自发地变得更为有序(即熵减)。
答案:焓(H)是热力学中一个重要的状态函数,定义为体系的内能(U)加上压强(p)和体积(V)的乘积,数学表达式为 H = U + pV。它是能量的一种形式,尤其在开放系统或涉及压力体积工作的过程中讨论时非常有用。 焓的性质包括: 1. 状态函数:焓值仅取决于系统的当前状态,与达到该状态的过程无关。 2. 过程路径独立:在等压过程中,焓变ΔH等于系统吸收或放出的热量Q。 3. 可加性:混合物的总焓等于各组分焓的总和。 焓与热量的联系: 在等压条件下,焓的变化(ΔH)等于该过程中交换的热量(Q),即 ΔH = Q_p。这表明在等压过程分析中,焓变可以直接通过热量变化来理解。然而,这个关系不适用于非等压过程,在非等压过程中,需要更复杂的计算来确定焓变与热量之间的关系。
A:对 B:错
答案:错
A:对 B:错
答案:错
A:错 B:对
答案:错
A:错 B:对
答案:错
A:对 B:错
答案:对
A:对 B:错
答案:错
A:错 B:对
答案:A:错
A:对 B:错
A:错 B:对
A:错 B:对
A:0.028 dm3·mol-1 B:0.072 dm3·mol-1 C:0.140 dm3·mol-1 D:0.010 dm3·mol-1
A:S(s) ↔S(l) ↔ S(g)三相共存 B:298 K时,H2O(l)→H2O(g) C:C2H5OH(l)与H2O(l)的混合物 D:一定量的PCl5(g)达到分解平衡时:PCl5(g) = PCl3(g) + Cl2(g)
A:∆U≠0,∆H≠0,Q=0
B:∆U=0,∆H=0,Q=0
C:∆U=0,∆H>0,W=0
D:∆U=0,∆H<0,Q=0
A:3.404 kJ,5.674 kJ B:15.20 kJ,25.32 kJ C:15.20 kJ,20.34 kJ D:25.32 kJ,35.45 kJ
A:ΔU = 0 ΔH = 0 ΔS > 0 ΔG = 0 B:ΔU > 0 ΔH < 0 ΔS > 0 ΔG < 0 C:ΔU = 0 ΔH = 0 ΔS > 0 ΔG < 0 D:ΔU = 0 ΔH = 0 ΔS = 0 ΔG = 0
A:理想气体的任何绝热变化 B:理想气体的任何可逆变化 C:理想气体的绝热可逆变化 D:任何气体的绝热变化
A:μ1 =μ2 B:μ1 <μ2 C:不能确定 D:μ1 >μ2
A:

B:
C:
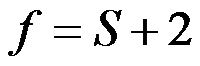
D:

A:
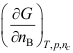 B:
B: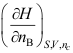 C:
C: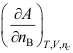 D:
D: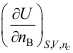
A:转动配分函数
B:电子配分函数
C:平动配分函数
D:振动配分函数
A:5 B:2 C:3 D:4
A:无法确定
B:∆H1>∆H2
C:∆H1=∆H2
D:∆H1<∆H2
A:ΔS体系>0,ΔS环境<0
B:ΔS体系<0,ΔS环境<0;
C:ΔS体系>0,ΔS环境>0
D:ΔS体系<0,ΔS环境>0
A:低于409 K
B:高于136 K而低于409 K
C:高于409 K
D:低于136 K
A:μ1 = μ2 B:μ1 < μ2 C:μ1 = 2μ2 D:μ1 > μ2
A:三相点温度小于298 K B:固体比液体密度大 C:三相点的压力小于101.3 kPa D:三相点的压力大于101.3 kPa
A:封闭体系只作膨胀功的可逆过程 B:理想气体可逆过程 C:理想气体等压过程 D:封闭体系恒外压过程
A:
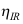 B:不能确定
C:
B:不能确定
C: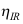 D:
D:
A:

B:
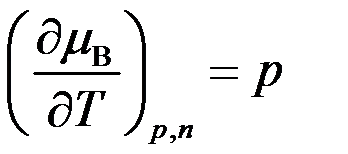
C:
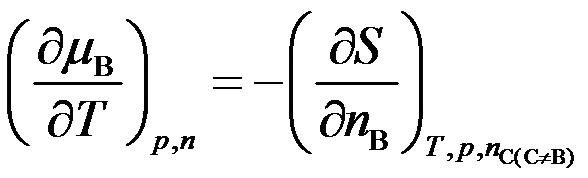
D:
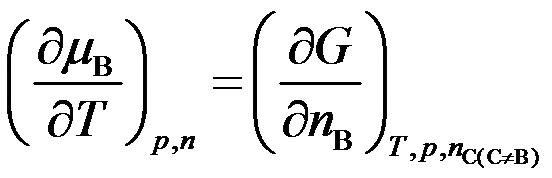
A:
 B:
B: C:
C: D:
D: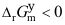
A:曲线以外某点进行着热力学可逆过程 B:曲线上的每一点 C:曲线的最低点 D:最低点与起点或终点之间的某一侧
A:2.465 B:0.406 C:1.570 D:0.637
A:0.50
B:0.64
C:0.25
D:0.40
A:ΔU = W – Q B:ΔU = Q – W C:ΔU = Q + W D:ΔU = – Q – W
A:
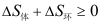 B:
B: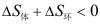 C:
C: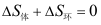 D:
D: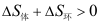
A:WT=WA
B:WT和WA无确定关系
C:WT>WA
D:WT<WA
A:理想气体的等温膨胀 B:水在其正常沸点汽化 C:在高温下,CaCO3 (s) = CaO (s) + CO2 (g) D:273.2 K常压下水结成冰
A:W1<W2,Q1>Q2
B:W1<W2,Q1<Q2
C:W1=W2,Q1=Q2
D:W1>W2,Q1<Q2
A:5
B:3
C:2
D:4
A:降低温度,增大压力
B:升高温度,增大压力
C:降低温度,降低压力
D:升高温度,降低压力
A:∆S体<0,∆S环<0
B:∆S体>0,∆S环>0
C:∆S体<0,∆S环>0
D:∆S体>0,∆S环<0
温馨提示支付 ¥5.00 元后可查看付费内容,请先翻页预览!



