第七章测试1.在300 K时,如果分子A和分子B要经过107次碰撞才能发生1次反应,这个反应的临界能是:( )
A:40.2 kJ.mol-1 B:10.5 kJ.mol-1 C:170 kJ.mol-1 D:-15.7 kJ.mol-1
答案:A
2.在碰撞理论中,概率因子小于1的主要原因是( )。
A:分子间有作用力 B:空间位阻效应 C:反应系统是非理想的 D:分子碰撞不够激烈 3.于简单碰撞理论下列描述正确的是 ( )。
①碰撞参数越大,反应越激烈
②互撞分子在连心线方向上的相对平动能超过临界能的碰撞才是能导致反应的碰撞。
③碰撞理论说明了阿仑尼乌斯经验式中的指前因子相当于碰撞频率,故又称为频率因子
④互撞分子的相对总动能超过E才是有效碰撞。
A:③④ B:①④ C:②③ D:①② 4.按照Linderman理论,当反应物的压力或浓度由高变低时,单分子反应常表现出( )。
A:反应级数由一级变为二级,由小变大 B:反应速率常数不变 C:反应级数由二级变成一级 D:反应速率常数由大到小变化 5.阿仑尼乌斯活化能Ea,阈能Ec和活化焓
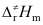 三者数值大小关系,下列不等式正确的是( )。
三者数值大小关系,下列不等式正确的是( )。A:Ec>
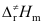 >Ea
B:Ea>Ec>
>Ea
B:Ea>Ec>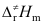 C:Ec>Ea>
C:Ec>Ea>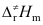 D:
D: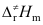 >Ea>Ec
6.按照化学反应速率的过渡态理论,对于气相反应,下列说法不正确的是 ( )
>Ea>Ec
6.按照化学反应速率的过渡态理论,对于气相反应,下列说法不正确的是 ( )。
A:该理论不考虑分子的内部结构和运动状态 B:反应过程中,反应分子先形成过渡态 C:活化络合物与反应物之间很快达到平衡 D:反应速率决定于活化络合物的分解速率 7.在简单碰撞理论中,有效碰撞的定义是( )。
A:互撞分子的内部动能超过Ec B:互撞分子的总动能超过Ec C:互撞分子的相对总动能超过Ec D:互撞分子的相对平动能在联心线上的分量超过Ec 8.设某基元反应在500K时,实验活化能为83.14 kJ/mol,则此反应的临界能为( )。
A:162.01 kJ/mol B:81.06 kJ/mol C:2.145 kJ/mol D:4.291 kJ/mol 9.设对峙反应正方向是放热的,并假定正、逆都是基元反应,则升高温度更利于增大正反应的速率系数。( )
A:对 B:错 10.对于一个在定温、定压下,不做非膨胀功的化学反应来说,△G越负,反应速度越快。( )
A:错 B:对
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!







