第四章测试1.
按照价键理论,HCl分子中共价键是由:
A:H原子的1s轨道与Cl原子的3px轨道沿x轴方向重叠而成; B:H原子的1s轨道与Cl原子的3s轨道重叠而成; C:H原子的1s轨道与Cl原子的3个p轨道重叠而成; D:H原子的1s轨道与Cl原子的2px轨道沿x轴方向重叠而成。
答案:A
2.
杂化轨道与原子轨道一样既可以形成s键,也可以形成π键。
A:对 B:错 3.
下列各组分子均为第二周期元素的同核双原子分子,其中都有未成对电子的是:
A:B2、O2 B:C2、F2。 C:O2、Li2; D:C2、N2; 4.
下列各组化合物分子中,键角大小顺序正确的是:
A:CH4>NH3=BF3>BeCl2; B:BeCl2>BF3=NH3>CH4; C:NH3>CH4>BeCl2>BF3。 D:BeCl2>BF3>CH4>NH3; 5.
按照分子轨道理论,N2+和N2-的键级相等。
A:对 B:错 6.
下列分子和离子中,中心原子的价层电子对几何构型为四面体,且分子(离子)空间构型为角形(V形)的是 :
A:
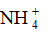
下列关于范德华(vanderWaals)力的叙述中,错误的是:
A:色散力通常是主要的; B:非极性分子间没有取向力; C:极性分子间没有色散力。 D:分子的极性越大,取向力越大; 8.
下列各组晶体的晶格能大小顺序中正确的是:
A:MgO>RbCl>SrO>BaO; B:CaO>KCl>MgO>NaCl; C:MgO>CaO>NaCl>KCl。 D:NaCl>KCl>RbCl>SrO; 9.
H2O的熔点比HF高,所以O-H…O氢键的键能比F-H…F氢键的键能大。
A:对 B:错 10.
极性分子的极化率比非极性分子的大。
A:对 B:错
温馨提示支付 ¥4.99 元后可查看付费内容,请先翻页预览!