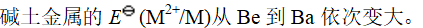
- 含有Ca2+、Mg2+的水叫做硬水。
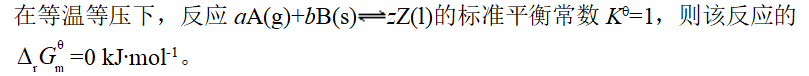
- KMnO4在酸中、碱中、受热、见光都不稳定。、
- 在水溶液中,Ag+ 能与多种配体形成相应的配合物,并且是无色的。
- 卤化氢还原性强弱的次序为HF
答案:对
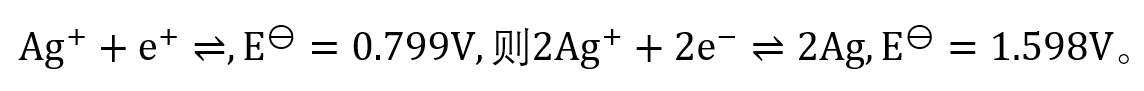
答案:错

答案:错
- 所有原子晶体的熔点均比离子晶体的熔点高。
答案:错
- SnCl2分子和H2O分子的空间构型均为V型,表明它们的中心原子采取相同方式的杂化轨道成键。
- 在水溶液中Fe3+与浓氨水可以形成[Fe(NH3)6]3+。
- 下列硫化物不能溶解于Na2S溶液的是:
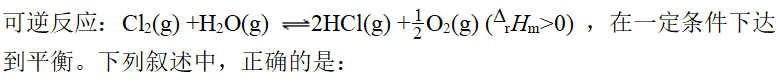
- 恒温恒压下,可逆反应达到平衡时,下列关系式正确的是:
- 下列配离子中,不是八面体构型的是:
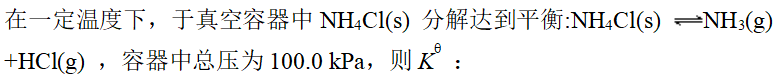
- 室温下,将H2S气体通入水中,得到的饱和溶液,其浓度近似为:
- 下列氧化物中,可溶于NaOH溶液的是:
- 已知反应Cu+4HNO3(浓)→Cu(NO3)2+2NO2(g)+2H2O,若有4.00mol HNO3被还原,则产生的NO2气体在273℃、202kPa下所占的体积为(假设NO2满足理想气体状态方程):
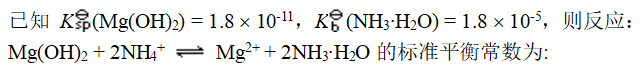
- 下列离子中,与Na2S溶液混合不生成黑色沉淀的是:
- 下列硫化物既溶于浓盐酸又溶于Na2Sx的是:
- 能够使 PbCl2在水中的溶解度增大的方法是:
- 下列各电对中氧化型物质的氧化能力随H+ 浓度增加而增强的是:
- 下列化合物不可能存在是:
- 要配制一定浓度的SbCl3溶液,应采取的方法是:
- 在AgCl 饱和溶液中加入AgNO3溶液,平衡时,溶液中:
- 对A、B两种元素来说,下列叙述正确的是:
- 下列电对作为原电池的半电池,不需使用惰性电极的是:
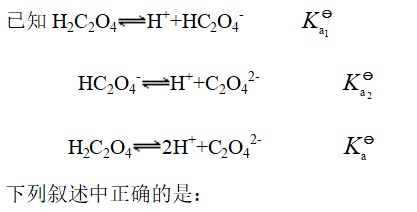
- 弱酸的标准解离常数与下列因素有关的是:
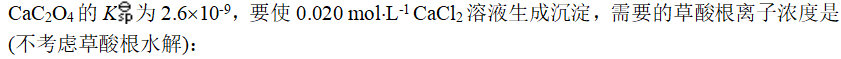
- 分子间取向力的产生取决于分子的:
- 下列物质不是橙色的是:
- 下列氯化物中,在日光下由白色变为灰黑色的是:
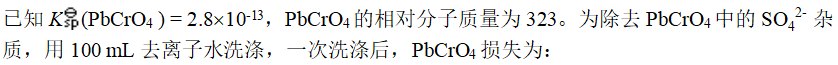
- 丙酮在25oC下的蒸气压是30.7kPa。现有25oC、0.100mol的丙酮。试计算当丙酮的体积为8.00L时,丙酮蒸气的压力是多少?
- 把氯和四氯化碳加到碘化钾的水溶液里摇动,待溶液分层后,四氯化碳层呈现的颜色是:
- 下列各种离子能在酸性溶液中稳定存在的是:
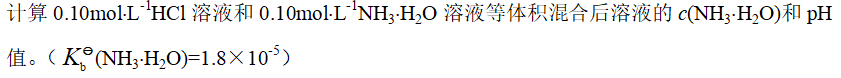
- 下列物质中,与Cl2作用生成漂白粉的是:
- 对于原子核外的电子来说,下列各组量子数的组合中错误的是:


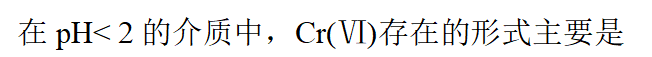
- 下列氢氧化物中属于两性氢氧化物的是:
- 碱土金属氢氧化物碱性强弱的次序为:Be(OH)2

- 碱金属的盐类都是可溶性的。
- Mn(OH)2能被空气中的氧气氧化。
- s区元素在自然界不以单质形式存在。
- 硝酸盐的水溶液在中性时几乎没有氧化性,只有在酸性介质中才有氧化性。
- SnS 溶于Na2S2溶液中,生成硫代亚锡酸钠。
- 元素的电离能越小,其金属性越弱。
- 波函数y表明微观粒子运动的波动性,其数值可大于零也可小于零,½y½2表示电子在原子核外空间出现的概率(几率)密度。
- PbO2 具有强氧化性,可以在酸性介质中将二价锰离子氧化为紫红色的高锰酸根,也可以将盐酸氧化为氯气。
- 普鲁士蓝和滕氏蓝是两种组成、结构都不相同的物质。
- 所有固体铵盐的热分解产物中均有氨气。
- 在K2MnO4溶液中加入HAc可以生成KMnO4和MnO2。
- 在氢卤酸中,由于氟的非金属性强,所以氢氟酸的酸性最强。
- 在锰的化合物中,锰的最高氧化值等于它在周期表中的族序数。
- 氟是最活泼的非金属,故其电子亲和能最大。

- 氢键只存在于NH3、H2O、HF的分子之间,其它分子间不存在氢键。
- 锰可以用作炼钢中的去氧剂。
- 共价键的键长等于成键原子共价半径之和。
- 100kPa和298K时,有含有饱和水蒸气的空气3.47L,如将其中的水除去,则干燥空气的体积为3.36L,此温度下水的饱和蒸气压为:
- 下列试剂中,能与CoCl2溶液反应生成粉红色沉淀的是:
- 元素周期表中第五、六周期的ⅣB、ⅤB、ⅥB族中各元素性质非常相似,这是由于:

- 已知某元素+2价离子的外层电子排布是3s23p63d4,则该元素的价电子构型和族数是:
- 下列硫化物中,不可能存在的是:
- 在H3BO3晶体中,硼原子的杂化方式是:
- 下列离子在过量NaOH溶液中能生成氢氧化物沉淀的是:
- 下列符号表示的原子能级,不可能存在的是:
- 关于 Cu - Zn 原电池的下列叙述中,错误的是:
- 下列原子或离子中,具有与Ar原子相同电子构型的是:
- 为制备卤化氢水溶液,下列方法中错误的是:
- 由氨催化氧化法制硝酸时,为消除氮氧化物的污染,通常用以吸收尾气的溶液是:
- 金与王水反应的主要产物是:
- 已知[Fe(C2O4)3]3-的磁矩大于5.75 BM;其空间构型及中心离子的杂化轨道类型是:
- 配离子[M(NH3)6]3+和[R(NH3)6]2+的不稳定常数分别为1.0 ´ 10-8和1.0 ´ 10-12,则在相同 浓度的[M(NH3)6]3+和[R(NH3)6]2+溶液中c(NH3)应是:
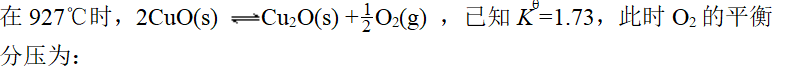
- 下列配合物中,易被空气中的氧氧化的是:
- 下列配合物中只含有多齿配体的是:
- 下列元素最高氧化值的化合物中,氧化性最强的是:
- 已 知 [HgCl]+、[HgCl2]、[HgCl3 ]-、[HgCl4]2-的稳定常数依次分别约为107、1013、1014、1015。 在 Cl-的平衡浓度为2.0 mol·L-1时,将0.010 mol Hg(NO3)2溶解在1.0 L NaCl(aq)中,Hg(II)的主要存在形式是:
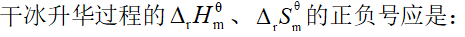
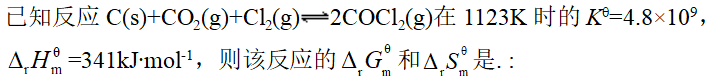
- 关于乙硼烷的结构,下列叙述中错误的是:
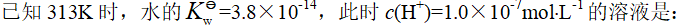
- 下列电极电势最小的是:
- 下列配合物不能被Cl2氧化的是:
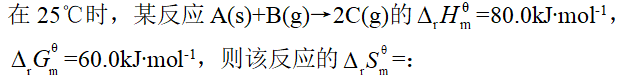
- 下列离子能与黄血盐作用,并生成蓝色沉淀的是:
- 在SnCl2溶液中滴加少量HgCl2,最终出现沉淀的颜色是:

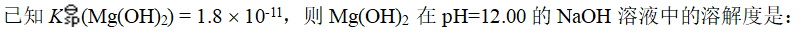
- 下列有关说明PbO2具有强氧化性的叙述中,正确的是:
- 欲抑制SnCl2的水解,可加入HCl,这种作用为:
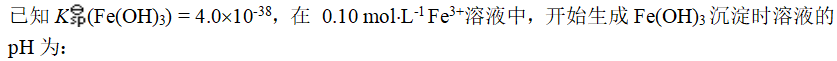
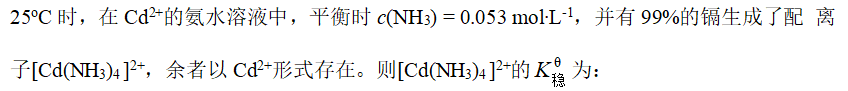
- 下列试剂能将AgCl、AgBr沉淀完全溶解,而不能溶解AgI、Ag2S沉淀的是:
- 按照分子轨道理论,N2+ 中电子占有的能量最高的轨道是:
- 下列物质分子的键离解能等于其键能的是:
- 下列化合物受热分解不能生成CuO的是:
- 将KClO3溶液与KI溶液混合,无明显现象发生,当加入稀H2SO4后,就有I2生成。
- 卤化氢沸点高低的次序为HF
- 氯的含氧酸中,热稳定性最强的是:
- 除HF外,可用卤化物与浓硫酸反应制取卤化氢。
- 下列叙述中正确的是:
- 磷与溴水反应的产物是:
- 下列氯的含氧酸盐在碱性溶液中不能歧化的是:
- 从碘水中萃取碘,所用的萃取剂是:
- 氢氟酸能腐蚀玻璃,故需要用塑料瓶保存。
- 单质碘在水中的溶解度很小,但在碘化钾等碘化物溶液中碘的溶解度增大,这是因为:
- 下列各组离子在过量NaOH溶液中都只能生成氢氧化物沉淀的是:
- 下列氢氧化物能溶于酸但不溶于碱的是:
- 有些洗衣粉中含有三聚磷酸钠。使用这种洗衣粉,常因磷是富营养元素,引起河流湖泊中的藻类迅速生长,从而破坏生态平衡。

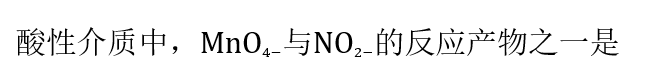
- 下列元素属于准金属(半金属)的是:
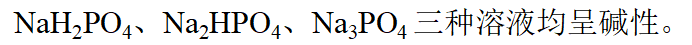
- 实验室配制SnCl2溶液时,通常采取的措施是:
- 下列硫化物中可溶于Na2S溶液的是:
- 下列硫化物中不可能存在的是
- 锡和铅的氢氧化物都是两性氢氧化物,Sn(OH)2的碱性强于Pb(OH)2。
- 若验证Pb(OH)2在酸中的溶解性,只能将其溶解在HAc或硝酸中。
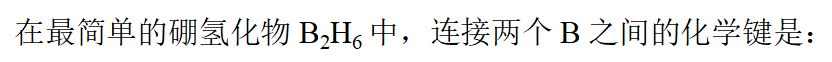
- 下列物质中,熔点最高的是:
- PbCl2可以溶于热水和较浓的盐酸中。
- BCl3是一种:


- a-锡酸既能溶于酸,也能溶于碱,b-锡酸既不能溶于酸,也不能溶于碱。
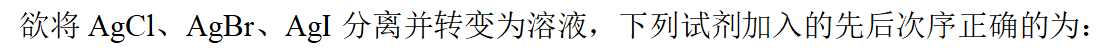
- ds区元素中导电、导热性最好的是:
- ds区元素中,延展性最好的是:
- 在CuSO4与过量NaOH混合液中加入葡萄糖溶液并微热,生成的产物之一是:
- Cu(I) 的化合物由于发生d - d跃迁多呈现颜色。
- 铜、银、金均可以单质状态存在于自然界。
- 下列物质可用于检验市售酒精中是否含有水分的是:
- 反应4Au+O2+2H2O+8CN-® 的主要产物为:
- 下列试剂中,能使KI - 淀粉试纸变蓝的是:
- 下列各种离子中与适量氨水反应生成沉淀,氨水过量时沉淀不消失的是.:
- 下列氢氧化物中,颜色为绿色的是:
- 水溶液中[Co(NCS)4]2-很稳定,不易发生解离。.
- 下列氢氧化物中,可以与浓HCl发生氧化还原反应的是:
- 用以检验Fe2+的试剂是:
- 铁、钴、镍都能溶于稀酸而形成水合离子。
- 用过量NaOH可将下列各组物质分离的是:
- 下列离子在水溶液中的颜色错误的是:
- 下列物质中,不能被空气中的O2氧化的是:
- 分离Fe3+和Co2+可选用的试剂是:
- 在所有过渡元素中,硬度最大的是:

- 下列各溶液中,可与K2Cr2O7溶液反应生成沉淀的是:
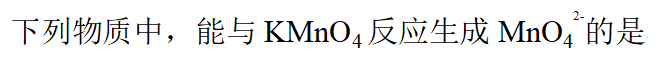
- 下列试剂中,与K2Cr2O7溶液在酸性介质中反应能生成气体的是:
- 下列各组离子在酸性溶液中能发生反应的是:
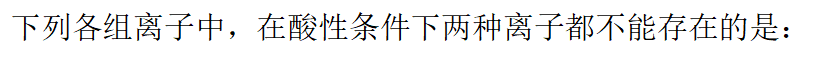
- 所有碱金属的碳酸盐都是易溶于水的。
- 碱金属熔点的高低次序为Li > Na > K > Rb > Cs。
- 锂在空气中燃烧时,生成物之一是:
- 下列各物质热稳定性次序正确的是:
- 碱金属的氢氧化物皆具有强碱性。

- 在潮湿的空气中,过氧化钠吸收CO2放出O2,在这个反应中,过氧化钠:
- 金属钙保存在煤油中。
- 由于s区、p区元素性质活泼,它们都不能以单质的形式存在于自然界。
- 配离子[CoCl(NO2)(NH3 )4 ]+的正确名称是:
- 已知下列配合物磁矩的测定值,按价键理论判断属于外轨型配合物的是:
- 在配合物[Co(en)3]2(SO4)3中,中心离子的配位数和氧化值分别是:
- 25oC时,在Cu2+的氨水溶液中,平衡时[NH3] = 6.7´10-4 mol·L-1,并认为有50%的Cu2+形成了配离子[Cu(NH3)4]2+,余者以Cu2+形式存在。则[Cu(NH3)4]2+的不稳定常数为:

- 根据下列反应所设计的原电池,不需用惰性电极的是:
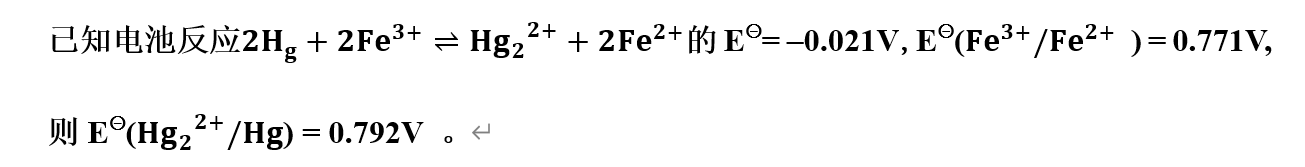
- 理论上所有氧化还原反应都能借助一定装置组成原电池。
- 下列反应中不是氧化还原反应的是:
- 对0.1mol×L-1HAc溶液来说,下列叙述中正确的是:
- 在1.00LH2S饱和溶液中加入10mL0.010mol×L-1HCl,则下列式子正确的是:
- 将缓冲溶液无限稀释时,其pH值基本不变。( )
- 0.1mol×L-1H2S溶液中,其各物种浓度大小次序正确的是:
- 0.2 mol×L-1甲酸溶液中有 3.2% 的甲酸电离,它的电离常数是:
- 关于H2S二元弱酸解离平衡的下列叙述中正确的是:
- 不影响弱电解质的解离度的因素有:
- 在有AgCl固体存在的溶液中,当加入等体积的下列溶液,会使AgCl溶解度增大的是:
- H2O的熔点比HF高,所以O-H…O氢键的键能比F-H…F氢键的键能大。
- 按照分子轨道理论,N2+和N2-的键级相等。
- 下列各组分子均为第二周期元素的同核双原子分子,其中都有未成对电子的是:
- 下列分子和离子中,中心原子的价层电子对几何构型为四面体,且分子(离子)空间构型为角形(V形)的是 :
- 下列各组化合物分子中,键角大小顺序正确的是:
- 杂化轨道与原子轨道一样既可以形成s键,也可以形成π键。
- 极性分子的极化率比非极性分子的大。
- 按照价键理论,HCl分子中共价键是由:
- 下列关于范德华(vanderWaals)力的叙述中,错误的是:
- 下列各组晶体的晶格能大小顺序中正确的是:
- 对某原子中的各电子来说,其主量子数n≤3,则原子处于基态时:
- 对下图所示,正确的叙述是:
- 第二周期中N的第一电离能比它前后相邻的C和O都要大。
- 首先提出微观粒子运动波动方程式的科学家是:
- 原子序数为33的元素,其原子在n=4,l=1,m=0的轨道中电子数为:
- 按照核外电子的排布规则,预测原子序数从1~100的100种元素的原子中,具有3d电子的元素有:
- 氢原子的原子轨道能量取决于量子数:
- 下列基态离子中,具有d7电子构型的是:
- 第三周期元素的基态原子中,不可能出现d电子,主要依据是:
- 已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素在周期表中属于:
- 反应CaCO3(s)→CaO(s)+CO2(g),在高温、标准态时才能自发进行,则该反应的:
- 下列关于熵的叙述中正确的是:
- 下列各种物质中,298K标准摩尔生成焓为零的是
- 混合气体中,某组分的分压是指:
- 等温等压下,气体A和B的体积分别为VA和VB,将它们混合,保持温度不变,则它们的分压比为 pA:pB = VB:VA。
- 硼和氯的相对原子质量分别为10.81和35.5。现有含硼、氯的质量分数分别为23%、77% 的固体硼氯化物试样0.0516g,在69℃完全蒸发,蒸气在2.96 kPa时占有体积268 mL。则该化合物的化学式:
- 在等温等压下,使5.0 m3的空气与过量碳反应,全部生成CO,则反应后比反应前气体体积增加的分数为:
- 混合等物质的量的N2与O2,则混合气体的平均相对分子质量是:
- 已知在25oC时苯的蒸气压为12.3 kPa。当0.100mol苯的蒸气体积为10.2 L和30.0L时,苯气体的压力分别是:
- 实验室用排水集气法制取氢气。在23oC、100.5 kPa下,收集了480.0 mL气体,已知23 oC 时水的饱和蒸气压为2.81 kPa,试计算氢气的物质的量:
- 某实验采用以空气通过乙醇液体带入乙醇气体的办法来缓慢加入乙醇。在20.0oC、101.325 kPa下,引入2.3g乙醇所需空气的体积为:(已知20.0oC时,乙醇的蒸气压为5.87kPa,M (C2H5OH) = 46 g·mol-1)
- 分压定律适用于真实气体混合物的条件,除在所处的温度区间内气体间不发生化学反应外, 这些气体所处的状态是:
- 某煤气柜内的压力为104 kPa,温度为298 K、体积为1.6×103 m3,298K时水的饱和蒸气 压为3.17kPa,则气柜中煤气的物质的量和水蒸气的质量分别为:
答案:

答案:

答案:错
答案:错
答案:对
答案:对
答案:对
温馨提示支付 ¥5.00 元后可查看付费内容,请先翻页预览!