1.
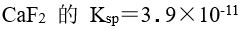 ,
,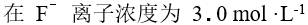 的溶液中 ,
的溶液中 ,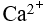 离子可能的最高浓度为
离子可能的最高浓度为
A: B: C: D:
答案:AI参考:答案:D\n\n解释:这组图像表明了三种不同的离子在不同的溶液中,没有给定这些离子相互之间的相互作用或者外界因素如pH、温度等因素的影响。在这种情况下,题目只是询问哪一个离子可能在溶液中的最高浓度。因为三个图片并没有直接的信息说明一种离子的浓度超过其他离子,因此无法确定哪一个离子浓度最高。所以,正确的选项应该是没有提供具体数值的开放式答案,即D。'
2.
反应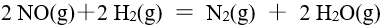 的速率常数 k 的单位是,则此反应级数是( )
的速率常数 k 的单位是,则此反应级数是( )
A:2 B:1 C:0 D:3
答案:AI参考:正确选项为D:3。\n\n根据题目描述,反应速率的单位是k,这通常意味着该反应是一个三级反应。即反应速率与反应物浓度的3次方成正比。因此,答案为D:3。'
3.
已知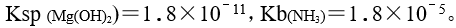 将等体积的
将等体积的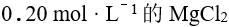 溶液与
溶液与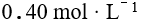 的氨水混合,混合后溶液中
的氨水混合,混合后溶液中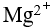 的浓度是混合前浓度的倍数为
的浓度是混合前浓度的倍数为
A: B: C: D:
答案:AI参考:正确答案是【C】。\n\n混合后溶液中167.png的浓度是混合前浓度的倍数为x,混合后溶液中各组分的质量分数不变,混合后溶液中各组分浓度与质量分数的关系为:c=m/V=M/VM=M/(m(NH₃)/ρ),混合前各组分的质量分数不变,故混合后溶液中167.png的浓度也是原来的m(NH₃) / (ρ*V),二者比值为m(NH₃) / (ρ*V) : 1,也就是题目中所述倍数,根据提供的选项可得C为正确答案。'
4.
某温度时,化学反应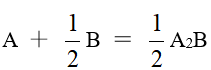 的平衡常数 K=,则在相同温度下,反应 的平衡常数为
的平衡常数 K=,则在相同温度下,反应 的平衡常数为
A:1 B: C: D:
答案:AI参考:正确选项是“C:无法判断”。\n\n题目描述的是一个化学反应的平衡常数,但是没有给出具体反应的化学方程式和反应条件,因此无法判断在相同温度下反应的平衡常数。选项A、B、D都与题目描述不符,因此是无效选项。'
5.
根据化学反应等温方程式,要使反应自发进行的条件是
A: B:没有 C: D:
答案:AI参考:正确选项为D:反应自发进行需要满足△H<0且△S>0的条件。\n\n根据化学反应等温方程式,要使反应自发进行,需要满足两个条件:△H<0(反应焓变小于零)和△S>0(反应熵变大于零)。只有同时满足这两个条件,反应才能自发进行。因此,选项D是正确答案。而选项A、B、C都只满足其中一个条件,不是反应自发进行的充分条件。'
6.
加 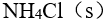 到
到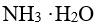 溶液中,将使
溶液中,将使
A:变大 B:pH值变大 C:变小 D:pH值变小
答案:AI参考:通过对题目中的选项进行分析,可以确定本题为PH值与溶液酸碱性相关的题目。由于加入的图片中不含有与PH值变化相关的信息,因此题目考察的是pH值的变化情况。\n\n根据题目中的描述,加入到溶液中的是两张图片,这两张图片的标题分别为“图片 134.png”和“图片 135.png”。\n\n选项A和B都涉及到PH值的变大或变小,但这两个选项中并未给出与PH值变化相关的信息。\n\n选项C和D分别表示pH值变小和不变,根据常识,加入溶液中的物质如果能够使溶液的PH值变小,那么就说明该物质是酸性物质,能够中和溶液中的碱性物质,从而使PH值变小。\n\n因此,根据题目描述和常识,可以得出结论:正确选项是C:变小。'
7.
已知金属 M 的下列标准电极电势数据:
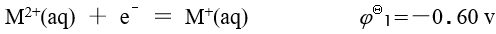
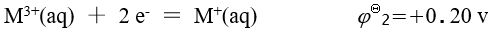
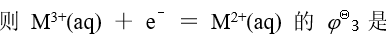
A:0.80 v B:1.00 v C:-0.40 v D:-0.20 v
答案:AI参考:正确答案是【单选题】A:0.80 v。\n由题意可知,金属M的标准电极电势为0.80V,所以答案为A。金属的标准电极电势为正值,表示金属失去电子变为离子时放出能量,即金属单质具有还原性。所以,0.80V为还原性反应中氧化剂对金属离子的电极电势差。需要选择金属离子的标准电极电势差进行比较,只有A选项是符合的。金属单质具有还原性是因为在电化学中它不能单独作为氧化剂和还原剂存在。根据电子的转移数来计算电子数可知选项B和D为正值不成立。而C选项是负值不符合实际情况。所以答案是A:0.80 v。'
8.
用能斯特公式计算电对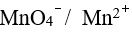 的非标准电极电势
的非标准电极电势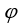 时,下列叙述中不正确的是
时,下列叙述中不正确的是
A:浓度变化对值无影响 B:增大值增大 C:浓度增大则值减小 D:温度应为298 K
答案:AI参考:根据给出的选项和图片,正确的答案应该是B:增大值增大。\n\n根据能斯特公式,电对的电极电势受温度和溶液酸碱性影响,浓度对其也有影响。在图241中,可以看到当浓度增大时,值增大。而在图229中,可以看到当温度升高时,值增大。所以,正确答案是B:增大值增大。\n\n选项A、C、D都是正确的描述,所以不正确的是B。\n\n请注意,这个答案基于给出的图片和题目描述,如果题目描述不准确或有其他信息,答案可能会有所不同。'
9.
某物质 B 的标准摩尔燃烧焓为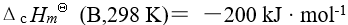 则该物质B 燃烧时的标准摩尔反应焓为( )
则该物质B 燃烧时的标准摩尔反应焓为( )
A:200 B:-200 C:40 D:0
答案:AI参考:正确选项【D】:0\n\n题目中已经说明物质B的标准摩尔燃烧焓,所以这个反应应该是一个燃烧反应,即反应物只有一个(即物质B),生成物没有。根据燃烧反应的定义,燃烧反应的标准摩尔焓变应该为零,所以正确答案为D。'
10.
对于反应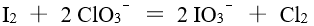 ,下面说法不正确的是
,下面说法不正确的是
A:此反应为氧化还原反应 B:碘的氧化数由0增至+5,氯的氧化数由+5降为0 C:得到电子,失去电子 D:是还原剂,是氧化剂
答案:AI参考:正确答案是D:是还原剂,是氧化剂。\n\n根据题目中给出的反应式,可以知道该反应中碘元素从0价升到+5价,氯元素从+5价降到0价,所以该反应是氧化还原反应,选项A正确。同时,碘的氧化数增加了,氯的氧化数减少了,所以选项B也是正确的。该反应中元素的化合价发生了变化,且升高和降低的元素个数相等,即得到了电子,也失去了电子,选项C也是正确的。根据以上分析,可以确定D选项是不正确的,因为该反应中碘元素的化合价升高了,化合价降低的是氯元素,所以碘是还原剂,氯是氧化剂。因此,正确答案是D。'
11.
反应 A (g) + B (g) → C (g) 的速率方程为 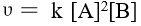 ,若使密闭的反应容器体积增大一倍,则反应速率变为原来的
,若使密闭的反应容器体积增大一倍,则反应速率变为原来的
A:1 / 2 B:1 / 6 C:1 / 4 D:1 / 8 12.
由反应式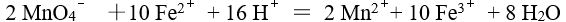 ,安排为电池 ,该电池的符号应是
,安排为电池 ,该电池的符号应是
A: B: C: D: 13.
在一定温度下,将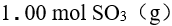 放在 1.00 L密闭容器中,下列反应
放在 1.00 L密闭容器中,下列反应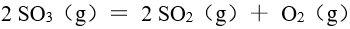 达到平衡时,
达到平衡时,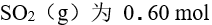 ,则反应的平衡常数
,则反应的平衡常数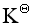 为
为
A:0.36 B:0.54 C:0.45 D:0.68 14.
已知有以下三个热化学方程式:
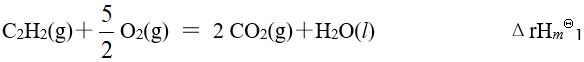

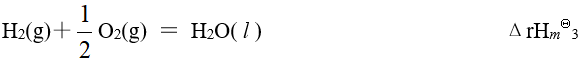
则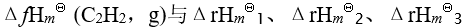 的关系为
的关系为
A: B: C: D: 15.
已知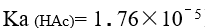 ,
,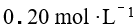 HAc溶液和的 NaAc 溶液等体积混合后,其 pH 值为
HAc溶液和的 NaAc 溶液等体积混合后,其 pH 值为
A:3.95 B:5.13 C:8.78 D:4.75 16.
浓度不大时,对于半反应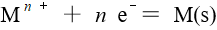 的电极电势,下列说法中错误的是
的电极电势,下列说法中错误的是
A:值随温度升高而增大 B:增大而增大 C:的数值与n的多少无关M(s) 的多少无关 D:的数值与 17.
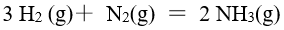 ,反应达到平衡后,把
,反应达到平衡后,把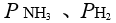 各提高到原来的2 倍,
各提高到原来的2 倍,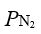 不变,则平衡将会
不变,则平衡将会
A:状态不变 B:向正反应方向移动 C:向逆反应方向移动 D:无法确定 18.恒压下某反应的正反应活化能为Ea ,逆反应的活化能为Ea’ ,则 Ea -Ea’ 等于该反应的
A:-Δ H B:ΔU C:Δ H D:-ΔU 19.室温下,稳定状态的单质的标准摩尔熵为
A:零 B:不等于零 C:大于零 D:小于零 20.某氢电极与饱和甘汞电极( =+0.240 v)组成原电池 ,若要使电池电动势达到+0.299 v ,则溶液的 pH值是
A:2 B:3 C:4 D:1 21.在HAc-NaAc组成的缓冲溶液中,若[HAc] > 则该缓冲溶液抵抗外加酸或碱的能力为
A:抗酸能力 < 抗碱能力 B:尚无法判断 C:抗酸碱能力相同 D:抗酸能力 > 抗碱能力 22.主量子数n=3的一个电子的下列四个量子数组,取值正确的是
A:3,2,-1,+1/2 B:3,1,2,+1/2 C:3,3,1,+1/2 D:3,2,1,0 23.下列关于分子间作用力说法正确的是
A:分子型物质的沸点总是随相对分子质量增大而增大 B:色散力存在于所有相邻分子间 C:大多数含氢化合物中都存在氢键 D:极性分子间只存在取向力 24.关于歧化反应,正确的叙述是
A:两种物种里两种原子之间发生的氧化还原反应 B:同一物种里两种原子之间发生的氧化还原反应 C:两种物种里同种原子之间发生的氧化还原反应 D:同一物种里同种原子之间发生的氧化还原反应 25.在标准铜锌原电池中,若向铜半电池内加入一定量的氢氧化钠 ,则原电池的电动势将
A:变小 B:无法判断 C:变大 D:不变 26.根据晶体场理论,形成高自旋配合物的理论判据是分裂能< 成对能。
A:错误 B:正确 27.在一个能实际产生电流的原电池中,作为正极的电极反应的电势总是高于作为负极的电极反应的电势值。
A:错 B:对 28.共价分子中,中心原子价层电子对的构型就是该分子的构型。
A:正确 B:错误 29.在反应体系中加入催化剂,不能改变反应的Δ H、ΔS、ΔG、ΔU。
A:对 B:错 30.对于不同的配合物相比较,配合物(离子)的越大,则其稳定性越高。
A:对 B:错 31.对同一中心原子所形成的配合物,低自旋型配合物的稳定性较大,高自旋型配合物的稳定性较小。
A:正确 B:错误 32.两原子之间形成共价键时,首先形成的一定是图片17.png型共价键。
A:错误 B:正确 33.当溶液中可能出现分步沉淀时,浓度积先达到Ksp的先沉淀出来。
A:对 B:错 34.电子云是波函数在空间分布的图形。
A:正确 B:错误 35.已知NO(g)和的分别是90.4和33.2,则反应的平衡常数升温时会减小。
A:正确 B:错误
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!

