提示:内容已经过期谨慎付费,点击上方查看最新答案
普通化学
- 对于任何一个化学变化,影响平衡常数数值的因素是( )
- 氨
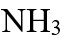 的沸点(− 33℃)比膦
的沸点(− 33℃)比膦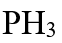 的沸点(− 87.7℃)高,这是因为 ( )
的沸点(− 87.7℃)高,这是因为 ( ) - 关于反应级数的叙述正确的是( )
- 对基元反应而言,下列叙述中正确的是( )
- 速率常数k是( )
- 蔗糖、葡萄糖各10g,分别溶入100g水中,成为A、B两溶液。用半透膜将两溶液隔开,则( )。
- 某反应在标准状态和等温等压条件下,在任何温度都能自发进行的条件是( )。
- 对于等温等压下不做非体积功的体系,若在非标准状态下自发进行,下列表示正确的是( )。
对于任一过程,下列叙述正确的是( )。
- 在一定条件下,反应的平衡常数
 很大,表示该反应( )
很大,表示该反应( ) - 下列说法正确的是:( )。
- 主量子数的符号用n表示,当n=4时,角量子数可取( )个数值。
- 下列分子形状是V字形的为 ( )。
- 下列物质在 0 K 时的标准熵为0的是( )。
 18、已知298.15 K时, ,则反应
18、已知298.15 K时, ,则反应 的平衡常数
的平衡常数 的对数
的对数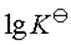 为( )。
为( )。- 常温下
 的溶度积常数为
的溶度积常数为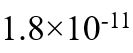 ,则
,则 饱和溶液的pH最接近于( )。
饱和溶液的pH最接近于( )。 - 勒·夏特列原理(平衡移动原理)适用于以下哪种情况?( )
- 对于一个给定条件下的反应,随着反应的进行( )
- 已知某反应的
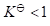 ,则该反应的
,则该反应的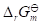 应是( )
应是( ) - 体系对环境作20 kJ的功,并失去10 kJ 的热给环境,则体系内能的变化为( )。
- 下列分子,属于平面三角形构型的为( )。
- 将
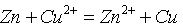 反应设计为原电池,若在铜半电池溶液中加入氨水后,则电池电动势E值将( )。
反应设计为原电池,若在铜半电池溶液中加入氨水后,则电池电动势E值将( )。 - 在标准条件下,下列反应均向正方向进行:

它们中间最强的氧化剂和最强的还原剂是( )。 - 室温下,稳定状态的单质的标准摩尔熵为( )。
- 在电池
 中,电子转移的方向是( )。
中,电子转移的方向是( )。 - 水对玻璃润湿,汞对玻璃不润湿,将一玻璃毛细管分别插入水和汞中,下列叙述不正确的是( )。
在元素周期表中电负性最大的元素是 ( )。
- 如果一个反应的吉布斯自由能变为零,则反应( )。
- 下列原子中电子的量子数,对应的能量最大的是 ( )。
- 下列关于强、弱电解质的叙述,错误的是( )。
- 下列说法中正确的是( )
- 在一定温度下,将 1.00 mol
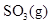 放在 1.00 L密闭容器中,下列反应
放在 1.00 L密闭容器中,下列反应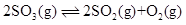 达到平衡时,
达到平衡时,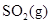 为 0.60 mol ,则反应的
为 0.60 mol ,则反应的 为( )
为( ) - 高分子分子链的几何形状有( )。
- 极性分子和非极性分子间一定存在( )。
- 下列说法正确的是:( )。
 和
和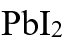 的溶度积非常接近,都约为
的溶度积非常接近,都约为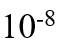 ,因此二者饱和溶液中,
,因此二者饱和溶液中,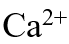 和
和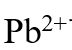 离子的浓度近似相等。( )
离子的浓度近似相等。( )- 活化能只能为正值而不能为负值。( )
- 在氧化还原反应中,氧化剂失去电子,氧化值升高,进行的是还原反应。( )
- 线型高聚物的柔顺性不如体型高聚物的好。( )
- 缓冲比一定时,总浓度越大,缓冲溶液的缓冲容量越大。( )
- 共价键和分子间取向力一样都是既具有饱和性又具有方向性 ( )。
- 体系经历一个循环,无论多少步骤,只要回到起始状态,其热力学能和焓的变化量ΔU和ΔH 都为零。。( )
在水溶液中含氧酸根离子的氧化能力通常随溶液的pH减小而增强。()
- 内能的改变值ΔU可通过测定Q和W算出。由于内能是状态函数,因此,热和功也是状态函数。( )
- 弱酸及其盐组成的缓冲溶液的pH值必定小于7。( )
- 若某原电池的标准电动势大于0V,则此电池反应的摩尔吉布斯函数变必然小于0。( )
- 同一原子轨道仅可容纳 2 个自旋相反的电子。( )
- 缓冲对是由共轭酸碱构成的,凡共轭酸碱均能组成缓冲对并产生缓冲作用。( )
- 反应的热效应就是反应的焓变。( )
- 卤化氢分子间色散力由强到弱的顺序为HF>HCl>HBr>HI ( )。
A:反应物的浓度 B:反应系统的总压力 C:反应系统的温度 D:生成物的浓度
答案:温度
A:分子的极性比分子的极性大 B:分子间的色散力比分子间的色散力大 C:的蒸汽压比高 D:分子间存在氢键,而分子间不存在氢键
答案:
 分子间存在氢键,而
分子间存在氢键,而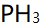 分子间不存在氢键
分子间不存在氢键A:二级反应也就是双分子反应 B:反应的级数只能通过实验来测定 C:反应级数必须是正整数 D:级数随温度上升而增加
答案:反应的级数只能通过实验来测定
A:反应级数不一定与反应分子数相一致 B:反应级数和反应分子数总是一致的 C:反应级数总是小于反应分子数 D:反应级数总是大于反应分子数
答案:反应级数和反应分子数总是一致的
A:量纲为的参数 B:无量纲的参数 C:量纲不定的参数 D:量纲为的参数
答案:量纲不定的参数
A:没有渗透现象 B:A中水渗入B C:没有渗透现象都有可能。 D:B中水渗入 E:A中水渗入 F:B中水渗入A
AI参考:正确答案是:B:A中水渗入B。蔗糖分子比水分子大,葡萄糖分子比水分子小,所以蔗糖分子不能透过半透膜,而葡萄糖分子可以透过半透膜,所以A溶液的水分子会透过半透膜进入B溶液中,B溶液的水分子会进入A溶液中,所以答案为B。这个问题考察的是渗透现象的相关知识。渗透现象是指水分子或溶剂分子通过半透膜的扩散现象,取决于溶质和溶剂的分子大小和性质差异。在这个问题中,蔗糖和葡萄糖的分子大小不同,因此不能透过半透膜,而水分子则可以透过。因此,A溶液中的水分子会通过半透膜进入B溶液中,而B溶液中的水分子则会进入A溶液中。所以答案是B。'
A: B: C: D:
A: B: C: D:
A:体系的内能变化与反应途径无关 B:体系所作的功与反应途径无关 C:体系所作的功与反应途径无、体系的内能变化与反应途径无关、体系所吸收的热量与反应途径无关均不正确 D:体系所吸收的热量与反应途径无关
A:反应的速度很大 B:反应的可能性很大 C:活化能很大 D:是放热反应
A:在电解的过程中阴极发生的是得电子反应 B:在电解的过程中阳极发生的是得电子反应 C:在吸氧腐蚀中腐蚀电池的阳极是氧气发生了反应 D:在析氢腐蚀中腐蚀电池的阳极是有氢气析出来
AI参考:在电解的过程中阴极发生的是得电子反应,因此选项A是正确的。在电解过程中,阴极上被还原的物质或离子得电子发生反应,而在阳极上被氧化的物质或离子失电子发生反应。在电解过程中,阴极通常被视为阳极的相反电极,因此选项B错误。在吸氧腐蚀中,氧气在阳极上发生反应,而不是在腐蚀电池的阳极上,因此选项C是正确的。在析氢腐蚀中,氢气是在阴极上产生的,而不是在腐蚀电池的阳极上,因此选项D错误。因此,答案为A:在电解的过程中阴极发生的是得电子反应。'
A:1个 B:4个 C:2个 D:3个
AI参考:正确答案是B,4个。主量子数n表示电子离原子核的平均距离,角量子数表示电子的轨道形状,当n=4时,角量子数可取四个不同的数值,分别对应磁量子数m为-2、-1、0、+1。因此答案为B。'
A: B: C: D:
AI参考:正确答案是D:下列分子形状是V字形的为:D. 乙炔。乙炔分子中碳原子为sp杂化,三键中有一个键不稳定,易断裂,所以乙炔分子形状是V字形。其他选项的分子形状不符合题意。'
A:完美晶体 B:纯液体 C:理想气体 D:理想溶液
A:2.70 B:-0.913 C:0.913 D:-2.70
AI参考:通过对题目中的图表进行分析,该图描述的是一个反应在特定温度下的平衡常数对数。而平衡常数的大小反映了一个化学反应进行的程度,其数值越大,反应进行的程度越高。因此,对数应当为正值。排除A、D选项。另外,题目中给出的是一个压缩因子(图中第二个图像),它是表示气体分子运动状态的非理想性的度量。对于理想气体,压缩因子为1,对于非理想气体,压缩因子大于1。而压缩因子与平衡常数的对数之间没有直接关系。因此,可以排除B选项。综上所述,该反应的平衡常数的对数应为C选项:0.913。'
A:3 B:1 C:11 D:13
AI参考:正确答案是D:13。根据溶度积常数和溶度积表达式,可以求出溶度积常数和pH之间的关系,即可得到最接近的pH值。本题中溶度积常数为离子对的乘积,不随浓度变化而变化,故无需考虑溶液中的离子浓度大小,根据离子对的性质可得出,离子对的酸碱性的判断,可判断为酸性大于碱性,根据溶度积表达式求出该溶液的pH值即可。因此最接近的pH值为13。另外需要注意的是,该选项是单选题,所以不需要考虑其他选项是否符合题意。因此,答案为D。'
A:适用于所有化学反应 B:平衡状态下的所有反应系统 C:只适用于气体间的反应 D:所有的物理平衡
AI参考:正确选项是【B:平衡状态下的所有反应系统】。勒·夏特列原理(平衡移动原理)是指如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。该原理适用于平衡状态下的所有反应系统,无论反应物和生成物是否为气体、是否为化学反应等。'
A:平衡常数K变大 B:逆反应速率降低 C:速率常数k变小 D:正反应速率降低
A: B: C: D:
AI参考:已知反应是一个由不同原子(可能是金属原子、非金属原子、氢原子等)通过不同化学键形成的化学反应。从图片中可以看出,反应物和生成物的化学键类型不同,因此可以推断该反应涉及到了化学键的断裂和形成。而选项中只有C选项“氧化还原反应”符合这一描述,因为氧化还原反应通常涉及到电子的转移和得失,是化学反应中最常见的一类反应之一。因此,正确选项为C:氧化还原反应。'
A:+30 kJ B:+10 kJ C:-30 kJ D:-10 kJ
AI参考:正确答案是A,+30 kJ。体系对环境作功,要减少它的内能,也就是减少它与外界进行热交换所损失的内能,并丢失了10kJ的热量给环境,说明内能减少了10kJ,另外体系对环境作功为20kJ,因此总的为增加的内能就是10kJ+20kJ=30kJ。所以选择A选项。'
A: B: C: D:
AI参考:答案是D:根据题目要求选出平面三角形构型,因此首先判断各个分子的键角。A选项的键角为108度,不是平面的三角形;B选项中的两个键角相同,都为120度,也不符合要求;C选项的两个键角不相同,无法判断是否为平面三角形构型;而D选项的两个键角都是90度,加上双键是直线型的,所以D选项中的分子是平面三角形构型。因此,本题的正确答案是D。'
A:无法判断 B:减小 C:增大 D:不变
A: B: C: D:
AI参考:答案:C解析:氧化剂和还原剂的强弱是根据得失电子的难易程度来判断的,与反应向哪个方向进行无关。所以最强的氧化剂和还原剂应该是得电子最容易,即化合价降低最深的物质,即C选项。因此本题选C。回答中给出的图像没有上下箭头的信息,所以我们不能直接使用箭头信息进行判断。另外,即使给出了箭头信息,根据题目要求“不用分析”,我们也可以直接根据给出的选项和图像进行判断,不需要进行分析。综上,我们可以在题目要求的范围内直接给出正确答案。如果题目要求使用分析方法来回答,则需要考虑其他因素。但是本题没有这个要求,所以我们只需要给出最简单的答案即可。'
A:小于零 B:0 C: D:大于零
A: B: C: D:
AI参考:正确选项为【D】电子转移的方向是从正极流向负极。电池中的电子是通过电极反应进行转移的,电子从正极流向负极,形成电流回路。因此,选项D为正确答案。图片中的箭头指向也表明了电子转移的方向是从正极到负极。'
A:管内水面高于管外水面 B:管内水面为凹液面 C:管内汞面与管外汞面一致 D:管内汞面为凸液面
A:I B:Cs C:F D:H
AI参考:正确答案是B:Cs。电负性最大的元素是周期表中第六周期的Cs元素,其电负性为1.98,比F元素的电负性还要大。因此,在元素周期表中电负性最大的元素是Cs。'
A:处于平衡状态 B:是放热反应 C:能自发进行 D:是吸热反应
A:3, 2, 2, 1/2 B:2, 0, −2, 1/2 C:3, 0, 1, 1/2 D:2, 1, 0, −1/2
AI参考:正确答案是:C:3, 0, 1, 1/2。根据能量最低原理,电子在基态时,总是优先占据能量最低的轨道,而在能量相同的轨道上电子的能量由轨道的量子数决定,即主量子数越大,能量越高。本题中A为第四电子层(能量比第三电子层大)第三轨道上的电子;B为第二电子层第一轨道上的电子;C为第三电子层第二轨道上的电子;D为第二电子层第二轨道上的电子,可见只有C是离核较近、能量较低的电子,选项C符合题意。因此答案选C。'
A:强电解质在溶液中完全电离,不存在电离平衡 B:在溶液中,导电能力强的是强电解质 C:同一弱电解质的溶液,当温度、浓度不同时,导电能力也不同 D:纯净的强电解质在液态时,有的导电有的不导电
AI参考:正确答案是:B:在溶液中,导电能力强的是强电解质。B项错误,溶液的导电能力与溶液中离子浓度成正比,与电解质的强弱无关。A项正确,强电解质在溶液中完全电离,不存在电离平衡,即不存在电离平衡状态,因此A项正确。C项正确,弱电解质在溶液中存在电离平衡,当温度、浓度不同时,溶液中离子浓度不同,导电能力也不同。D项正确,纯净的强电解质在液态时,有的导电有的不导电,如纯水不导电,但水是弱电解质。本题为选非题,故正确答案为B。'
A:反应速率常数的大小即反应速率的大小 B:从反应的速率常数单位可以推测该反应的反应级数 C:反应级数和反应分子数是同义词 D:反应级数越大,反应速率越大
A:0.54 B:0.45 C:0.68 D:0.36
A:体型 B:无规型 C:支链型 D:线型
AI参考:正确答案是:D:线型。高分子链的几何形状有:线型、支链型、体型和无规型。故选D。'
A:氢键 B:色散力 C:诱导力 D:取向力
AI参考:正确选项为:B、色散力。极性分子与非极性分子间可以存在色散力、诱导力和取向力,但不一定存在氢键。氢键通常存在于极性分子与极性分子之间,用于加强氢原子的电子云密度,增强分子间的作用力。而色散力是所有分子间普遍存在的作用力,极性分子与非极性分子间也不例外。诱导力虽然需要极性分子与非极性分子间存在电性相互作用,但并不是一定会产生。取向力一般存在于极性分子的偶极之间,而非极性分子与极性分子之间以及极性分子与非极性分子之间都不能存在取向力。因此,正确选项为B:色散力。'
A:电池在放电时负极的实际电极电势比可逆电极电势小 B:电池在放电时负极的实际电极电势比可逆电极电势大 C:电池在放电时正极的实际电极电势比可逆电极电势大 D:电池在放电时正极的实际电极电势比可逆电极电势小
AI参考:正确答案是 A和D。电池在放电时,实际电极电势通常会小于可逆电极电势,这是因为电池反应过程中,电极反应的可逆性受到破坏,因此选项A和D是正确的。而选项B和C则是错误的,因为电池在放电时正极的实际电极电势通常会小于可逆电极电势。需要注意的是,实际电极电势和可逆电极电势都是用来描述电极反应的平衡态和非平衡态的电化学性质,它们之间的差异可以用来判断电池反应的方向和反应的速率。在实际应用中,需要根据具体情况选择合适的参数来进行计算和分析。'
A:错 B:对
AI参考:A:错。\r解释:判断题中的结论与题目所给信息相悖,实际上这两种物质对应的离子浓度相差很大,不是近似相等的关系。根据溶度积的表达式,溶解度越大的物质对应的离子浓度越大,所以上述两个溶液中,后者的离子浓度更大。因此本题选择A。'
A:对 B:错
AI参考:活化能只能为正值而不能为负值,这句话是正确的。活化能是指分子从常态转变为容易发生化学反应的活跃状态所需要的能量,这个能量通常是一个正值。因此,选项A是正确的。选项B是错误的。'
A:对 B:错
A:错 B:对
AI参考:答案:B:对。线型高聚物具有链节柔顺性好、分子间易运动等优点,其综合力学性能较好。而体型高聚物是线型高聚物在交联反应中发生链与链之间发生互相缠结,形成的三维网状结构的高聚物,具有很高的强度和硬度。因此线型高聚物的柔顺性要好于体型高聚物。所以,题目中的判断是正确的。'
A:错 B:对
AI参考:答案是B:对。缓冲比一定时,总浓度越大,缓冲溶液的缓冲容量越大。根据缓冲溶液的公式:缓冲容量=总浓度/缓冲比,可以得出总浓度越大,缓冲容量越大的结论。因此,这个判断题是正确的。'
A:错 B:对
AI参考:答案:B。共价键和分子间取向力一样都是既具有饱和性又具有方向性。共价键的饱和性是指成键原子的电子总数不能配对满,只能配对一部分;分子间取向力是分子与分子之间的相互作用,属于色散力的一种,只有分子的大小相近且取向相同时才会存在。因此本题中选项B是正确的。'
A:错 B:对
A:错 B:对
AI参考:答案是B:对。根据题目描述,在水溶液中含氧酸根离子的氧化能力通常随溶液的pH减小而增强,这说明在酸性环境下,含氧酸根离子的氧化性会增强,因此选项B是正确的。选项A错误,因为氧化能力通常不是随pH的增大而减弱或增强,而是与含氧酸根离子本身的性质和环境条件有关。'
A:对 B:错
A:错 B:对
A:对 B:错
AI参考:答案是B:错。标准电动势只是衡量电池反应自发进行程度的物理量之一,而摩尔吉布斯函数变则是衡量反应进行的的方向和程度大小的物理量。这两个物理量之间没有必然的关系。如果一个原电池的标准电动势大于0V,但不能确定反应的摩尔吉布斯函数变是否小于0,因为反应的方向和程度大小还受到其他因素的影响,例如反应的温度、压力、物质的性质等。因此,该判断题是错误的。'
A:错 B:对
AI参考:答案是B:对。同一原子轨道如为sp,只能容纳两个自旋相反的电子。而spd轨道可以容纳6个电子,其中每个sp轨道各一个,两个d轨道各两个。因此,该题说法正确。'
A:错 B:对
AI参考:答案:B。缓冲对是由共轭酸碱构成的,能缓解溶液的酸碱性的对称为缓冲对,故凡共轭酸碱均能组成缓冲对并产生缓冲作用的说法是正确的。所以本题选B。'
A:对 B:错
A:错 B:对
AI参考:正确。色散力主要存在于非极性分子之间,卤化氢分子间色散力由强到弱的顺序为HF>HCl>HBr>HI。因此,选项B“对”是正确答案。'
温馨提示支付 ¥1.50 元后可查看付费内容,请先翻页预览!