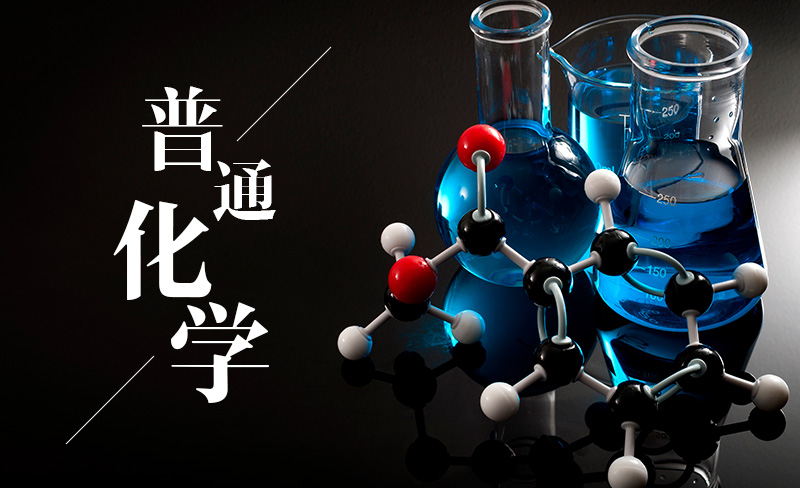
- 某反应,若反应物浓度的减少与时间成正比,则反应级数为零级。( )
- 缓冲比一定时,总浓度越大,缓冲溶液的缓冲容量越大。( )
- 状态函数是物质现有状态的性质,它与形成该状态的途经无关。( )
- 内能的改变值ΔU可通过测定Q和W算出。由于内能是状态函数,因此,热和功也是状态函数。( )
- 缓冲溶液稍加稀释后,缓冲比基本不变,缓冲溶液的pH值也基本不变。( )
- 对绝大多数化学反应而言,升高温度,吸热反应速率增大,而放热反应的反应速率却下降。( )
- 线型高聚物的柔顺性不如体型高聚物的好。( )
- 卤化氢分子间色散力由强到弱的顺序为HF>HCl>HBr>HI ( )。
- 因为结晶聚合物的结晶度为100%,所以具有精确的熔点。( )
- 极性分子和非极性分子间一定存在( )。
- 下列关于加聚反应特点的论述正确的有( )。
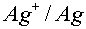
- 共聚反应中,根据不同单体聚合的序列不同,可以生成多种形式的共聚物,包括:( )。
- 水对玻璃润湿,汞对玻璃不润湿,将一玻璃毛细管分别插入水和汞中,下列叙述不正确的是( )。
- 下列关于强、弱电解质的叙述,错误的是( )。


- 对基元反应而言,下列叙述中正确的是( )

- 勒·夏特列原理(平衡移动原理)适用于以下哪种情况?( )
- 下列分子,属于平面三角形构型的为( )。
- 某化学反应,消耗75%反应物所需时间是消耗50%所需时间的2倍,则该反应的级数为( )
- 在元素周期表中电负性最大的元素是 ( )。
- 下列分子形状是V字形的为 ( )。
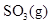
- 下列原子中电子的量子数,对应的能量最大的是 ( )。
- 下列物质在 0 K 时的标准熵为0的是( )。
- 在绝热容器中,电热丝浸入水中,通电10s,通电后水及电阻丝的温度均略有升高,今以电阻丝为系统,下列选项正确的是( ) 。
- 若某原电池的标准电动势大于0V,则此电池反应的摩尔吉布斯函数变必然小于0。( )
- 体系经历一个循环,无论多少步骤,只要回到起始状态,其热力学能和焓的变化量ΔU和ΔH 都为零。。( )
- 同一原子轨道仅可容纳 2 个自旋相反的电子。( )

- 多电子原子的原子轨道的取向由磁量子数m决定。( )
- 共价键和分子间取向力一样都是既具有饱和性又具有方向性 ( )。
- 根据高分子液晶形成条件的不同,高分子液晶可以分为热致性液晶和溶致性液晶。( )
- 燃料电池也称为连续电池,它是将电能转化为化学能的装置。( )
- 反应的热效应就是反应的焓变。( )
- 将一块0℃的冰放在0℃的食盐水中,则( )。
- 量子力学中说的原子轨道是指 ( )。
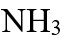
- 在一定条件下,一个反应达到平衡的标志是( )
- 胶束的出现标志着表面活性剂的( )。

- 表面现象在自然界中普遍存在,但有些自然现象与表面现象并不密切相关,例如( )。
- 氢电极的电极电势等于0 V。( )
- 结晶必须在玻璃化温度与熔点之间的温度范围内进行。( )
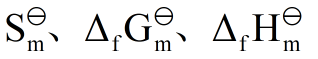
- 若反应的ΔH 和 ΔS 都是正值,则随着温度的升高反应自发进行的可能性增加。( )
- 弱酸及其盐组成的缓冲溶液的pH值必定小于7。( )
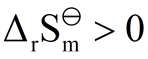
- 在p轨道的能量一定高于s轨道的能量。( )
- 对于给定的氧化还原电对,写成还原反应形式的能斯特方程与写成氧化反应形式的能斯特方程的是完全相同的。( )
- 在氧化还原反应中,氧化剂失去电子,氧化值升高,进行的是还原反应。( )
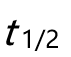
- 下列关于形成高分子液晶的条件,不正确的是( )。
- 下列关于高弹态的论述,不正确的是( )。
- 过渡态理论中的活化配合物就是活化分子。( )
- 在大多数情况下,色散力是最主要的分子间作用力。( )
- 高分子分子链的几何形状有( )。
- 氧化还原反应的标准平衡常数只与氧化剂和还原剂的本性、温度及反应中转移的电子数有关,而与反应物浓度无关。( )
- 对于电极电势的叙述,不正确的是( )。
- 下列说法正确的是:( )。
- 氧化还原反应中两个电对的电极电势相差越大,则氧化还原反应的速率越大。( )
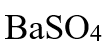
- 对于任何一个化学变化,影响平衡常数数值的因素是( )

- 将4.5g某非电解质溶于125g水中,测得此溶液凝固点为-0.372℃,则该物质的相对分子质量为( )。
- 体系对环境作20 kJ的功,并失去10 kJ 的热给环境,则体系内能的变化为( )。

- 盖斯定律认为化学反应的热效应与途径无关,这是因为反应处在( )。
- 主量子数的符号用n表示,当n=4时,角量子数可取( )个数值。
- 速率常数k是( )


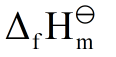
- 某反应在标准状态和等温等压条件下,在任何温度都能自发进行的条件是( )。
- 下列物质的水溶液,存在电离平衡的是( )。
- 下列叙述中正确的是( )
- 对于一个给定条件下的反应,随着反应的进行( )
- 两个半电池,电极相同,电解质溶液中各物质相同,都可以进行电极反应,但溶液浓度不同,将两个半电池用盐桥和导线联接,这个电池的电动势( )。

- 在下列电对中,298.15K时标准电极电势最高的是 ( )。
- 对于等温等压下不做非体积功的体系,若在非标准状态下自发进行,下列表示正确的是( )。
- 双亲性分子能作为表面活性剂的原因是( )。
- 蔗糖、葡萄糖各10g,分别溶入100g水中,成为A、B两溶液。用半透膜将两溶液隔开,则( )。
- 对于任一过程,下列叙述正确的是( )。


- 下列诗句中涉及的高分子化合物,不属于天然高分子的是( )。
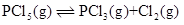
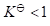
- 乳化剂具有乳化作用,最根本的原因是( )
- 酚醛树脂的聚合物是加聚反应,会产生小分子副产物,可能对环境产生危害。( )
- 聚合物是一种纯净物。( )
- 下列关于高分子化合物一级结构的论述,正确的有( )。
- 加聚反应的特点包括( )。
- 下列高分子材料中属于均聚高分子的是( )。
- 下列几种元素中原子半径最大的是 ( )。
- 电子等微观粒子运动具有的特征是 ( )。
- 下列基态原子或离子中,不具有 d5电子排布的是 ( )。
- 下列元素原子对其外层电子所显示的有效核电荷最大的是 ( )。
- 下列原子中电子的运动状态表示不合理的是 ( )。
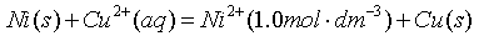
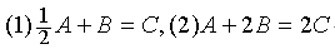
- 氧化还原电对的标准电极电势越高,表示该电对中氧化态物质的氧化能力越强。( )
- 将某氧化还原反应组成原电池,下列说法正确的是( )。
- 将下列反应设计成原电池时,不用惰性电极的是( )。
- 水不能润湿荷叶表面,接触角大于90°,当水中加入皂素后,接触角将( )。
- 将CuS溶解在HAc-NaAc缓冲溶液中,体系的pH将( )。
- “W/O型乳状液”的含义是( )
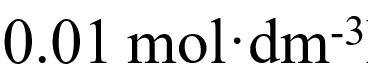
- 1L溶液中含有0.10mol醋酸和0.01mol醋酸钠,该溶液的pH值是( )(已知25℃时醋酸的pKa=4.75)。
- 二级反应的速率常数单位是( )。
- 正、逆反应的活化能数值相等,符号相反。( )
- 对于一个确定的化学反应来说,下列说法中正确的是( )。
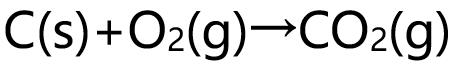
- 任意两个反应相比,速率常数k较大的反应,其反应速率必较大。( )
- 下列哪一种有关多重化学平衡系统的说法是错误的 ( )。
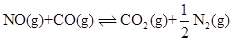
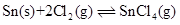
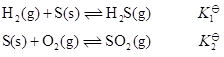
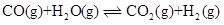
- 下列状态函数中,绝对值可以确定的是( ) 。
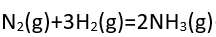
- 以ΔU=Q-pΔV表示的热力学第一定律,适用条件是( ) 。
- 在绝热容器中,电热丝浸入水中,通电10s,通电后水及电阻丝的温度均没有升高,今以电阻丝为系统,下列选项正确的是( ) 。
- 19世纪初,某科学家提出了原子学说,他认为物质由原子组成,原子不能被创造,也不能被毁灭,在化学反应中不能再分,这个科学家是( )。
- 2020年10月7日,诺贝尔化学奖颁给法国和美国科学家Emmanuelle Charpentier、Jennifer A. Doudna,以表彰她们“开发出一种基因组编辑方法”,下列说法错误的是( )。
- 宋代《开宝本草》中记载:“此即地霜也,所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”。文中对火硝(硝酸钾)提取没有设计的操作方法是:( )。
- 晋朝葛洪的《肘后备急方》中记载:“青蒿一握,以水二升渍,绞取汁,尽服之……”,受此启发为人类做出巨大贡献的科学家是( )。
- 以下发明或发现属于化学史上中国对世界做出重大贡献的是( )。
答案:对
答案:对
答案:对
答案:错
答案:对
答案:错
答案:错
答案:错
答案:错
答案:色散力###诱导力
答案:有小分子副产物生成###加聚反应中的单体必须具有不饱和键或环状结构###缩聚过程涉及两种甚至两种以上不同官能团之间的反应
温馨提示支付 ¥5.00 元后可查看付费内容,请先翻页预览!