云南大学
- NH4H2PO4水溶液的质子条件式为___。
- 写出用NaOH滴定HAc(Ka= 5.610-5)和H3BO3(Ka = 5.610-10)到化学计量点时体系的质子平衡方程___。
- EDTA络合滴定中,条件稳定常数K′越大,滴定的突跃范围越___;在允许滴定的pH范围内,酸度越大,滴定的突跃范围越___。
- 在1L 0.1mol/L HAc溶液中加入___g NaOH固体后,溶液的pH为4.74(已知HAc的pKa = 4.74;NaOH的分子量为40.0 g/mol)。
- https://image.zhihuishu.com/zhs/onlineexam/ansewerImg/202403/85c0976daf1442959a7a6088f4fda778.png
- 用重量法测定As2O3(M =197.8 g/mol)的含量时,将As2O3溶于NaOH溶液,处理为AsO43-,然后形成Ag3AsO4(M =462.6 g/mol)沉淀,过滤、洗涤、将沉淀溶于HNO3后,再以AgCl(M =143.3 g/mol)形式沉淀和称重,则换算因数为___。
- https://image.zhihuishu.com/zhs/onlineexam/ansewerImg/202403/fd46473b9b3c4a1398a1011a6522f252.png
- CuS沉淀在0.01mol/LHCl中的溶解度大于在纯水中的溶解度是因为___;BaSO4沉淀在0.1mol/L NaCl溶液中的溶解度大于在纯水中的溶解度则是因为___。
- https://image.zhihuishu.com/zhs/onlineexam/ansewerImg/202403/586ffc9b105642a493b86500204b4951.png
- 利用重量分析法测定P2O5(141.94 g·mol-1)时,使试样中P转化为MgNH4PO4(M=137.32 g·mol-1)沉淀,再灼烧为Mg2P2O7(M=222.55 g·mol-1)形式称量,其换算因子为___。
- C1(mol/L)NaAc + C2(mol/L)H3BO3的质子平衡条件式___。
- 已知As2S3的溶解为2.0×10-4g·L-1,它的溶度积是___。
- https://image.zhihuishu.com/zhs/onlineexam/ansewerImg/202403/4caba136da9743e193625d2a236070da.png
- https://image.zhihuishu.com/zhs/onlineexam/ansewerImg/202403/d9a60a91e1314a70a443131d25235a65.png
- 利用CaC2O4(M = 128.10 g/mol)沉淀、灼烧为CaO(M = 56.08 g/mol)形式称重,测定KHC2O4·H2C2O4 (M = 218.2 g/mol)时,其换算因子为___。
- 分析测定中的偶然误差偶然误差具有单项性和可预测性。( )
- 在分析化学的数据中,并不是所有的“0”都是有效数字。( )
- 对于某一给定的缓冲体系, 缓冲容量的大小与缓冲物质总浓度和酸与共轭碱浓度比有关。( )
- 佛尔哈德法应在酸性介质中进行,目的是为了防止Fe3+的水解。( )
- 高锰酸钾法中使用的指示剂属于自身指示剂。( )
- 用沉淀滴定法中的莫尔法测定I-时,将产生较大的负误差,这是因为AgI对I-的强烈吸附作用。( )
- 当指示剂与待测离子生成的配合物的稳定性高于滴定剂与待测离子生成的配合物的稳定性时,会出现指示剂的封闭现象,从而无法指示终点。( )
- 数据0.06078和0.6078均有四位有效数字。( )
- 重铬酸钾法中使用的指示剂属于自身指示剂。( )
- NaOH是非基准物质,常用基准物质邻苯二甲酸氢钾进行浓度标定。( )
- 使用莫尔法时,滴定体系的酸度不能太高,原因是酸度太高时,CrO42-会转化为Cr2O72-,而影响Ag2CrO4沉淀的形成,从而影响终点的到达。( )
- 用法扬司法沉淀滴定海水中卤素的总量时,加入糊精是为了防止沉淀凝聚,增加沉淀比表面积。( )
- 用KMnO4法测定Fe时,滴定的速度在滴定开始时不宜太快。( )
- 若A-为强酸根,且体系中存在可与金属离子M形成络合物的试剂L,则难溶盐MA在水中的溶解度为
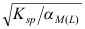 。( )
。( ) - 用高锰酸钾滴定草酸时,高锰酸钾的颜色消失由慢到快是由于Mn2+的自催化作用。( )
- 络合滴定中,当络合物的条件稳定化常数
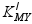 一定时,金属离子的分析浓度CM越大,突跃越大。( )
一定时,金属离子的分析浓度CM越大,突跃越大。( ) - 碘量法中使用的指示剂属于自身指示剂。( )
- 晶型沉淀的沉淀条件是:稀、热、慢、搅、陈。( )
- ZnS易于在HgS沉淀表面而不在BaSO4沉淀表面继沉淀。( )
- 继沉淀引入杂质的量随放置时间的延长而增加。( )
- 计算浓度c为0.1 mol/L的NaOH滴定等浓度的某二元弱酸H2A(已知其pKa1=4.0、pKa2=9.5)到第一化学计量点时溶液中的[H+],应选用下列哪一个公式( )
- 用K2Cr2O7法测定铁时,加入H2SO4-H3PO4的作用不包括( )
- 强酸滴定强碱时,若酸、碱的浓度均增大10倍,则滴定突跃增大的pH单位是( )
- 用KMnO4滴定Fe2+之前,加入几滴MnSO4是作为( )
- 已知某种规格的微量滴定管的读数误差为±0.002mL,为使分析结果误差小于0.2%,一次至少应用滴定剂( )
- 用0.1mol/L的NaOH溶液滴定0.1mol/L的HCl和0.1mol/L的H3PO4(Ka1=7.610-3、Ka2=6.310-8、Ka3=4.410-13)的混合溶液,在滴定曲线上出现几个突跃( )
- 某试样可能含有NaH2PO4、Na2HPO4或Na3PO4,以酚酞为指示剂,用HCl标准溶液滴定消耗V1(mL),再以甲基橙作指示剂,用HCl标准溶液滴定,消耗V2(mL),已知V1=0,V2>0,试样的组成可能为( )
- 测定(NH4)2SO4中的氮时,不能用NaOH直接滴定的原因是( )
- 某一NaOH和Na2CO3混合液,用HCl溶液滴定,以酚酞为指示剂,耗去HCl V1(mL), 继以甲基橙为指示剂继续滴定,又耗去HCl V2(mL),则V1与V2的关系是( )
- 在络合滴定中,用返滴法测定Al3+时,若在pH=5~6时以某金属离子标准溶液返滴定过量的EDTA,金属离子标准溶液最好选( )
- 下列多元酸或混合酸中,用NaOH溶液滴定时出现两个滴定突跃的是( )
- 下列论述中错误的是( )
- 将含Pb2+和Bi3+的混合溶液调节pH到1.0,以二甲酚橙为指示剂,用EDTA标准溶液滴定到化学计量点后,再用六次甲基四胺缓冲溶液调pH到5.0,继续用上述EDTA标准溶液滴定到化学计量点。请问第二步滴定的是溶液中的哪些离子(已知lgKPbY=18.07;lgKBiY=27.94;pH1.0时,lgY(H)=18.1;pH5.0时,lgY(H)=6.45。( )
- 由两个分析工作者对同一样品进行分析,得到两组分析结果,若要判断这两组分析结果之间是否存在系统误差,应该选用下列哪种方法( )。
- 在Fe3+/Fe2+电对体系中加入F-(可络合Fe3+),将导致电对的条件电位( )
- 采用EDTA络合滴定测定无色金属离子时,终点所呈现的颜色是( )
- 下列关于EDTA与金属离子M络合物的描述中,不正确的是( )
- 下列要求中哪一条不是重量分析对称量形式的要求( )
- 用Ce4+标准溶液滴定溶液中的Fe2+到50%时,体系的电位是(已知
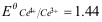 V,
V,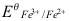 =0.68V)( )
=0.68V)( ) - 欲配制pH=5.1的缓冲溶液,缓冲体系最好选择( )
- 络合反应一般都是在一定的pH下进行的。为保证pH值在整个络合滴定过程中维持在允许的范围内,需加入一定量的下列那种物质( )
- 某弱酸HA的离解常数为Ka,其共轭碱A-的离解常数和质子化常数分别为Kb和KH,则Ka、Kb和KH的关系为:( )
- 用佛尔哈德法测定Cl-时,忘记在溶液中加硝基苯,并在滴定过程中剧烈摇动,将导致结果( )
- 将含Fe3+和Cd2+的混合溶液调节pH到1.0,用EDTA标准溶液滴定到化学计量点后,再将溶液的pH调到5.0,继续用上述EDTA溶液滴定到化学计量点。请问第一步滴定的是溶液中的哪些离子(已知lgKFeY=25.1;lgKCdY=16.47;pH1.0时,lgY(H)=18.1;pH5.0时,lgY(H)=6.45)( )
- EDTA的酸效应曲线是指( )
答案:[H+] +[H3PO4] = 2[PO43-]+ [HPO42-] + [OH-]
答案:对于NaOH滴定HAc(醋酸)到化学计量点时: 设反应为:\[ HAc + NaOH \rightarrow NaAc + H_2O \] 质子平衡方程表示体系中氢离子(H+)、氢氧根离子(OH-)和水分子(H2O)之间的关系。由于在滴定过程中,NaOH会完全反应生成NaAc,因此NaAc的浓度等于NaOH的初始浓度减去与HAc反应掉的NaOH浓度。 在化学计量点时,假设NaOH的初始浓度为c(M),则反应掉的NaOH浓度也为c,所以NaAc的浓度为c,而剩余的HAc浓度为0(因为所有的HAc都参与了反应)。此时,水的浓度不变。 质子平衡方程可以表示为: \[ [H^+] = \frac{K_w}{[OH^-]} \] 其中 \(K_w = 1 \times 10^{-14}\) 是水的离子积常数。 但是,由于在化学计量点时体系中没有HAc,只有NaAc,而NaAc是弱酸盐,它在水中会水解产生H+和OH-,所以实际的平衡方程应该是考虑NaAc的水解: \[ [H^+] = [OH^-] \] 对于H3BO3(硼酸)滴定到化学计量点时: 设反应为:\[ H_3BO_3 + NaOH \rightarrow NaB(OH)_4 \] 质子平衡方程同样考虑体系中氢离子、氢氧根离子和水分子的关系。硼酸是比醋酸更强的弱酸,其一级电离常数更小(\(K_a = 5.6 \times 10^{-10}\))。 在化学计量点时,假设NaOH的初始浓度为c(M),则反应掉的NaOH浓度也为c,所以生成的NaB(OH)_4的浓度为c,而剩余的H_3BO_3浓度为0(因为所有的H_3BO_3都参与了反应)。 由于NaB(OH)_4也是弱酸盐,它会在水中水解产生H+和OH-,所以质子平衡方程同样表示为: \[ [H^+] = [OH^-] \] 综上所述,填空答案为: - 对于HAc:\[ [H^+] = [OH^-] \] - 对于H3BO3:\[ [H^+] = [OH^-] \]
答案:大小
答案:2
答案:
答案:M(As2O3)/6M(AgCl)
答案:
答案:盐效应
答案:
A:对 B:错
A:错 B:对
A:对 B:错
A:错 B:对
A:对 B:错
A:对 B:错
A:错 B:对
A:对 B:错
A:错 B:对
A:错 B:对
A:错 B:对
A:对 B:错
A:对 B:错
A:对 B:错
A:错 B:对
A:错 B:对
A:错 B:对
A:错 B:对
A:对 B:错
A:错 B:对
A:
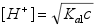 ;
B:
;
B: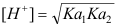 ;
C:
;
C: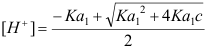 ;
D:
;
D: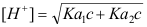
A:降低Fe3+/Fe2+电对的电位 B:提供必要的酸度; C:掩蔽Fe3+; D:消除Cl-的影响;
A:1个单位 B:2个单位 C:10个单位 D:不变化
A:诱导剂; B:氧化剂; C:配位剂 D:催化剂;
A:10mL B:1mL C:2mL D:20mL
A:1个; B:2个; C:3个; D:4个
A:Na3PO4+Na2HPO4; B:Na3PO4 C:Na3PO4+NaH2PO4; D:NaH2PO4+Na2HPO4;
A:(NH4)2SO4中含有游离的H2SO4 B:NH4+的Ka太小 C:(NH4)2SO4不是酸 D:NH3的Kb太小
A:V1>V2 B:2V1=V2 C:V1=V2 D:V1=2V2
A:Zn2+; B:Ag+; C:Bi3+ D:Mg2+;
A:H2C2O4(Ka1 = 5.910-2、Ka2 = 6.410-5); B:H3PO4(Ka1 = 7.610-3、Ka2 = 6.310-8、Ka3 = 4.410-13); C:酒石酸(Ka1 = 9.110-4、Ka2 = 4.310-5); D:HCl加一氯乙酸(Ka = 1.410-3)
A:随机误差大,系统误差也一定大 B:系统误差一般可以通过测定加以校正 C:随机误差小,是保证准确度的先决条件 D:随机误差呈正态分布
A:没有被滴定 B:Pb2+; C:Bi3+; D:Pb2+与Bi3+;
A:F检验法; B:F检验加t检验; C:t检验法; D:Q检验法
A:无法确定 B:无变化; C:减小; D:增大;
A:EDTA-金属离子络合物的颜色; B:指示剂-金属离子络合物的颜色; C:游离指示剂的颜色; D:A与C的混合颜色
A:EDTA与M生成的络合物具有多元环状结构; B:EDTA与M络合物的稳定化常数在任何条件下均为一固定不变的常数。 C:EDTA与无色金属离子生成的络合物无色; D:EDTA与大部分金属离子生成摩尔比为1:1的络合物;
A:组成与化学式完全符合; B:分子量要大; C:颗粒要粗大 D:性质稳定;
A:0.86V B:1.44V C:0.68V D:1.06V
A:氨水(pKb=4.74) B:六次甲基四胺(pKb=8.85) C:甲酸(pKa=3.74) D:一氯乙酸(pKa=2.86)
A:合适的缓冲溶液 B:盐; C:碱; D:酸;
A:Kb=Ka/Kw,KH=1/Kb; B:Kb=Kw/Ka,KH=Ka/Kw; C:Kb=1/Ka,KH=Kw/Ka; D:Kb=Kw/Ka,KH=1/Ka;
A:无影响 B:正负误差不一定 C:偏低 D:偏高
A:Cd2+; B:Fe3+; C:没有离子被滴定 D:Fe3+和Cd2+;
A:pM-pH曲线; B:lgK'(MY)-pH曲线; C:lgaY(H)-pH曲线 D:aY(H)-pH曲线;
温馨提示支付 ¥5.00 元后可查看付费内容,请先翻页预览!


