第二章 多组分体系热力学:通过引入偏摩尔量这个概念,本章将单组分体系得到的结论进行修正,推导其在在多组分体系中的运用,最终推导出化学势判据,并介绍气体和液体中各组分的化学势计算方法。2.1多组分体系组成表示法:介绍混合物、溶液等多组分体系概念,以及这些概念在本课程与其他场景中的区别。[单选题]
2.2偏摩尔量:通过对比广度性质的部分可加和性在单组分体系和多组分体系中的区别,介绍多组分体系中广度性质状态函数的表达式,进而通过偏摩尔量,介绍单组分体系热力学中的结论在多组分体系中的修正方法。
2.3化学势:介绍化学势概念、化学势判据以及相关的知识点。
2.4气体的化学势:介绍理想气体和实际气体的化学势计算方法。
2.5稀溶液的两个经验定律:介绍分别用于描述稀溶液中溶剂和溶质的休克尔定律和亨利定律
2.6理想液态混合物及理想稀溶液的化学势:本节对理想液态混合物和理想稀溶液的化学势公式进行推导,并且通过实例进行计算讲解。
2.7稀溶液的依数性:稀溶液与纯溶剂相比某些物理性质会有所变化如蒸气压下降、凝固点降低、沸点升高和渗透压的产生。这是多组分系统中化学势随组分数而表现出来的自身变化规律,溶液的依数性只有在溶液的浓度很稀的时候才有规律,而且溶液越稀,其依数性的规律性越强。依数性与溶质的本性无关,由溶质粒子数目的多少决定,因此被称为稀溶液依数性。
2.8知识点总结:本节内容对前边介绍的化学热力学的内容进行了总结,并且对学生学习化学热力学过程中容易混淆的概念进行了重点解释。
2.9熵和不可逆热力学:为了帮助同学更好理解熵判据在化学热力学中的地位,本节介绍了一些关于熵这个概念的延伸知识;同时,作为对前边经典热力学的补充,本节内容也对不可逆热力学进行了简要的介绍。
 选项:[G, 凝固热, S
选项:[G, 凝固热, S, 蒸汽压]
[单选题]
 选项:[=0, 无法确定, <0 , >0 ]
选项:[=0, 无法确定, <0 , >0 ][判断题]在定温定压下,任一组分在全部浓度范围内都符合亨利定律的溶液,称为理想溶液选项:[错, 对]
[判断题]单组分体系的偏摩尔量即为摩尔量选项:[对, 错]
[判断题]偏摩尔量就是化学势选项:[错, 对]
[单选题]
, 与溶液的组成无关, 小于任一纯组分的蒸气压]
[单选题]
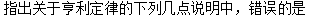 选项:[溶质必须是非挥发性的, 温度愈高或压力愈低,溶液愈稀,亨利定律愈准确, 对于混合气体,在总压力不太大时,亨利定律能分别适用于每一种气体,与其他气体的分压无关, 溶质在气相和在溶剂中的分子状态必须相同]
选项:[溶质必须是非挥发性的, 温度愈高或压力愈低,溶液愈稀,亨利定律愈准确, 对于混合气体,在总压力不太大时,亨利定律能分别适用于每一种气体,与其他气体的分压无关, 溶质在气相和在溶剂中的分子状态必须相同][单选题]
[判断题]化学势判据就是Gibbs自由能判据选项:[错, 对]
[判断题]单组分系统的熔点随压力的变化可用克劳休斯-克拉佩龙方程解释选项:[对, 错]

