提示:内容已经过期谨慎付费,点击上方查看最新答案
无机化学(内蒙古民族大学)
- 1.17%的NaCl溶液产生的渗透压接近于
(相对原子质量:Na23,Cl35.5) ( ) - 下列分子中偶极矩大于0的分子是( )
- 几何形状是平面三角形的离子是( )
- 一级反应的半衰期与反应物初始浓度的关系为( )
- 某化学反应的速率常数的单位是(时间)^-1,则反应是( )
- 冰的熔化热为6008J•mol^-1,在0℃时1.00 mol冰熔化时的熵变为( )
- 2.9%的NaCl(摩尔质量58.5g•mol^-1)溶液产生的渗透压接近于( )
- 1dm^3含甘油(相对分子质量92.0)46.0g的水溶液, 在27℃时的渗透压为( )
- 0.542gHgCl2(相对分子质量为271)溶于50g水中,溶液的凝固点为-0.0744℃,(水的Kf=1.86 K•kg•mol^-1 )则 HgCl2在水中是( )
- 取下列物质各10g,分别溶于1000g苯,溶液开始凝固时温度最低的是( )
- 下列物质在0K时的标准熵为0的是( )
- 下列偶极矩不等于零的分子是( )
- 要使溶液的凝固点降低1.0℃,需向100g水中加入KCl的物质的量是(水的Kf=1.86K•kg•mol^-1)( )
固体物质溶于水时,形成溶液的凝固点( ).
- 0.100mol•kg^-1HAc 溶液的电离度为1.33%, 则该溶液的凝固点应为(水的Kf=1.86K•kg•mol^-1)( )
在H原子中,对r = 0.53
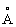 (10^-8cm) 处的正确描述是( )。
(10^-8cm) 处的正确描述是( )。某反应在标准态和等温等压条件下,在任何温度都能自发进行的条件是( )。
- 可用于物质提纯的相变是( )
- 在固体催化剂表面进行的气相反应属于( )
- 用0.20mol•dm^-3HAc和0.20mol•dm^-3NaAc溶液直接混合(不加水),配制1.0dm^3
pH=5.00的缓冲溶液,需取0.20mol•dm^-3 HAc溶液为(pKa(HAc)=4.75)( ) 固体溶于水时, 与其溶解热有关的是( )。
- 对于一个给定条件下的反应,随着反应的进行说法不正确的是( )
- BF3和CO2分子中,中心原子分别采取的是等性sp^2杂化呵sp杂化,所以BF3和CO2分子的构型是( )
- 要降低反应的活化能,采取的方法不正确是( )
- CH4和CH2= CH2分子中C原子采取的杂化形式分别是( )
- 某原子的符号为67(下标)139(上标)M,由此知道( )
- 将NaCl晶体溶于水中得到NaCl溶液,此过程熵值和吉布斯自由能变( )
- 下列说法正确的是( )
- 对于一个特定的反应,不会影响K^Ɵ(T)值的因素是( )
- 下列量子数取值合理的是( )
- 关于零级反应的速率不正确的事( )
- 下列过程中熵值减小的是( )
- 下列化合物中存在氢键的是( )
- 下列说法中不正确的是( )
下列哪个反应对应的能量变化是NaCl和NaF的晶格能( )
- 用分子轨道理论来判断下列说法,正确的是( )
- 下列分子中是极性分子的是( )
- 下列分子中偶极矩为零的是( )
- 主量子数n=4时,角量子数不能取( )
- 核外电子运动的特征是( )
- [Co(NH3)2Cl2]Cl的系统命名为三氯二氨合钴(Ⅲ)。( )
- 电子的波动性是电子运动时呈波浪式的前进。( )
因为I2作氧化剂时,I2+2e =2I-,EΘ (I2/ I-)=0.535V,所以I-作还原剂时,2I- - 2e = I2,EΘ (I2/ I-)=-0.535V。( )
- 酸性水溶液中不含氢氧根。( )
- 弱酸溶液越稀,其解离度越大,所以溶液中的H^+浓度越大。( )
- 与纯溶剂相比,溶液的蒸气压一定降低。( )
质量作用定律是一个普遍的规律,适合于任何化学反应。( )
298K时,最稳定纯态单质的
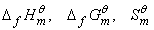 均为零。( )
均为零。( )将NaOH溶液和氨水的浓度各稀释为原来的一半,则两种溶液中OH - 浓度均减小为原来的一半。( )
- 化学反应的速率大小与反应物分子之间碰撞次数有关。( )
- 将正常红细胞放入氯化钠溶液中,发生了溶血现象,则该氯 化钠溶液为低渗溶液。( )
- n=3,l=2轨道的名称为3d。( )
- 甲醇的水溶液中,存在CH3OH与H2O形成的分子间氢键。( )
- 由极性键组成的分子一定是极性分子。( )
- 反应活化能越大,反应速率也越大。( )
- 在一定条件下,化学反应的活化能越大,其反应速率越快。( )
- 催化剂既可以加快反应速率又可以提高反应物的转化率。( )
- 化学反应热效应为负值的反应均不能自发进行。( )
以电子概率密度表示的空间图像即为原子轨道,波函数的空间图像即为电子云。( )
- 加催化剂能加快反应速率,使平衡向正反应方向移动。( )
反应2H2 + 2NO = 2H2O + N2的实验数据如下:
NO的初始浓度 / mol·dm-3
H2的初始浓度 / mol·dm-3
初始速率r/mol·dm-3·s-1
6.00×10-3
1.00×10-3
3.19×10-3
6.00×10-3
2.00×10-3
6.36×10-3
1.00×10-3
6.00×10-3
0.48×10-3
2.00×10-3
6.00×10-3
1.92×10-3
含有ⅠB和ⅡB两种离子的混合液, 向其中加入氯化钠溶液产生白色沉淀A, 过滤分离后, 向A中加入氨水部分溶解为无色溶液B, 往其中加硝酸产生白色沉淀C,而部分沉淀A加氨水后转化为灰黑色沉淀D. 将D溶于硝酸形成无色溶液, 往此溶液中加入KI产生桔红色沉淀E. A, B, C, D, E各为何物。
A:0.20mol•dm^-3葡萄糖溶液 B:0.40mol•dm^-3蔗糖溶液 C:1.17%葡萄糖溶液 D:1.17%蔗糖溶液
答案:0.40mol•dm^-3蔗糖溶液
A:PF5 B:BF3 C:SF4 D:SnF4
答案:SF4
A:CH3^- B:SO3^2- C:NO3^- D:SnCL3^-
答案:NO3-
A:立方根成正比 B:成正比 C:成反比 D:无关
答案:无关
A:零级反应 B:三级反应 C:二级反应 D:一级反应
答案:一级反应
A:-22.0 J•mol^-1•K^M46-1 B:0 C:22.0 J•mol^-1•K^-1 D:334 J•mol^-1•K^-1
A:5.8%的蔗糖溶液 B:2.9%的蔗糖溶液 C:1mol•kg^-1 的蔗糖溶液 D:0.5mol•kg^-1的蔗糖溶液
AI参考:正确答案是C:1mol•kg-1的蔗糖溶液。渗透压与溶液中溶质的摩尔浓度成正比,而摩尔质量相同的物质,其摩尔浓度与质量百分数成反比。因此,2.9%的NaCl溶液产生的渗透压应该接近于1mol•kg-1的蔗糖溶液。选项ABD都与题干中给出的信息不符。'
A:1.25×10^3 kPa B:1.13×10^3 kPa C:2.49×10^3 kPa D:112kPa
AI参考:正确答案是【B:1.13×10^3 kPa】。已知甘油的质量为46.0g,其摩尔质量为92g/mol,故溶液中含有的甘油物质的量为:$n(甘油) = frac{m(甘油)}{M(甘油)} = frac{46.0g}{92g/mol} = 0.5mol$;甘油分子中有3个水分子,所以该溶液中含有的水分子数为$n(水分子) = 3 \times n(甘油) = 3 \times 0.5mol = 1.5mol$。水的质量为$m(水) = 1.5mol \times 18g/mol = 27g$。溶液的质量为$m = m(甘油) + m(水) = 46.0g + 27g = 73g$,则溶液的密度约为$\rho = frac{m}{V} = frac{73g}{73mL} = 1.0g/mL$。在27℃时,水的密度为$1g/mL$,根据渗透压与溶液密度成正比,可求得该溶液的渗透压为:$P = \rho_{液} \times c_{液} = 1 \times (m(甘油) + m(水))/V_{液} \times RT/N_{A} = 1 \times (46 + 27)/73 \times 8.314 \times (273 + 27)/6.02 \times 10^{23} = 1.13 \times 10^{3}kPa$。因此,答案为B。'
A:不能确定是否电离 B:不电离 C:完全电离 D:部分电离
A:CHCl3 B:CH2Cl2 C:CCl4 D:都在同一温度
A:完美晶体 B:理想气体 C:理想溶液 D:纯液体
AI参考:正确答案是D:纯液体。在0K时,物质的熵值与其微观结构有关,完美晶体和理想气体都是指没有缺陷的微观结构,其标准熵为无穷大。理想溶液虽然是有机物之间的混合物,但其混合后各组分的熵值会降低,所以其标准熵不为零。因此,在0K时标准熵为零的物质应该是没有微观结构的纯液体。所以答案为D:纯液体。'
A:BF3 B:NF3 C:CO2 D:BeCl2
AI参考:正确答案是B:NF3。B选项中的NF3分子中存在极性键和非极性键,且正负电荷中心不重合,因此其偶极矩不为零。而其他选项中的分子中均不存在极性键和非极性键,且正负电荷中心重合,因此其偶极矩为零。因此,正确答案是B。'
A:0.27mol B:0.054mol C:0.54mol D:0.027mol
A:根据固体性质而定 B:降低 C:升高 D:不变
AI参考:正确选项是【D:不变】。固体物质溶于水时,形成溶液的凝固点不变。溶液是一种混合物,凝固点是指液体物质从液态转变为固态时的温度,而凝固点的高低与溶质和溶剂的性质无关,只与液体的性质有关。因此,无论是溶解哪种固体物质,形成溶液的凝固点都是不变的。'
A:-0.186℃ B:-0.25℃ C:-0.188℃ D:-0.21℃
AI参考:正确答案是:C:-0.188℃。凝固点下降ΔTf=Kf×m×a=1.86×0.100×1.33%=0.026K,凝固点降低常数Kf=1.86K•kg•mol-1,所以凝固点为-0.188℃。故答案为C。'
A:该处1s电子云最大 B:该处为H原子Bohr半径 C:该处是1s电子云界面 D:r是1s径向分布函数的平均值
AI参考:通过对题目中的信息进行分析,可以得知题目要求选择在H原子中r=0.53(10^-8cm)处的正确描述。选项A、B、D都与该处的具体描述无关,因此可以排除。而选项C“该处是1s电子云界面”与题目中的描述相符合,因为根据电子云理论,在原子中,电子云界面表示电子在原子核附近出现的概率密度较高的区域。因此,根据题目要求和选项分析,答案为C:“该处是1s电子云界面”。'
A:< 0,> 0 B:> 0,< 0 C:> 0,> 0 D:< 0,< 0
A:沸腾 B:三种相变都可以 C:凝固 D:升华
A:酶的催化反应 B:多相反应 C:双分子反应 D:均相反应
A:6.4×10^2cm^3 B:3.6×10^2cm^3 C:3.5×10^2cm^3 D:6.5×10^2cm^3
A:水分子之间的相互作用 B:固体的分子量 C:固体溶质之间的相互作用 D:溶质和水之间的相互作用
AI参考:正确选项是:A:水分子之间的相互作用 D:溶质和水之间的相互作用。解释:固体溶于水时,溶解热主要与水分子之间的相互作用和溶质和水之间的相互作用有关。水分子之间的相互作用会影响溶剂分子之间的热运动,从而影响溶解过程中的热效应。而溶质和水之间的相互作用则会影响溶质在溶剂中的扩散和溶解过程,从而影响溶解热。固体的分子量和固体溶质之间的相互作用对于溶解热的影响较小。因此,选项A和D是正确的。'
A:速率常数k变小 B:平衡常数K^⊖变大 C:正反应速率降低 D:逆反应速率降低
A:直线型 B:平面三角形 C:三角锥型 D:正四面体型
AI参考:正确答案是【B:平面三角形】。BF3和CO2分子中,中心原子B和C分别采取的是等性sp2杂化和sp杂化,所以BF3和CO2分子的构型是平面三角形。B和C都是中心原子,它们都只有三个杂化轨道参与杂化,分别形成三个杂化轨道,其中有两个杂化轨道形成两个相互垂直的δ键,因此它们的分子构型为平面三角形。A选项错误,因为BF3分子的构型不是直线型;C选项错误,因为CO2分子的构型不是三角锥型;D选项错误,因为BF3和CO2分子的构型都不是正四面体型。'
A:移去产物 B:使用催化剂 C:升高温度 D:降低温度
AI参考:正确选项是:A:移去产物降低反应的活化能的方法主要有使用催化剂、升高温度、降低温度和增大反应物浓度等。其中,移去产物不是一种有效的方法,因为产物被移除后,反应系统中的能量平衡会被打破,可能会使反应所需的活化能升高。其他选项如使用催化剂、升高温度和降低温度都可以降低反应的活化能,从而促进反应的进行。因此,正确选项为A:移去产物。'
A:sp^3d B:sp^3 C:sp D:sp^2
AI参考:正确选项为B:sp^3。对于甲烷(CH4),C原子采用sp3杂化,形成4个单键且键角为正四面体。对于乙烯(CH2=CH2),C原子采用sp2杂化,形成3个单键且含有1个双键。因此,本题中C原子采取的杂化形式分别是sp3和sp2,即选项B为正确选项。'
A:这原子核中有139个质子 B:这个原子核中有72个中子 C:它有139个电子 D:它有67个电子
AI参考:正确选项为【D:它有67个电子】。解释:原子符号为67(下标)139(上标)M,其中67表示原子序数(即质子数),因此该原子核中有67个质子。而电子数等于质子数减去中子数,因此该原子核中有67个质子时,中子数应为139-67=72。但是题目中并未给出中子数,因此无法确定选项B。另外,由于原子序数等于质子数,因此选项A错误。至于选项C,由于题目中并未给出电子数,因此无法确定。因此,正确选项为D,它有67个电子。'
A:不确定 B:大于零 C:小于零 D:等于零
AI参考:正确选项为C:小于零。熵变(ΔS)是衡量反应混乱度(或无序度)的变化值,数值越大代表越混乱,越无序。将NaCl晶体溶于水中得到NaCl溶液,这个过程是一个熵值增加的过程,即混乱度增加了。而吉布斯自由能变(ΔG)是表示系统进行某反应的趋势,当ΔG=0时,反应达到平衡状态。在溶解过程中,虽然氯化钠晶体要发生溶解,这个过程需要吸收能量,但吸收的这部分能量可以被用于氯化钠分子间的相互聚集和排斥,使其成为稳定状态,即能量发生了变化(通常是释放能量),这有利于自发进行的反应,所以总的趋势是ΔG小于零,表示自发进行。因此,这个过程的熵值和吉布斯自由能变都是小于零的。因此,本题的正确选项为C:小于零。'
A:当液体与其蒸气处于平衡时,蒸气的压力称为液体的饱和蒸气压 B:液体混合物的蒸气压等于各纯组分液体的蒸气压之和 C:蒸气压的大小与容器体积的大小有关 D:非电解质稀溶液中某一液体组分的蒸气分压等于它在相同温度下的饱和蒸气压与其在溶液中的摩尔分数之积
AI参考:正确选项是:A:当液体与其蒸气处于平衡时,蒸气的压力称为液体的饱和蒸气压B:液体混合物的蒸气压等于各纯组分液体的蒸气压之和D:非电解质稀溶液中某一液体组分的蒸气分压等于它在相同温度下的饱和蒸气压与其在溶液中的摩尔分数之积。解释:A. 液体与其蒸气处于平衡时,蒸气的压力称为液体的饱和蒸气压,这是蒸气压的基本概念。B. 液体混合物的蒸气压等于各纯组分液体的蒸气压之和,这是蒸气压的混合物概念,即液体混合物中各纯组分的蒸气压之和等于混合物的总蒸气压。C. 蒸气压的大小与容器体积的大小无关,只与液体的物性及温度有关。D. 非电解质稀溶液中某一液体组分的蒸气分压等于它在相同温度下的饱和蒸气压与其在溶液中的摩尔分数之积,这是蒸气分压的计算公式,用于计算溶液中某一组分的蒸气分压。'
A:催化剂 B:系统是否处于平衡状态 C:温度 D:反应物和生成物的浓度
A:n=3 l=3 m=2 ms=-1/2 B:n=2 l=1 m=0 ms=0 C:n=3 l=2 m=2 ms=-1/2 D:n=5 l=1 m=0 ms=+1/2
AI参考:正确选项为:B:n=2 l=1 m=0 ms=0解释:1. A选项中,n=3,l=3,m=2,ms=-1/2,这三个量子数组合是不合理的,因为n和l的取值不能同时为3。2. C选项中,n=3,l=2,m=2,ms=-1/2,同样因为l的取值为从0到n-1,所以l=2不合理。3. D选项中,n=5,l=1,m=0,ms=+1/2,看起来所有量子数都是合理的,但是当ms取值为+1/2时,只能出现在自旋方向为自旋向上或自旋向下的粒子上。对于n=5,l=1的粒子,其轨道角动量m应该为±5或±4,而m=0是不存在的。综上,只有B选项中的量子数组合都是合理的。因此,B是正确选项。'
A:只与产物浓度相关 B:与反应物浓度系数次幂成正比 C:为零 D:是个常数
AI参考:正确选项是【C:为零】。零级反应是指反应速率与反应物浓度之间没有明显关系的反应,也就是说,反应速率是一个常数,不随反应物浓度的变化而变化。因此,选项C是错误的,因为零级反应不是零级反应。选项A、B、D都是关于零级反应的一些特性,如只与产物浓度相关、与反应物浓度系数次幂成正比以及是常数等,这些特性都符合零级反应的反应机制。'
A:N2(g)+3H2(g)=2NH3(g) B:CaCO3(s)=CaO(s) +CO2(g) C:H2+1/2O2(g)=H2O(g) D:I2(s)=I2(g)
A:H2O B:CH3OH C:NH3 D:HF
AI参考:正确选项为:A:H2O 和 D:HF 。氢键通常存在于含有N、O、F等电负性较大的原子对之间,选项A和D中的水分子和氟化氢分子都含有氢键。而选项B中的甲醇分子中没有明显的电负性原子对,不含有氢键。选项C中的氨气分子虽然含有氢原子,但是氮原子的电负性较弱,形成的氢键作用不强。因此,正确选项为A和D。'
A:色散力仅存在于非极性分子之间 B:相对分子质量小的物质,其熔点、沸点也会高于相对分子质量大的物质 C:极性分子之间的作用力称为取向力 D:诱导力仅存在于极性分子与非极性分子之间
AI参考:正确答案是:B,相对分子质量小的物质,其熔点、沸点也会高于相对分子质量大的物质。A选项,色散力是极性分子之间产生的吸引力,仅存在于非极性分子之间,正确;B选项,物质的熔点、沸点与相对分子质量大小有关,但并不是绝对的正比关系,因此相对分子质量小的物质,其熔点、沸点不一定高于相对分子质量大的物质,错误;C选项,取向力是极性分子与极性分子之间产生的吸引力,因此极性分子之间的作用力称为取向力,正确;D选项,诱导力仅存在于极性分子与极性分子之间,因此诱导力仅存在于极性分子与非极性分子之间的说法错误。综上,本题答案为BCD。'
A:Na(s) + 1/2Cl2(g) = NaF(s) B:Na+(g) + F- (g) = NaF(s) C:Na(g) + Cl (g) = NaF(s) D:Na+(g) + Cl-(g)= Na Cl (s)
AI参考:正确选项是【C:Na(g) + Cl (g) = NaF(s) 】。晶格能是衡量离子化合物的稳定性的物理量,晶格能越大,离子键越稳定,晶体越稳定。选项C中反应物的总能量比生成物的总能量低,且该反应属于离子晶体之间的反应,所以能量变化表现为从外界吸收热量,从而增加晶格能。而其他选项中反应物的总能量和生成物的总能量没有明显差异,或者反应物和生成物不是离子晶体之间的反应,不符合题意。因此,选项C是正确的。'
A:N2^+的键能比N2分子的小 B:CO^+的键级是2.5 C:N2^-和O2^+ 是等电子体系 D:第二周期同核双原子分子中,只有Be2分子不能稳定存在
A:SiCl4 B:CO2 C:NCl3 D:CHCl3
AI参考:正确选项为【C:NCl3】。解释:C选项的NCl3是三角锥型分子,由于N原子的电负性较强,使得分子中存在极性,所以是极性分子。其他选项中,A选项的SiCl4是正四面体结构,分子中没有极性,是非极性分子;B选项的CO2是直线型分子,虽然C原子的电负性较强,但由于分子中存在C=O双键,因此具有极性;D选项的CHCl3是三角锥型分子,但C-H键和C-Cl键的极性相差不大,所以整个分子也是极性的。所以答案是C。'
A:BCl3 B:CO2 C:PCl3 D:NH3
A:5 B:1 C:4 D:2
A:有无穷大的能量 B:具有波粒二象性 C:没有确定的运动轨道 D:绕核高速旋转
AI参考:正确选项为【B:具有波粒二象性】和【C:没有确定的运动轨道】。核外电子的运动没有确定的轨道,但是可以产生波动效应,因此具有波粒二象性。同时,核外电子的运动速度很快,无法预测其具体位置和运动轨迹,因此无法实现绕核高速旋转。因此,选项B和C是正确的。选项A和D都是错误的,因为核外电子的运动没有无穷大的能量和固定的运动轨迹。'
A:错 B:对
A:对 B:错
AI参考:答案是B:错。电子的波动性是指电子在空间中传播时,表现出类似波动的行为,而不是波浪式的前进。电子的波动性是由电子的量子性质决定的,与电子的运动方式无关。因此,这个判断题是错误的。'
A:错 B:对
AI参考:答案:A:错推理过程:题干中的描述没有分析I⁻作还原剂时的电极反应,因此描述错误。正确选项应为B:错。'
A:对 B:错
AI参考:B:错。酸性水溶液中含氢离子和氢氧根,只是氢氧根相对较少。因此,酸性水溶液中是含有氢氧根的。'
A:对 B:错
A:错 B:对
A:错 B:对
A:错 B:对
A:对 B:错
A:对 B:错
A:对 B:错
AI参考:答案是B:错。将正常红细胞放入氯化钠溶液中,如果发生了溶血现象,则该氯化钠溶液为高渗溶液。红细胞在高渗溶液中会吸水膨胀破裂,发生溶血现象。因此,本题判断错误。'
A:对 B:错
A:对 B:错
A:对 B:错
A:对 B:错
AI参考:判断题反应活化能越大,反应速率越小。 (对)。反应活化能越大,分子需要吸收更多的能量才能从非活化分子转变为活化分子,这需要更多的时间,因此反应速率会降低。所以这个题目的答案应该是B:错。'
A:错 B:对
AI参考:【答案】A。题中描述的是活化能与反应速率之间的关系,活化能越大,反应越困难,活化能越小,反应越容易进行,而反应速率与反应的难易程度有关,活化能越大,反应速率越慢。因此,描述是错误的。'
A:对 B:错
AI参考:B:错。催化剂只能加快反应速率,不会影响反应物的转化率。因此,本题判断错误。'
A:错 B:对
A:对 B:错
A:错 B:对
AI参考:答案:B:对。加催化剂能加快反应速率,但不能使平衡发生移动。因此该判断题是正确的。'
AI参考:这段文字主要描述了反应2H2 + 2NO = 2H2O + N2在不同条件下反应速率的变化。根据表格中的数据,我们可以看到随着反应物浓度(H2和NO)的增加,反应速率也在增加。其中,反应速率最快的是当H2和NO的初始浓度都为6.00×10-3mol·dm-3时的实验数据,此时反应速率为3.19×10-3mol·dm-3·s-1。因此,正确选项是【C】反应速率最快的是当H2和NO的初始浓度都为6.00×10-3mol·dm-3时的实验数据。'
AI参考:正确选项为:* 白色沉淀A: 氯化银* 无色溶液B: 氯化银氨水混合物* 白色沉淀C: 硫酸钡* 灰黑色沉淀D: 氢氧化银* 桔红色沉淀E: 碘化钾与硝酸银反应的产物(具体来说是碘化钾与D反应的产物)解析:* 含有IIB和IIIB两种离子的混合液, 向其中加入氯化钠溶液产生白色沉淀A,氯化银在氯化钠溶液中形成白色沉淀。* 过滤分离后, 向A中加入氨水部分溶解为无色溶液B,这是因为氯化银与氨水反应形成银氨溶液,无色溶液B是氯化银和银氨溶液的混合物。* 往其中加硝酸产生白色沉淀C,这是因为硫酸钡不溶于稀硝酸。* 部分沉淀A加氨水后转化为灰黑色沉淀D,这是因为氢氧化银与氨水反应形成氢氧化二氨合银,为灰黑色。* 将D溶于硝酸形成无色溶液,这说明D是氢氧化二氨合银。* 往此溶液中加入KI产生桔红色沉淀E,这是因为碘化钾与硝酸银反应生成碘单质,碘单质与氢氧化二氨合银反应生成碘化银(桔红色)和氢氧化钾。'

