第二章单元测试
- 反应
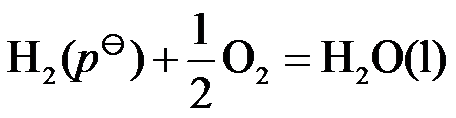 可通过爆鸣反应完成,也可通过氢氧可逆电池完成,两者的焓变分别为
可通过爆鸣反应完成,也可通过氢氧可逆电池完成,两者的焓变分别为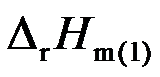 和
和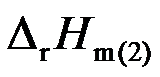 ,若反应物和生成物的T、p均相同,则两者关系为 ( )
,若反应物和生成物的T、p均相同,则两者关系为 ( ) - 298 K时电池反应 H2 (g) +
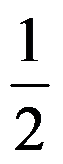 O2 (g) === H2O (l)的标准电动势为
O2 (g) === H2O (l)的标准电动势为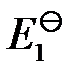 ,2 H2O (l) === 2 H2 (g) + O2 (g)所对应的电池反应的标准势为
,2 H2O (l) === 2 H2 (g) + O2 (g)所对应的电池反应的标准势为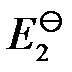 ,则
,则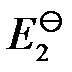 与
与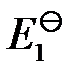 关系为 ( )
关系为 ( ) - 反应Pb + Hg2Cl2 = PbCl2 + 2Hg,在101.3 kPa、298.2 K时,在可逆电池中作电功103.4 kJ,吸热8.4 kJ,则该反应的ΔrH为 ( )
- 当可逆电池电动势
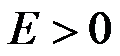 ,电动势的温度系数
,电动势的温度系数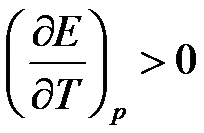 时,则可逆电池反应的热力学函数变化
时,则可逆电池反应的热力学函数变化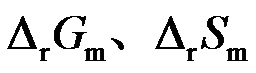 为 ( )
为 ( ) - 氢氧燃料电池的反应为
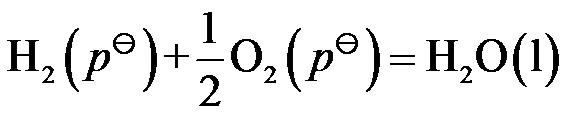 ,在298 K时,
,在298 K时,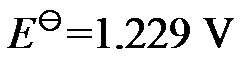 ,则电池反应的平衡常数
,则电池反应的平衡常数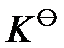 为 ( )
为 ( ) - 已知298 K时,下列电极反应的标准电极电势:
(1)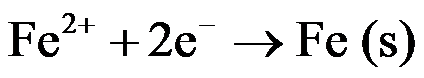 ,
,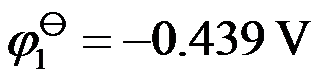 ;(2)
;(2) 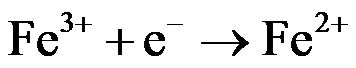 ,
,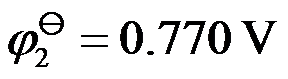 。(3)
。(3)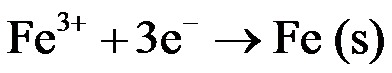 所对应的标准电极电势
所对应的标准电极电势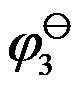 为 ( )
为 ( ) - 在298 K时,若要使电池
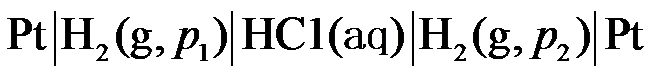 的电动势E为正值,则p1与p2值的大小的关系为 ( )
的电动势E为正值,则p1与p2值的大小的关系为 ( ) - 不能用于测定溶液pH的电极是 ( )
- 298.2 K时,某电池电动势
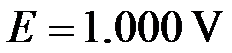 ,
,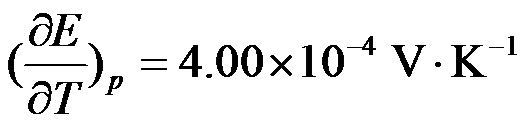 ,此电池可逆地提供1F电量的热效应是 ( )
,此电池可逆地提供1F电量的热效应是 ( ) - 电池反应的电动势E与指定电池反应计量方程式的写法无关,而电池反应的热力学函数
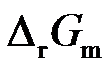 等则与指定电池反应计量方程式的写法有关。( )
等则与指定电池反应计量方程式的写法有关。( ) - 标准电极电势的数据就是电极与溶液界面电位差。( )
- 一个化学反应进行时,
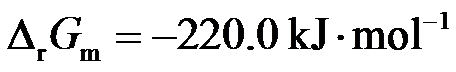 ,如将该化学反应安排在电池中进行,则需要环境对系统做功。 ( )
,如将该化学反应安排在电池中进行,则需要环境对系统做功。 ( ) - 对于电池
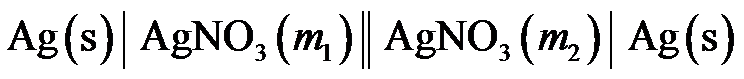 ,m较小的一端为负极。 ( )
,m较小的一端为负极。 ( )
A:无法确定
B:
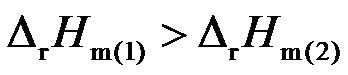
C:
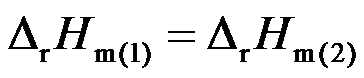 D:
D: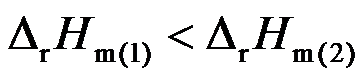
答案:
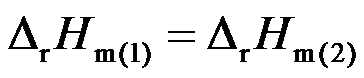
A:
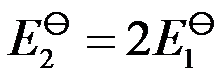
B:
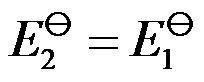
C:
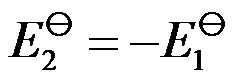
D:
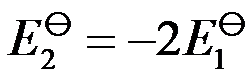
答案:
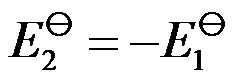
A:8.3 kJ B:−8.3 kJ
C:103.4 kJ
D:−95.0 kJ
答案:−95.0 kJ
A:
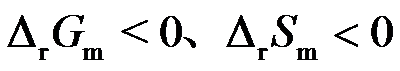
B:
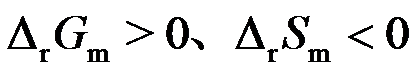
C:
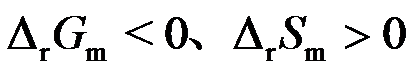 D:
D: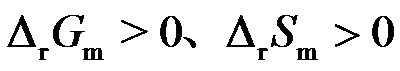
答案:
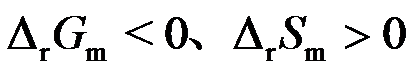
A:
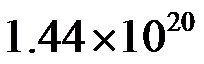 B:0
B:0C:1.0 D:
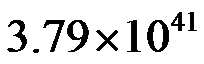
答案:
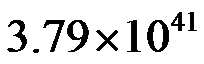
A:0.331 V B:0.036 V C:0.036 V D:0.331 V
答案:0.036 V
A:p1<p2 B:p1>p2 C:p1=p2 D:p1和p2都可任意取
答案:p1>p2
A:Ag (s), AgCl (s) | Cl– (m) 电极
B:氢醌电极 C:氢电极 D:玻璃电极
答案:Ag (s), AgCl (s) | Cl– (m) 电极
A:96500 J B:96500 J C:11510 J
D:84997 J
答案:11510 J
A:对 B:错
答案:对
A:对 B:错
答案:错
A:错 B:对
答案:错
A:错 B:对
答案:对
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!



