- 波函数是指电子在核外某区周围微单位体积中电子出现的概率。
- 甲基红指示剂变色范围为4.4~6.2,故在pH=5.2的溶液应呈现红与黄的混合颜色
- BF3分子中,B原子的s轨道与F原子的p轨道进行等性sp2杂化,分子的空间构型为平面三角形。
- 任一反应的反应级数,只能由实验来确定。
- 强酸滴定强碱的pH突跃范围与所选用的指示剂的变色范围有关
- 当主量子数n=3时,有3s、3p、和3d三种原子轨道。
- [V(NH3)6]3+中的V3+和[Co(NH3)6]3+中的Co3+均采用d2sp3杂化与NH3分子中的N成键,并且都为内轨配离子,所以两种配离子的稳定性相同
- 两个原子的p电子只能沿p轨道对称轴平行方式重叠成键。
- 四个等性sp3杂化轨道在空间的分布呈正四面体形。
- 根据你所学的配合物知识,如果某配合物的配位数4,可以认为:
- 在NH3 的水解平衡 NH3+H2O NH4+ +OH- 中,为了使[OH-]增大,可行的办法是:
- 下列说法错误的是 :
- 室温下0.10 mol·L-1 HB 溶液的pH值为3, 则0.10 mol·L-1 NaB溶液的pH值为(按pH最简公式计算) :
- 对KS 的错误描述是
- 已知标准电极电位φθ(Sn2+/Sn)= -0.137 5V,φθ(Fe3+/Fe2+)=0.771V,φθ(Hg2+/Hg22+) =0.920 V,φθ(Br2/Br-)= 1.066V,从理论上判断下列反应自发进行的是那些?
- 对于反应A + 2B®产物,实验证明,如两反应物浓度都加倍,则反应速率增至8倍,如仅将A的浓度加倍,则反应速率也加倍。则该反应对B而言的级数为
- 减小测量中系统误差的方法有
- 在pH = 9.00的缓冲溶液中,CO2将以下列哪种形态为主(H2CO3的pKa1=6.37, pKa2=10.25):
- 对于下列基元反应:A + 2B = C,其速率常数为k,若某个时刻(时间以s计),A的浓度为2mol/L,B的浓度为3mol/L,则反应速率v:
- 已知HCOOH在25℃时的酸解离平衡常数Ka,则其共轭碱COOH-的Kb为:
- 电子排布为[Ar]3d64s0,可以表示:
- 某一弱酸型指示剂HIn的pKHIn=4.1,那么它的理论变色范围是
- 以下叙述正确的是:
- 已知〔25Mn(SCN)6〕4-的μ=6.1μB,该配离子属于
- 用Na2CO3标定HCl溶液时,若Na2CO3未干燥,则得到的结果
- 在[Co(en)(C2O4)2]-中,Co3+的配位数是
- 第ⅥB的所有原子价电子排布式都为3d44s2。
- 浓差电池Ag|AgNO3(c1)||AgNO3(c2)|Ag,c1< c2>
- 凡是多元弱酸溶液中,其酸根的浓度总是近似等于其最后一级的离解常数。
- 欲使准确度高,首先要求精密度高,反之精密度高说明其准确度也高
- 已知在配离子[Cr(H2O)6]2+中,中心离子d轨道上有4个成单电子,则[Cr(H2O)6]2+是高自旋配合物
- 螯合物的稳定性大于一般配合物
- NaOH滴定HCL,酚酞作指示剂优于甲基橙,而HCL滴定NaOH,则相反。
- 生物体液中的晶体渗透压力维持毛细血管内外水的相对平衡。
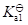
- 能量相同或相近的2个ns轨道有效组合,只能得到1个σ成键分子轨道及1个σ反键分子轨道。
- 分子轨道理论中,原子轨道线性组合成分子轨道应遵循的原则是:
- 下列各对溶液中,等体积混合后为缓冲溶液的是:
- 下列电池的电动势与Cl-离子浓度无关的是:
- 下列说法中,错误的是
- 下列电池反应中,有关离子的浓度均减少一半时,电极电位值将减小的是
- 已知Cd的原子序数为48,CN-为强场配体,故[Cd(CN)4]2-为低自旋配离子。
- 0.2 mol·L-1的NaCl溶液的渗透压力等于0.2 mol·L-1的葡萄糖溶液的渗透压力。
- 一般情况下,不论反应是放热还是吸热,温度升高,反应速率都增大。
- 将氨水的浓度稀释一倍,那么OH-的浓度将变成原来的一半。
- 酸碱滴定曲线的突跃范围与酸碱溶液浓度有关。浓度越小,突跃范围越大,浓度越大,突跃范围越小。
- 当强酸滴定弱碱或强碱滴定弱酸时,滴定突越范围的大小和什么有关
- 下列属于系统误差的是
- 下列原电池的符号中,书写错误的是
- 已知某元素+3价离子的价电子组态为3d5,该元素在周期表中周期和族是:
- 下列分子中没有π键的是:
- 下列分子中中心原子的杂化类型与其它分子不同的是:
- 有下列水溶液:①0.100 mol·kg-1的葡萄糖(C6H12O6) ②0.100 mol·kg-1的NaCl ③0.100 mol·kg-1 Na2SO4。同温度下,蒸气压由大到小的顺序:
- 0.1 mol⋅L-1 NaAc溶液(Ka,HAc =1.0×10-5)的pH为:
- 减小电池(-) Cu|Cu2+‖Ag+|Ag (+)电动势的方法是
- 下列关于杂化轨道理论阐述不正确的是:
- 对可逆反应,加入催化剂的目的是
- 下列溶液中,能与0.2 mol⋅L-1 NaHCO3,溶液以等体积混合,配成缓冲溶液的是:
- 要使0.1 mol·L-1HAc溶液的pH值变小,解离度a也变小,应加入少量( ):
- 价键理论可以解释配合物的()
- 对于反应 Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,其ΔrGm=–nFE,式中n等于()
- 元素原子的核外电子排布如下,其中元素电负性最大的是:
- 对于多电子原子来说,下列说法正确的是:
- 正常人体血液的pH值基本维持在( )之间。
- 将银丝插入1L的下列溶液中组成电极,则电极电位最低的是
- 下列有关缓冲溶液的叙述中,错误的是:
- 欲使Mg(OH)2 的溶解度降低,最好加入下列哪种物质
- 配合物的磁矩主要取决于形成体的()
- 关于蒸气压,下列说法正确的是:
- 已知〔PtCl4〕2-中Pt2+以dsp2杂化轨道与Cl-成键,〔PtCl4〕2-的空间构为
- 质量作用定律只适用于:
- 有两种不同酸的溶液,其pH值相等,则下列说法错误的是:
- 难挥发性非电解质稀溶液依数性产生的本质原因是:
- 滴定突跃范围一定在偏碱性区的是
- 下列几组原子轨道沿x轴靠近时,由于对称性不匹配,不能有效地形成分子轨道的是:
- 根据有效数字运算规则,1.0712×98.351÷0.312÷24.06+1.5的计算结果应该保留几位有效数字
- 弱酸或弱碱都能用强碱或强酸溶液直接滴定。
- 下列几种酸的浓度均为0.2000 mol×L-1,若用0.2000 mol×L-1 NaOH溶液进行滴定,不能直接滴定的酸是
- 在滴定过程中,指示剂发生颜色改变的转变点称为
- 测量结果准确度高,则精密度一定也高
- 当溶液中H3O+浓度与OH-浓度相等时,酸碱指示剂显示其中间色。
- 强碱滴定三元酸,只要Ka1/Ka2 ≥ 104, Ka2/Ka3 ≥ 104,就一定有三个突越。
- 金属原子不能作为配合物的形成体
- 具有d5电子构型的过渡金属离子形成八面体配合物时,在弱场和强场配体作用下,晶体场稳定化能应.()
- 下列配合物中,属于内轨型配合物的是()
- 一般地说,内轨型配合物较外轨型配合物稳定
- 价键理论认为,决定配合物空间构型主要是()
- H2N-NH2 能做螯合剂
- [Co(NH3)6]3+是内轨型配合物,则中心离子未成对电子数和杂化轨道类型是.()
- 下列分子与CO2分子的结构最相似的是:
- sp3杂化轨道是由1s轨道和3p轨道混合起来形成的一个sp3杂化轨道。
- 色散力普遍存在于分子之间,而取向力只存在于极性分子之间。
- CH4分子中,C原子采取sp3等性杂化,在CH3Cl分子中,C原子采取sp3不等性杂化。
- CCl4的沸点、熔点很低,所以分子很不稳定。
- NH3和H2O分子之间,存在的分子间作用力有:①取向力 ②诱导力 ③色散力 ④氢键
- 在下列分子中,中心原子采取不等性sp3杂化的是:
- 下列分子或离子的分子轨道式中,无单电子的是:
- 依据能级由低到高顺序、遵守Pauli不相容原理排布电子就写出基态原子的电子组态。
- 基态 24Cr 的电子组态是:
- M电子层原子轨道的主量子数都等于3。
- 有下列外层电子组态的原子中,电负性最大的是:
- 表示原子轨道离核远近的量子数是n。
- 最外层电子组态为ns1或ns2的元素,都在s区。
- 某一电子有下列成套量子数(n、l、m、s ),合理的一组是:
- 在任何原子中,3d的能量均高于4s的能量。
- 某金属M的价层电子组态为3d104s2,其在周期表中位置为:
- 知原电池中两电极的标准电极电位值,就能判断该电池自发进行的方向。
- 25℃时,将铂丝插入含有Sn4+ 和Sn2+ 离子浓度分别为0.1和0.01mol·L-1 的溶液中,电对的电极电位为()
- 两电对组成原电池,标准电极电位大的电对中的氧化型物质在电池反应中一定是氧化剂。
- 往银电极中加入一定量的氯化钠,电极电位降低。
- 某氧化还原反应的标准电动势Eθ>0,则应有
- 电池标准电动势越大,氧化还原能力越大,反应速率越快。
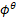
- 标准电极电位和标准平衡常数一样,都与反应方程式的化学计量系数有关。
- 在标准条件下,下列反应均向正方向进行:Cr2O72- +6Fe2+ +14H+ = 2Cr3+ +6Fe3+ +7H2O2Fe3+ +Sn2+ = 2Fe2+ +Sn4+他们中间最强的氧化剂和最强的还原剂是 ()
- 已知A + 2B ® C,则其速率方程式为
- 化学反应速率常数k的大小,只与温度有关,而与反应物的浓度和加入的催化剂无关。
- 已知反应2A+B¾®产物的速率方程式为v=kCA2•CB,故此反应为元反应。
- 对于反应Cl2(g) + 2NO(g) ® 2NOCl(g),实验发现,如两反应物浓度都加倍,则反应速率增至8 倍。该反应的级数是
- 某反应A¾®B,当A浓度增加1倍时,反应速率也增加1倍,则该反应必为一级反应。
- 反应A®B为二级反应,当A的浓度为0.050 mol×L-1时,反应速率为1.2 mol×L-1×min-1。在相同温度下,欲使反应速率加倍,A的浓度应该是
- 某反应2A +B ®C,实验测得其速率方程为n=kcA×cB,由此可见该反应为
- 某 反 应 的 活 化 能 为 90 kJ×mol-1, 则 可 求 出 当 反 应 温 度 自 10℃ 升 高 至20℃ 时, 其 反 应 速 率 (大 约) 将 变 为 10℃ 时( )
- 在Ca3(PO4)2的饱和溶液中,已知c(Ca2+) = 2.0×10-6 mo/L,c(PO43-) = 1.58×10-6mo/L,则Ca3(PO4)2的K为
- 某温度下CuI的Ksp=1.27×10-11, Pb(OH)2的Ksp=1.26×10-15,PbS的Ksp=9.04×10-29,Ag2CrO4的Ksp=1.12×10-12,它们的溶解度的顺序为
- 能使难溶强电解质溶解的方法
- 将1.0 mol·L-1CaCl2 溶液通入CO2 气体至饱和,则溶液中有无CaCO3 沉淀?[已知CaCO3 的Ksp= 3.36×10-9,H2CO3 的Ka1= 4.47×10-7,Ka2= 4.68×10-11
- 在一定温度下,往AgCl溶液中加入NaCl,溶液中[Ag+] 和[Cl-]的乘积为一常数
- 在混合离子溶液中加入沉淀剂,Ksp小的难溶电解质首先生成沉淀。
- 酸性溶液中,Fe3+和Zn2+的浓度均为0.010 mol/L,增大溶液pH,哪种离子先沉淀。(KspFe(OH)3=2.79 × 10-39,KspZn(OH)2=6.86 × 10-17。)
- 已知Ksp(AgCl)=1.77×10-10,AgCl在0.01mol·L-1NaCl溶液中的溶解度为1.77×10-8 mol·L-1。
- CuS不溶于盐酸和硫酸,但是能溶于硝酸,是因为硝酸的酸性强。
- 人体血浆中最重要的抗酸成分是:
- 缓冲溶液被稀释后,溶液的pH基本不变,故缓冲容量基本不变。
- 缓冲溶液的缓冲容量大小只与缓冲比有关。
- 影响缓冲容量的主要因素是:
- 缓冲溶液就是能抵抗外来酸碱影响,保持pH绝对不变的溶液。
- 混合溶液一定是缓冲溶液。
- 用H3PO4(pKa1=2.12,pKa2=7.21,pKa3=12.67)和NaOH所配成的pH=7.0的缓冲溶液中,抗酸成分是:
- 缓冲溶液中,其他条件相同时,缓冲对的pKa越接近缓冲溶液的pH时,该缓冲溶液的缓冲容量就一定越大。
- 下列公式中有错误的是:
- 下列叙述错误的是:
- 已知0.01 mol/L 的弱酸HA溶液有1%的电离,它的电离常数约为:
- 根据酸碱质子理论,不属于两性物质的是:
- 相同浓度的下列溶液,pH值最小的是:
- HSO4-的共轭酸和共轭碱分别是:
- 在HAc溶液中加入HCl后,由于同离子效应,会使得H+离子浓度降低。
- 不是共轭酸碱对的一组物质是:
- 难挥发的电解质和非电解质稀溶液中均存在沸点升高、凝固点降低、渗透压等现象。
- 渗透现象是指纯溶剂的净迁移,其渗透方向是纯溶剂通过半透膜从低浓度往高浓度迁移。
- 在电解质溶液中,正离子的渗透浓度等于负离子的渗透浓度,也等于该电解质的渗透浓度。
- 在相同温度下,0.01 mol/L下列各水溶液的渗透压最大的是:
- 下列各对稀水溶液中,中间用半透膜隔开,有较多水分子自右向左渗透的是:
- 正常沸点是指液体的蒸气压等于外压时的温度。
- 某难挥发非电解质苯溶液(Kb = 3.5 K·kg·mol-1, Kf = 5.6 K·kg·mol-1) 的沸点升高值为0.35℃,它的凝固点降低值为:
- 在凝固点时,同一物质的液相蒸汽压p1与固相蒸汽压p2的关系是:
- 1928年,英国细菌学家弗莱明发现了第一种抗生素( ),后由钱恩和弗洛里解决了其富集和浓缩的问题,为解决细菌感染问题做出了巨大贡献。
- 基础化学与医学关系不大,不需认真学习
- 化学是一门在原子、分子水平上研究物质的组成、结构、性能、应用以及物质相互之间转化规律的科学
- 目前,化学已经与哪些学科交叉、渗透。
- 美国医学教授,诺贝尔奖金获得者肯伯格指出,要“把生命理解为化学”
- 在化学中,溶液浓度的表示方法有多种,如物质的量浓度,质量摩尔浓度,质量浓度,物质的量分数等
- 化学平衡主要包括()
- 顺铂是典型的DNA催损剂,能杀死癌细胞,是著名的抗癌药物。
- 中国科学研究屠呦呦因开创性地从中草药中分离出应用于疟疾治疗获得2015年的诺贝尔生理学或医学奖。
- 化学家证明了作为生物遗传因子的基因是核糖核酸(RNA)
答案:错
答案:对
答案:错
答案:对
答案:错
答案:对
答案:错
答案:错
答案:对
答案:它一定有4个配体 B.它一定有4个配位键###它的空间结构不是四面体就是四方形
答案:加NaCl
温馨提示支付 ¥5.00 元后可查看付费内容,请先翻页预览!







