- 下列说法中,正确的是( )
- 原子中某电子的各种波函数,代表了该电子可能存在的各种运动状态,每一种状态可视为一个轨道。( )
- 若一种弱酸不能被强碱滴定,则其共轭碱必定可被强酸滴定。( )
- 配离子的生成和离解是逐级进行的。( )
- 可以利用分步沉淀的原理分离溶液中的离子,难溶电解质的溶度积常数相差越大,分离就越完全。( )
- 绝热过程只有在孤立体系才能发生。( )
- 氧化数跟化合价没有区别,只是说法不同。( )
- 对同类型离子化合物,离子的电荷越高,正负离子的核间距越长,则晶格能越大,离子化合物越稳定。( )
- 系统误差是由固定的原因造成的,所以系统误差可以消除。( )
- 根据价键理论,形成外轨型配合物时,中心原子用的都是外出轨道,形成内轨型配合物时,中心原子用的都是内层轨道。( )
- 没有密封好的冰醋酸放置一段时间后,凝固点会降低。( )
- EDTA配位滴定中,反应终点的颜色是指示剂本身的颜色。( )
- 热和功与途径紧密联系,即使始终态相同,途径不同,能量变化也不同。( )
- 难挥发非电解质溶液的依数性与溶液的浓度成正比而与溶质种类无关。( )
- 测定血红素等大分子摩尔质量的方法是 ( )。
- 以0.1000 mol/L NaOH滴定20 mL 0.1000 mol/L HAc时,能用作指示剂的是( )。
- 下列情况属于随机误差的是( )。
- 不能提高配位滴定选择性的方法是( )。
- 可减小偶然误差的方法是( )。
- 关于偶然误差说法不正确的是( )。
- 已知某元素的+2 价离子的电子排布式为1s2 2s2 2p6 3s2 3p6 3d5 , 该元素在周期表中属于( )。
- 下列分子或离子中,不含有孤对电子的是( )。
- 可以减少分析测试中随机误差的措施是( )。
- 下列关系中错误的是( )。
- 下列原子轨道的n相同,且各有一个自旋方向相反的不成对电子,沿键方向可形成π键的是( )。
- 在配离子[Ru(NH3)4Br2]+中,Ru的氧化数和配位数分别是( )。
- 现代价键理论认为,共价键的本质仍然是( )。
- 在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,则Mg(OH)2沉淀量( )。
- 某酸碱指示剂的pKa(HIn) = 5, 其理论变色范围的pH为( )。
- 在定量分析中,精密度与准确度之间的关系是( )。
- 配合物都包含有内界和外界两部分。( )
- 能组成原电池的反应都是氧化还原反应。( )
- 通常所谓的原子半径, 并不是指单独存在的自由原子本身的半径。( )
- 低自旋配合物的磁矩一般而言要比高自旋配合物的磁性相对要弱一些。( )
- 非金属离子PO43-不能与EDTA形成配位化合物,不能用EDTA来测定PO43-的量( )
- 纯溶剂通过半透膜向溶液渗透的压力叫渗透压。( )
- 两原子间可以形成多重键, 但两个以上的原子间不可能形成多重键。( )
- 氢原子中,2s与2p轨道是简并轨道,其简并度为4;在钪原子中, 2s与2p 轨道不是简并轨道,2px,2py,2pz 为简并轨道, 简并度为3。( )
- 原电池的E 越大,则电池反应的自发程度越强。( )
- 某气体经过一个循环过程,但ΔT和ΔP不一定为0。( )
- 当电对的离子浓度变化时,电极电势会发生变化,也会导致反应的平衡常数发生变化。( )
- 随着科学技术的发展,我们已经能够同时准确地测定电子在空间的位置和速度。( )
- 在消除系统误差的前提下,平行测定的次数越多,测定的平均值越接近真实值。( )
- 对同一中心原子所形成的配合,低自旋配合物的磁矩较小,高自旋配合物的磁矩较大。( )
- EDTA滴定中消除共存离子干扰的通用方法是控制溶液的酸度( )
- 在氧化还原反应中,如果两电对的E值相差越大,则反应进行得越快。( )
- EDTA的酸效应系数与溶液的酸度有关,与发生反应的金属离子无关。( )
- 热化学方程式表示了一个化学反应各物质所处的状态和热效应,以及是否做了体积功等。( )
- 在相同质量的两份水中,分别加入相同质量的甘油和蔗糖后,这两份溶液的沸点相同。( )。
- 主量子数为3 时,有3s,3p, 3d ,3f 四条轨道。( )
- 纯单质的ΔfHm ,ΔfGm ,Sm 皆为零。( )
- 根据的数值,如下结论正确的是( )。
- Na2C2O4中C的氧化数等于 ( )。
- 下列运动着的物质不具有波粒二象性的是( )。
- 欲使某气相反应正向进行,下列说法正确的是 ( )。
- 关于滴定分析说法不正确的是( )。
- 已知下列反应的标准平衡常数。H2 (g) + S (s) H2S (g) K1S (s) + O2 (g) SO2 (g) K2则反应H2 (g)+ SO2 (g) O2 (g)+H2S (g) 的标准平衡常数是 ( )
- 由铬在酸性溶液中的元素电势图, 可确定能自发进行的反应 ( )。Cr3+-0.41VCr2+-0.91VCr
- 已知反应3O2(g)→2O3(g) 的ΔrHm = 285.4 kJ·mol-1,有助于提高该反应平衡转化率的措施是( )。
- 已知ka(H2O2) = 2.410-12,kb(NH3) = 1.810-5,ka(HCN) = 4.9310-10,ka(H3BO3) = 7.310-10,则下列物质中酸性最强的是( )。
- 根据价层电子对互斥理论,硫酸根价层电子对数和空间结构分别是( )。
- 欲配制pH=9的缓冲溶液,应选用下列何种弱酸或弱碱和它们的盐来配制( )。
- 热力学有关体系和环境之间的关系说法正确的是( )。
- 根据酸碱质子理论, 下列各离子中, 既可作酸, 又可作碱的是 ( )。
- 在AgCl白色沉淀中加入KI 溶液,沉淀的颜色发生了变化,其原因是( )。
- 1.325+0.41、3.25×0.11两式计算结果正确的是( )。
- 下列哪一措施能使反应达平衡时的产物增加( )。
- 下列物质属于基准物质的是( )。
- 下列物质室温下蒸气压最高的是( )。
- 关于配合物,下列说法错误的是( )。
- EDTA滴定中消除共存离子最有效的方法是分离干扰离子( )
- 滴定反应对化学反应的要求不包括 ( )。
- 酸碱滴定中,选择指示剂可不必考虑的因素是( )。
- Ca2+,Mg2+离子共存时,可以通过控制溶液pH值对Ca2+,Mg2+离子进行分别滴定 ( )。
- 用已知浓度的NaOH滴定相同浓度的不同弱酸时,弱酸的pKa 越大,则( )。
- 用EDTA直接滴定有色金属离子,终点所呈现的颜色是( )。
- 金属指示剂与金属离子生成的配合物越稳定,滴定准确度越高( )。
- 用0.1000 mol/L的NaOH标准溶液滴定0.1000 mol/L的HAc溶液,其突跃范围pH = 7.76~9.70, 应选用哪一指示剂?( )。
- 若采用含有少量中性杂质的H2C2O42H2O作为基准标定NaOH溶液的浓度,会使得标定结果偏低( )。
- 比较下列滴定,哪类类型滴定突跃最大( )
- 有一碱液, 可能含有NaOH, Na2CO3 , NaHCO3 , 今以盐酸滴定之, 先以酚酞为指示剂, 消耗盐酸的体积为V1 , 再以甲基橙为指示剂, 消耗盐酸体积为V2 , 且有V1 > V2 , 问该碱液的组成为( )。
- 标定HCl时最好选择的基准物质是( )。
- 做对照实验和空白实验,校正仪器和方法都可以减免和消除系统误差。( )
- 仪器能测量得到的数字就是有效数字。( )
- 如果要求分析结果的相对误差小于0.1%,若称量的绝对误差为±0.2mg,则称取样品的质量至少应为 ( )。
- 下列不属于系统误差的是 ( )。
- 实验中三次平行测定的结果越接近,说明测定的准确度越高。( )
- 分析天平称量的样品质量为0.3556g,假定其真值为0.3559g,测定的相对误差为 ( )。
- pH = 2 .300 的有效数字位数是( )。。
- 配合物中, 中心离子一般为正价态和零价态金属离子, 而配体一般为含有电负性比较高的负离子或中性分子。( )
- 关于外轨型与内转型配合物的区别,下列说法不正确的是( )。
- 在[ Co( NH3)3(H2O)2Cl]2+中, (Co )的氧化数和配位数分别为( )。
- 配位原子与中心原子之间的化学键也有可能是多重键。( )。
- 某配合物组成为Co(NH3)5BrSO4 , 加入BaCl2 时产生沉淀 , 加入AgNO3时不产生沉淀,则 该化合物的化学式为 ( )。
- 配位键没有方向性和饱和性。( )
- [Cr(Py)2(H2O)Cl3]中Py代表吡啶, 这个化合物的名称是( )。
- 下列配合物中属于内轨型的是( )。
- 配合物中心离子的配位数等于( )。
- 乙醇和醋酸易溶于水, 而碘和二硫化碳难溶于水的原因是 ( )。
- O2+的键级是2.5,O2的键级是2.0,所以O2+比O2更稳定。( )
- 关于晶格能, 下列说法中正确的是( )。
- 当2个原子形成共价键时, 可以是σ加π键, 也可以都是σ键。( )。
- 乙炔分子(C2H2)中, 碳原子采取的是( )。
- CO2 分子空间构型为直线型,是非极性分子,其化学键也是非极性的。( )
- 按VSEPR理论, BrF3分子的空间几何构型为( )。
- 冰融化所克服作用力有 ( )
- H2S分子与CH4分子间存在的分子间力有( )。
- 在一个多电子原子中,具有下列各套量子数的电子,能量大的电子具有的量子数(n, l, m, mS) 是 ( )。
- 所有微观粒子都既有粒子性又有波动性。( )。
- 多电子原子的原子轨道能级顺序随着原子序数的增加( )。
- p轨道的简并度为 ( )。
- 原子失去电子变成简单阳离子时,失电子顺序与电子填充顺序正好相反。( )。
- 下列电子构型中,电离能最低的是( )。
- 波函数和原子轨道二者之间的关系是 ( )。
- 下列原子参数与元素周期性变化的说法不正确的是 ( )。
- 对于同一原子, 失去同层电子时电离能差值较小,而失去不同层电子时电离能差值较大。所以电离能数据也是原子核外电子分层排布的实验佐证。( )。
- 同一原子中, 可能存在下列量子数的两个电子是( )。
- 关于标准电极电势说法正确的是( )。
- 与下列原电池电动势无关的因素有 (-)Zn | ZnSO4(aq)║HCl(aq)|H2(101 325 Pa), Pt(+) ( )。
- 原电池中负极发生( )。
- 氧化还原反应中氧化数升高的称为 ,氧化数降低的称为 。 ( )
- 已知:E(Sn4+/Sn2+) = + 0.15 V,E(Fe3+/Fe2+) = + 0.77 V,则不能共存于同一溶液中的一对离子是 ( )。
- 在一个能实际产生电流的原电池中, 作为正极的电极反应的电势总是高于作为负极的电极反应的电势值。( )
- 标准电极电势的数值越小, 其氧化型的氧化性越弱, 其还原型的还原性越强。( )
- Na2S4O6中S的氧化数是( )。
- 原电池中关于盐桥的说法不正确的是 ( )。
- 溶液中若不存在同离子效应, 也就不会构成缓冲溶液。( )
- 欲配置pH=5的缓冲溶液,应选用的缓冲对为( )。
- 酸碱反应到达终点后溶液的pH呈中性。( )
- 在298 K 100 mL 0.10 mol/L HAc溶液中, 加入1克NaAc后, 溶液的pH 值( )。
- 依软硬酸碱概念,下列物质属于软酸的是 ( )。
- 按酸碱质子理论考虑,在水溶液中既可作酸亦可作碱的物质是( )。
- Ag2CrO4在0.0010 mol·dm-3 AgNO3溶液中的溶解度较在0.0010 mol·dm-3 K2CrO4中的溶解度 ( )。
- 稀释可以使醋酸的电离度增大, 因而可使其酸度增强。( )
- 在0.10 L 0.10 mol•L-1 HAc溶液中,加入0.10 mol NaCl晶体,溶液的pH值将会 ( )。
- 已知体积为V1, 浓度为0.2 mol/L弱酸溶液, 若使其解离度增加一倍, 则溶液的体积V2应为 ( )。
- 若有一可逆反应2A(g) + 2B(g) ←→ C(g) + 2D(g) △H< 0>
- 正反应和逆反应的平衡常数之间的关系是( )。
- 某一温度时, 当反应2SO2(g) + O2(g) ←→ 2SO3(g) 达平衡时,是指( )。
- 化学平衡常数是化学反应本质决定的, 因此与反应的条件无关。( )
- 下列关于反应商Q的叙述中错误的是( )。
- 某温度下, A + B2C反应达到平衡,若增大或减少B的量,C和A的平衡浓度都不变, 则B是 ( )。
- 溶度积小的, 不能认为溶解度也一定小, 故溶度积不能反映难溶化合物的溶解能力。( )
- 温度一定时,减小生成物浓度,该反应 ( )。
- 反应2A(g) + B(g) ←→ 2C(g), △H < 0 K=[C]2/([A]2[B]),>
- 在生产中, 化学平衡原理应用于( )。
- 根据熵变的概念,判断下列哪反应在室温条件下,正向反应熵变数值最大( )。
- 任何一个反应不论在什么条件下进行, 如果△rG大于零,则该反应一定不能正向进行。 ( )
- 如果某一体系从状态A变到状态B有两种途径: 一种是经C到B 状态; 另一种是经D到E, 最后到B状态。 体系内能的改变值为( )。
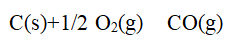
- 化学反应的热效应是指某化学反应从始态到终态的等温变化 过程中(只做体积功),体系与环境所交换的能量。( )
- CaO( s ) + H2O( l ) = Ca(OH) 2 (l) 在25℃ 及标准状态下反应自发进行, 高温时其逆反应自发, 这表明该反应为哪种类型 ( )。
- 反应的热效应就是反应的焓变。( )
- 下列有关热效应的正确说法是( )。
- 过程是始态到终态的一个变化,途径是实施过程的具体步骤。( )
- 如果体系经过一系列变化最后又回到初始状态, 则体系的( )。
- 难挥发非电解质稀溶液的依数性不仅与溶质种类有关,而且与溶液的浓度成正比 ( )
- 空气中O2和N2的体积分数分别是21%和79%,若将一定质量的空气压缩到压力为1500KPa,则空气中O2的分压最接近( )
- 将一定量的N2和一定量的He 放在一个密闭容器中混合均匀,在温度不变时,此混合气体的总压力为 ( )
- 气体处于那种状态下更接近理想气体?( )。
- 一定量气体在一定压力下,当温度由100℃上升至200℃时,则气体 ( )。
- 在一定温度和压力下,两种不同气体具有相同体积,则这两种气体( )。
- 测定人血清白蛋白(HSA)摩尔质量的最好方法是( )。
- 取两小块冰(0 ℃),分别放在0 ºC的纯水和盐水中,将会产生的现象是( )。
- 同温度下, 渗透压最大的水溶液是 ( )。
- 稀溶液具有共同的性质规律,如溶液的蒸汽压下降、沸点升高、凝固点下降和渗透压等,溶液越稀,其依数性的规律性越强。 ( )
答案:离子键和共价键相比,其作用范围更大
答案:对
答案:对
答案:对
答案:对
答案:错
答案:错
答案:对
答案:对
答案:错
答案:对
温馨提示支付 ¥5.00 元后可查看付费内容,请先翻页预览!

