提示:内容已经过期谨慎付费,点击上方查看最新答案
物理化学
- 对理想气体单纯的pVT变化,公式dU=nCvmdT,适用于( )过程。
- 对1 mol范德华气体单纯pVT变化,
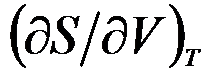 =:( )。
=:( )。 - 在101325Pa的压力下,I2在液态水与CCl4中的溶解已达到平衡(无固体I2存在),此体系的自由度为:( )。
- 对于一任意化学反应aA+bB=gG+hH当反应达平衡时,下列等式中何者是正确的( )。
- 外界压力增大,冰的熔点( )。
- 高温高压下实际气体适合的状态方程是( )。
- 若焦尔-汤姆生系数μ>0,则节流膨胀后气体温度( )。
- 电极Tl3+,Tl+/Pt 的电势ψƟ1=1.250V,电极Tl+/Tl的电势ψƟ2= -0.336V,则电极Tl3+/Tl的电势ψƟ3为( )。
- 某二级反应,反应物消耗1/3需时间10min,若再消耗1/3还需时间为( )。
- 某电池在298K、pƟ下可逆放电时,放出100 J的热量,则该电池反应的焓变值ΔrHm为( )。
- 已知下列反应的平衡常数:① H2(g)+S(s)=H2S(s) K1;② S(s)+O2(g)=SO2(g) K2。则反应H2(g)+SO2(g)=O2(g)+H2S(g)的平衡常数为:( )。
- 玻璃管两端有大小不等的两个肥皂泡,打开阀门,原先较小的肥皂泡将( )。
- 在温度T时,将纯固体A2B放入抽空容器中,则A2B发生分解2A2B(s)=2A2(g)+B2(g),当系统达平衡时,测得在压力为p,则平衡常数
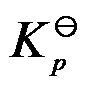 为( )。
为( )。 - 在一封闭恒温箱中有二杯液体,气相已饱和,a杯为纯水,b杯为蔗糖水溶液,静置足够长的时间,发现( )。
已知某溶液溶于水后,溶液表面张力
 与活度a的关系为:
与活度a的关系为: ,其中
,其中 为纯水表面张力,A、b为常数,则此溶液中溶质的表面过剩
为纯水表面张力,A、b为常数,则此溶液中溶质的表面过剩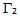 与活度a的关系为:( )。
与活度a的关系为:( )。 - 理想气体自相同的始态,经可逆绝热压缩或不可逆绝热压缩至相同的终态体积,U终(可逆)( )U终(不可逆)。
- 在298K的含下列离子的无限稀的溶液中,离子摩尔电导率最大的是( )。
- 内燃机车头牵引相同的一列车厢,在下列( )环境下,消耗燃料最多。
- 在恒T、p下,由A(l)和B(l)混合成理想液态混合物的过程中正确的为( )。
298K,当
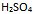 溶液的浓度从
溶液的浓度从 增加到
增加到 时,其电导率
时,其电导率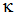 和摩尔电导率
和摩尔电导率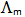 将( )。
将( )。- 反应A+2B→P速率方程可写为:-dcA/dt=kAcAcB或-dcB/dt=kBcAcB,则kA与kB的关系是( )。
- 有关超显微镜的下列说法中,不正确的是( )。
- 非理想气体混合物中B的化学势,μB=μƟB+RTlnfB中μƟB是指( )。
- 对有过量KI存在的AgI溶胶,下列电解质( )的聚沉能力最大。。
- 下述偏导数是化学势的为( )。
- 下列电池的电动势中与Cl-有活度无关的是( )。
- 电池反应 2H2(g)+O2(g)→2H2O(l) E1;H2(g)+1/2O2(g)→H2O(l) E2,则有( )。
某等容反应的热效应
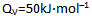 ,则反应的实验活化能Ea值为( )。
,则反应的实验活化能Ea值为( )。- 一定体积的水,处于两种状态:⑴形成一个大液滴;⑵分散成许多小液滴,则对两种状态,下列性质相同的有( )。
- 用等体积的0.05mol·m-3 AgNO3溶液和0.1mol·dm-3 KI溶液混合制备的AgI 溶胶,在电泳仪中胶粒向( )。
- 溶胶是( )。
- CO2(g)标准摩尔生成焓ΔfHƟm等于( )。
- a、b和c三种物质(不能相互发生化学反应)所形成的溶液与固相a及由b、c组成的气相同时呈平衡,则此系统中能平衡共存最大相数是( )。
当表面活性物质加入溶剂后,所产生的结果是( )。
- 某反应速率常数与各基元反应速率常数的关系为 k=k2(k1/2k4)1/2 则该反应的表观活化能Ea与各基元反应活化能的关系( )。
- 某反应经实验证明是一级反应,则它一定是单分子反应( )。
- 通常所说的液体表面张力是指液体与其饱和蒸汽之间或与被其蒸汽饱和了的空气之间的界面张力( )。
- 理想液态混合物每一组分均服从拉乌尔定律( )。
- 绝热恒容且W'=0的过程一定有ΔU=0,绝热恒压且W'=0的过程一定有ΔH=0( )。
- 溶液表层浓度与溶液本体浓度之差就是表面吸附量( )。
- 质量作用定律只适用于基元反应( )。
- 恒沸混合物液体中,任一组分的活度系数γi≠1( )。
- 理想液态混合物分子间无相互作用力,分子不具有体积( )。
- A与B组成的二元混合物,已知纯B的蒸汽压比纯A的蒸汽压大,则 B在气相的含量必大于液相的含量( )。
- 液体的表面张力在温度达到临界温度时降为0( )。
A:恒容 B:恒温 C:恒压 D:任一过程
AI参考:正确选项是C:恒压。公式dU=nCvmdT是理想气体摩尔热容的定义式,用于描述理想气体在恒定温度和体积变化时的内能变化。对于恒压过程,压力保持恒定,符合公式使用的条件。而恒容、恒温过程虽然也是理想气体状态变化的常见情况,但它们的温度可能发生变化,此时公式不适用。因此,选项C恒压是唯一符合公式适用条件的过程类型。'
A: B: C: D:0
AI参考:正确答案是D:0。范德华方程是描述理想气体状态方程的一种经验方程,它是由范德华在19世纪末提出的。对于1mol范德华气体单纯pVT变化,其内能、焓、熵的变化均为零,即ΔU=ΔH=ΔS=0。因此,本题答案为D选项。'
A:4 B:3 C:1 D:2
答案:2
A:aμA+bμB=gμG+hμH B:aμaA+bμbB=gμgG+hμhH C:μaA+μbB=μgG+μhH D:μA+μB=μG+μH
答案:=μG+μH
A:不变 B:降低 C:无法判断 D:升高
AI参考:外界压力增大,冰的熔点会降低。这是因为压力增加时,分子间的有效间距减小,因而分子间的相互作用增强,这使得冰在低于熔点时也能融化。因此,正确答案是B:降低。'
A:pV=RT+b B:pV=RT-b C:pV=RT+bp D:pV=bRT
答案:pV=RT+Bp
A:上升 B:不变 C:无法判断 D:下降
答案:小于AI参考:正确答案是D:下降。焦尔-汤姆生系数μ表示的是气体做等温膨胀和等温压缩时,其体积与压力的比值相同,即膨胀时比压缩时体积增大得更多。若焦尔-汤姆生系数μ>0,说明气体做等温压缩时体积会减小,做等温膨胀时体积会增大,而节流过程是一个典型的等温膨胀过程,因此气体温度下降。因此,本题的正确选项为D:下降。'
A:0.721V B:0.305V C:1.586V D:0.914V
答案:0.721VAI参考:电极反应Tl3+/Tl的标准电极电势为ψƟ3 = ψƟ1 + (1/2)ΔE°,其中ΔE°为标准态下反应的电极电势差。已知ψƟ1 = 1.250V,ψƟ2 = -0.336V,因此ψƟ3 = 1.250 + (1/2) × 0.674 = 1.586V。因此,电极反应Tl3+/Tl的电势ψƟ3为选项C:1.586V。'
A:20 min B:30 min C:10 min D:40 min
A:= -100 J B:= 100 J C:< -100 J D:> 100 J
A:K1-K2 B:K1·K2 C:K1+K2 D:K1/K2
A:无法判断 B:变大 C:变小 D:不变
AI参考:正确答案是B:变大。当打开阀门时,原先较小的肥皂泡会受到空气的压强减小,内部气体膨胀,因此会变大。选项A、C、D都不符合实际情况。'
A: B: C: D:条件不足,不能判断
AI参考:正确答案是D:条件不足,不能判断。已知反应为固体分解反应,该反应在恒温恒容条件下进行,因此不能判断平衡常数。选项A、B、C都是错误的,因为平衡常数与压力无关,所以无法通过压力来判断平衡常数的大小。因此,答案为D。注意:由于本题未给出具体的温度和压力,因此无法确定平衡常数的具体数值。同时,要注意题目的关键点在于考察固体分解反应中平衡常数与压力的关系,而非单纯的固体分解反应的热力学或动力学性质。'
A:a中减少,b中增加 B:a中增加,b中减少 C:a、b均不变 D:a、b均减少
AI参考:在一封闭恒温箱中有二杯液体,气相已饱和,a杯为纯水,b杯为蔗糖水溶液,静置足够长的时间,发现a中增加,b中减少。这是因为a杯中的水蒸发为气相中的水蒸气,而b杯中的蔗糖溶质逐渐结晶析出,并使得溶液浓度降低,水分释放减少,从而b杯中的液体减少。因此,正确答案是B:a中增加,b中减少。'
A: B: C: D:
A:等于 B:小于 C:无法判断 D:大于
AI参考:正确答案是A:等于。理想气体自相同的始态,经可逆绝热压缩或不可逆绝热压缩至相同的终态体积,由于绝热过程不做功,因此系统U终(可逆)等于系统U终(不可逆),所以选择A。'
A:Al3+ B:Mg2+ C:K+ D:H+
A:南方夏天 B:北方夏天 C:北方冬天 D:南方冬天
AI参考:正确答案是C:北方冬天。北方冬天气温低,需要内燃机车提供更多的热量来维持机车的运行和列车的行驶,因此消耗燃料更多。南方夏天相对比较温暖,不需要过多的热量供给,消耗燃料较少。而北方夏天相对北方冬天而言,温度相对较高,消耗燃料也会相应减少。因此,内燃机车头牵引相同的一列车厢,在北方冬天环境下消耗燃料最多。'
A:ΔmixA=0 B:ΔmixS=0 C:ΔmixG=0 D:ΔmixH=0
AI参考:正确答案是C:ΔmixG=0。在恒T、p下,理想液态混合物组成恒定,因此混合过程吉布斯自由能变化ΔmixG=0。而ΔmixH、ΔmixS以及ΔmixA(A选项和B选项)的大小会随着反应程度和生成产物的大小变化而变化,故答案为C。'
A:增加,减小 B:增加,增加 C:减小,增加 D:减小,减小
AI参考:根据题意,溶液的浓度从“13.png”增加到“14.png”,根据电解质溶液理论,溶液的离子浓度增加,电导率会增大,而摩尔电导率是单位体积内自由移动的离子数目的电导,因此也会增大。因此,正确答案是B:增加,增加。'
A:kA=2kB B:2kA=kB C:kA=k2B D:kA=kB
A:观察到的仅是粒子对光散射的亮点 B:可以直接确切地看到粒子的形态和大小 C:可以配合电泳仪,测定粒子的电泳速度r D:可以观察粒子的Brown运动
A:fB=pƟ的纯气体B B:总压p=pƟ的混合气 C:pB=pƟ的假想纯理想气体B D:pB=pƟ的纯气体
AI参考:正确答案是:C:pB=pƟ的假想纯理想气体B。理想气体混合物中,各个组分的化学势仅取决于混合组分的化学势与它们的相对摩尔量的乘积。而对于非理想气体混合物中B的化学势μB=μ(B)+RTlnfB,μ(B)是混合组分B的化学势,fB是B在混合物中相对摩尔体积,μ(B)只与B自身及总的混合组分和总的压强有关,μ(B)可分解为两部分,即纯B组分对总体压缩的贡献(即总压的加权平均),再有由于有气体渗入、流出的非理想性对B的贡献。选项C是正确的。选项A和D错误,因为fB不等于pA=pƟ的纯气体A;选项B错误,因为μ(B)与混合气体的总压无关。希望以上答案对你有帮助。'
A:NaCl B:FeCl3 C:K3[Fe(CN)6] D:MgSO4
A: B: C: D:
AI参考:正确答案是D:化学势是函数在空间某一区域上的偏导数。化学势在材料科学中应用广泛,它可以描述材料中物质在特定条件下对物质的分布、扩散、化学反应速度等起决定性作用。A选项中的函数没有给出具体表达式,无法判断其偏导数;B选项中的函数表达式中包含了多个变量,无法判断其偏导数;C选项中的函数表达式与题目要求不符,因此也无法判断其偏导数。而D选项中的函数表达式为U(x, y),根据偏导数的定义,可得到U关于x的偏导数为∂U/∂x,关于y的偏导数为∂U/∂y。因此,D选项中的函数表达式符合题目要求,可以判断其偏导数。综上所述,正确答案是D:化学势是函数在空间某一区域上的偏导数。它是指函数在空间某一区域上的偏导数,在材料科学中应用广泛,可以描述材料中物质在特定条件下对物质的分布、扩散、化学反应速度等起决定性作用。'
A:Hg∣Hg2Cl2(s)∣KCl∣∣AgNO3∣Ag B:Ag∣AgCl(s)∣KCl∣Cl2∣Pt C:Zn∣ZnCl2∣∣KCl∣AgCl(s)∣Ag D:Zn∣ZnCl2∣Cl2∣Pt E:Pt∣H2∣HCl∣Cl2∣Pt
AI参考:正确答案是:E:Pt∣H2∣HCl∣Cl2∣Pt。根据题意,氯离子浓度不影响电池电动势,因此选项E正确。其他选项中,氯离子浓度都会影响电池电动势,因此错误。A选项中,氯离子浓度会影响正极反应和电池电动势;B选项中,氯离子浓度会影响正极电极电势,影响电池电动势;C选项中,氯离子浓度会和锌形成络合离子影响电极电势,进而影响电池电动势;D选项中,氯离子浓度和氢氧根浓度都会影响电极电势。所以答案是E。'
A:E1=2 E2 B:没有关系 C:E1=1/2E2 D:E1= E2
AI参考:答案选D:E₁=E₂。题目中给出了两个电池反应的ΔH,即反应热。根据反应热的概念,ΔH = φ(产物) - φ(反应物)。对于题目中的两个反应,反应物和产物都是一样的,因此ΔH的大小也取决于反应过程中的吉布斯自由能的变化,即ΔG = ΔH - TΔS。对于气体反应,温度T对ΔS的影响较大,因此在高温下,第二个反应的ΔG更小,即E₁>E₂。因此,选项D E₁=E₂是正确的。'
A:Ea = 无法确定 B: C: D:
AI参考:正确答案是D:Ea = 0。反应的实验活化能Ea值为0,因为等容反应的热效应没有提供活化能信息。选项A、B、C都与题干信息不符,故选D。'
A:表面能 B:液面下的附加压力 C:表面张力 D:饱和蒸汽压
AI参考:正确答案是:ABC。一定体积的水,处于两种状态:⑴形成一个大液滴;⑵分散成许多小液滴,表面能、液面下的附加压力、表面张力相同,D项说法错误。本题答案为ABC。注意区别分子热运动,内能的概念和联系,宏观量体现物态变化中物态变化的宏观过程及性质;宏观的电现象在微观的物理量体现的是微观的分子运动现象,属于电场性质;同时电场具有磁场的性质。题目中的选项都是属于物理性质,所以选择ABC。'
A:不能确定 B:负极移动 C:正极移动 D:不移动
A:热力学不稳定,动力学稳定系统 B:热力学稳定,动力学不稳定系统 C:热力学稳定,动力学稳定系统 D:热力学不稳定,动力学不稳定系统
AI参考:正确答案是C。溶胶是热力学上比较稳定,动力学上比较活泼的系统。热力学稳定性通常取决于物质的化学势,如果两个物质的化学势相等,那么这两个物质在体系中的状态就是平衡状态,这时系统就达到了热力学的稳定状态。动力学稳定性取决于物质在体系中扩散的速率,扩散速率快的物质容易在体系中移动,在化学反应中占优势,因而具有动力学优势。因此,对于溶胶来说,其热力学稳定性相对较好,因为溶质粒子之间相互作用力较弱,粒子之间的热运动也比较剧烈,可以认为各个粒子之间处于相对平衡状态;而动力学稳定性则取决于粒子在体系中的扩散速率和粒子之间的碰撞频率等因素,由于溶胶粒子尺寸较小,扩散速率较快,因此溶胶的动力学稳定性也较好。因此,正确答案是C:热力学稳定,动力学稳定系统。'
A:石墨的标准摩尔燃烧焓 B:金刚石的标准摩尔燃烧焓 C:CO(g)的标准摩尔燃烧焓 D:无定形碳的标准摩尔燃烧焓
A:1 B:3 C:4 D:2
A: B: C: D:
A:Ea=E2+1/2(E1-2E4 ) B:Ea=E2+1/2(E1-E4) C:Ea=E2(E1/2E4)1/2 D:Ea=E2+(E1-E4)1/2
A:对 B:错
AI参考:答案是B:错。一级反应的定义是反应速率只与反应物浓度的一次方成正比的反应。但是,一级反应不一定是单分子反应,因为反应可以是多分子之间的反应。因此,这个判断题是错误的。'
A:对 B:错
AI参考:正确答案是B:错。液体表面张力是指液体表面相邻两部分间,由于表面原因产生相互牵引的力。液体表面张力的产生原因是表面层中分子间距比液体内部分子间距大,分子间相互作用表现为引力。而题目中所述的液体与其饱和蒸汽之间或与被其蒸汽饱和了的空气之间的界面张力并不是液体表面张力,因此答案为B,即错误。'
A:对 B:错
A:错 B:对
AI参考:答案是B:对。 解释: 1. 绝热恒容过程,系统的热量交换为零,即Q=0。同时,由于绝热过程W可能不为零(取决于具体过程),因此不能通过这个条件来判断ΔU是否为零。 2. 绝热恒压过程,系统内部的压强保持恒定,因此不会因为做功而改变系统的能量。在这个过程中,系统内部的能量变化可以通过焓变来衡量,即ΔH。而焓变是由系统和环境之间的热量交换引起的,如果这个过程是绝热的,那么热量交换也为零,即Q=0。同时,由于W=0,因此这个过程是等温过程。根据等温过程的热力学性质,ΔH=0。 综上所述,选项B“绝热恒压且W=0的过程一定有ΔH=0”是正确的。选项A“绝热恒容且W=0的过程一定有ΔU=0”是不正确的。"
A:对 B:错
AI参考:答案:B。溶液表层浓度与溶液本体浓度之差不一定是表面吸附量,需要视具体情况而定。'
A:错 B:对
A:对 B:错
A:错 B:对
AI参考:答案是B:对。理想液态混合物是指分子间没有相互作用力,分子不具有体积的两个液体的混合物。在这种情况下,分子之间的相互作用力可以忽略不计,因此分子不会相互挤压或受到彼此的引力或斥力,也就是说分子没有体积变化或相互之间的相互作用。因此,答案为B:对。'
A:对 B:错
A:对 B:错
AI参考:答案是B:错。液体的表面张力在温度达到沸点时降为0,而不是临界温度。在液体蒸发的过程中,液体表面分子间相互作用力的变化导致液体表面产生张力,当液体达到沸点时,蒸发停止,表面张力也随之消失。因此,这个说法是错误的。'
温馨提示支付 ¥1.35 元后可查看付费内容,请先翻页预览!






