提示:内容已经过期谨慎付费,点击上方查看最新答案
材料工程中的物理化学基础
- 等温等压条件下,反应aA+bB=cC+dD达到化学平衡的条件是:( )
- 关于标准态的选取,下列说法错误的是:( )
- 根据某一反应的
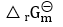 ,可以确定:( )
,可以确定:( ) - 下列各反应,其经验平衡常数Kp等于气相总压力的是:( )
- 热力学标准平衡常数的特征( )
- 下面的叙述中违背平衡移动原理的是( )
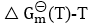 图中,位置越在下的元素,其相应的氧化物稳定性越低。( )
图中,位置越在下的元素,其相应的氧化物稳定性越低。( )- 封闭系统,当过程的始态和终态确定后,Q有定值。( )
- 当温度一定时,纯溶剂的饱和蒸气压越大,溶剂的液相组成也越大。( )
- 封闭系统,等压,且不做非体积功的情况下系统的焓改变值△H等于等压热。( )
- 孤立体系或绝热体系中,相同的始终态之间,可逆过程
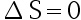 ,不可逆过程
,不可逆过程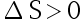 。( )
。( ) - 对于双组分液态系统,易挥发组分在平衡气相中的组成大于其在平衡液相中的组成。( )
- 对于纯组分,化学势等于其吉布斯函数。( )
- 高温物体所含的热量比低温物体的多,因此热从高温物体自动流向低温物体。( )
- 对于二元互溶液系,通过精馏方法总可以得到两个纯组分。( )
- 二组分真实液态混合物的总蒸气压与组分B的摩尔分数xB成直线关系。( )
- 溶液的凝固点降低只与溶质的质量摩尔浓度有关。( )
- 恒温、恒容条件下,增加反应物的量,会使平衡向右移动。( )
- 1mol理想气体从0℃等容加热至100℃和从0℃等压加热至100℃,Q相同。( )
- Q和W不是体系的性质,与过程有关,所以Q+W也由过程决定。( )
- CaCO3的分解压为
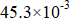 Pa,MgCO3的分解压为28.4 Pa,则说明CaCO3比MgCO3热稳定好。( )
Pa,MgCO3的分解压为28.4 Pa,则说明CaCO3比MgCO3热稳定好。( ) - 计算标准平衡常数时,化学反应式相加减对应着标准平衡常数相乘除。( )
- 杠杆规则只适用于T~x图的两相平衡区。( )
- 吉布斯判据适用于理想气体的任意过程。( )
- 绝热的封闭系统就是隔离系统。( )
- 将少量挥发性液体加入溶剂中形成稀溶液,则溶液的沸点一定高于相同压力下纯溶剂剂的沸点。溶液的凝固点也一定低于相同压力下纯溶剂的凝固点。( )
- 功可以全部转化为热,但热不能全部转化为功。( )
- 1mol理想气体从0℃等容加热至100℃和从0℃等压加热至100℃,W相同。( )
- 焓的定义式H=U+pV是在定压条件下推导出来的,所以只有在定压过程才有焓变。( )
- 在标准压力下加热某物质,温度由T1上升到T2,则该物质吸收的热量为
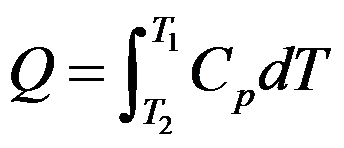 ,在此条件下应存在
,在此条件下应存在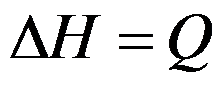 的关系。( )
的关系。( ) - 焓的增量
 等于该过程中体系从环境吸收的热量。( )
等于该过程中体系从环境吸收的热量。( ) - 二元液系中,若A组分对拉乌尔定律产生正偏差,那么B组分必定对拉乌尔定律产生负偏差。( )
- 凡是系统的温度有变化,则系统一定有吸热或放热现象。温度不变时,系统既不吸热也不放热。( )
- 某一过程的热效应与温度相除,可以得到该过程的熵变。( )
- 绝热过程Q = 0,根据熵的定义dS = δQ/T,可得dS = 0。( )
- 不可逆过程的熵变是不可求的。( )
- 体系经过一不可逆循环过程,其ΔS体 > 0。( )
- 对于一定量的理想气体,温度一定时,热力学能和焓一定。( )
- 1mol理想气体从0℃等容加热至100℃和从0℃等压加热至100℃,△U相同。( )
- 化学反应达到平衡时,平衡系统的分压商与压力和浓度无关。( )
- 亨利系数的大小与T、p以及溶液组成的表示方法有关。( )
- 孤立体系中,自发过程由A→B,但体系永回不到原来状态。( )
- 对于有纯凝聚物的复相反应,
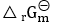 同时包含了气态和凝聚态的化学势( )
同时包含了气态和凝聚态的化学势( ) - 元素氧化反应的
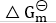 是对1mol氧化物而言。( )
是对1mol氧化物而言。( ) - 恒温、恒压条件下,增加反应物的量,一定会使平衡向右移动。( )
- 单组分系统的相图中两相平衡线都可以用克拉贝龙方程定量描述。( )
- 二组分理想液态混合物的总蒸气压介于两纯组分的蒸气压之间。( )
- 在隔离系统中,发生了一个过程,系统从状态1变到了状态2,那么不论用什么方法,系统再也回不到原来状态了。( )
- U和H是状态函数。( )
- 在相图中总可以利用杠杆规则计算两相平畅时两相的相对的量。( )
- 对于一个定量的理想气体,温度一定,热力学能和焓也随之确定。( )
- 热和体积功不是状态函数。( )
- 一个绝热过程Q=0,但体系的△T不一定为零。( )
- 在一可逆过程中,熵值不变。( )
- 恒沸物的组成不变。( )
- 渗透现象是由于纯溶剂的化学势大于溶液中溶剂的化学势所造成的。( )
- 下列过程中
 =0的是( )
=0的是( ) - 等温等压条件下,当反应的
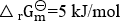 时,该反应能否进行?( )
时,该反应能否进行?( ) - 一单相体系, 如果有3种物质混合组成, 它们不发生化学反应, 则描述该系统状态的独立变量数应为( )
- 氢气和氧气在绝热钢瓶中生成水,则有:( )
- 理想气体绝热向真空膨胀,则:( )
- 如果只考虑温度和压力的影响, 纯物质最多可共存的相有( )
以下各系统中属单相的是( )
- 在101.3kPa下,110℃的水变为110℃水蒸气,吸热Qp,在该相变过程中下列哪个关系式不成立?( )
- 理想气体从状态I经自由膨胀到状态II,可用哪个热力学判据来判断该过程的自发性?( )
- 关于三相点, 下面的说法中正确的是( )
- 已知373K时液体A的饱和蒸气压为133.24kPa,液体B的饱和蒸气压为66.62kPa。设A和B形成理想溶液,当溶液中A的物质的量分数为0.5时,在气相中A的物质的量分数为:( )
- 关于热力学基本方程
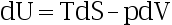 ,下面正确的是:( )
,下面正确的是:( ) - 一个由气相变为凝聚相的化学反应在恒温恒容下自发进行,问下列各组答案中哪一个是正确的:( )
- 正常沸点时,液体蒸发为气体的过程中( )
- 盖斯定律包含了两个重要问题,即( )
液体B比液体A易于挥发,在一定温度下向纯A液体中加入少量纯B液体形成稀溶液,下列几种说法中正确的是:( )
- 下列气体溶于水溶剂中,哪个气体不能用亨利定律:( )
- 水蒸气蒸馏通常适用于某有机物与水组成的:( )
- 对于偏摩尔量,指出下列说法错误者( )
- 理想气体混合过程中,下列体系的性质,不正确的是:( )
- 一卡诺热机在两个不同温度之间的热源之间运转,当工作物质为气体时,热机效率为42%,若改用液体工作物质,则其效率应当:( )
- 在101325Pa的压力下,I2在液态水与CCl4中的溶解已达到平衡(无固体I2存在),此体系的自由度为:( )
- 反应2NH3(g)==N2(g)+3H2(g)在某温度下的标准平衡常数为0.25,则在相同温度下氨的合成反应 0.5 N2(g)+ 1.5 H2(g)==NH3(g)的标准平衡常数为( )。
- 某理想气体从0℃、1MPA、绝热可逆膨胀至终态压力为0.1MPA、,温度降至141.1K。若在恒定外压0.1MPA、下绝热膨胀至终态,其终态温度将( )
- 分解压力越小的化合物,其热稳定性越( )。
- 对于相律, 下面的陈述中正确的是( )
- 在101.325kPa下,385K的水变为同温下的水蒸汽。对于该变化过程,下列各式中哪个正确:( )
液体在其沸点汽化时,若将蒸汽视为理想气体,由于温度恒定,则( )
- 对于下列平衡系统:①高温下水被分解;②同①,同时通入一些H2(g) 和O2(g);③H2和O2同时溶于水中,其组分数C和自由度数f的值完全正确的是:( )
- 关于熵的性质,下面的说法中不正确的是:( )
- 合成氨反应3H2(g)+N2(g)=2NH3(g),总压不变时,反应物的起始摩尔比为__,产物的平衡含量出现极大值。( )
- 理想气体可逆定温压缩过程中,错误的有:( )
- 关于亨利系数, 下面的说法中正确的是( )
- 绝热条件下,迅速推动活塞压缩气筒内的空气,过程的熵变:( )
- 下列各组量中皆为状态函数的是( )
- 理想气体在恒温条件下,经恒外压压缩至某一压力,此变化中体系的熵变ΔS体及环境的熵变ΔS环应为:( )
- 相律在下列体系中何者不适用? ( )
- 对于稀溶液中的溶质,下列各式何者不正确( )
- 不锈钢MIG焊时,常在保护气体Ar中加入少量氧气,其目的是什么?
A: B: C: D:
AI参考:正确选项为BCD。根据化学平衡的条件,在等温等压条件下,反应达到平衡的条件包括:正逆反应速率相等、各组分的浓度保持不变、体系的总压强保持不变。因此选项B、C、D都是正确的。选项A中只提到了速率相等,但没有提到各组分的浓度保持不变,因此不是达到平衡的条件之一。'
A:选取的标准态不同,则相应的化学势也不同 ; B:实际气体和理想气体的标准态相同 ; C:溶液中使用不同的标准态,则得到的活度不同 ; D:对溶质,只能选取假想态为标准态,不能选用真实态为标准态 ; E:纯固体物质的标准态与实际气体的标准态是不相同 。
答案:选取的标准态不同,则相应的化学势也不同;;对溶质,只能选取假想态为标准态,不能选用真实态为标准态;
A:标准平衡常数 B:提高温度,反应速率的变化趋势 C:标准态下自发过程的方向 D:标准态下系统所能作的最大非体积功
AI参考:根据反应的图像,可以确定:B:提高温度,反应速率的变化趋势其他选项与图像信息无关。温度升高,反应速率通常会加快。因此,答案为B。'
A:2FeO(S)=2Fe(S)+O2(g) B:ZnS(s)+ 1.5O2(g)= ZnO+SO2(g) C:NH4HS(s)=NH3(g)+H2S(g) D:CaCO3(s)=CaO(s)+CO2(g)
答案:CaCO3(s)=CaO(s)+CO2(g);;KClO3(s)=KCl(s)+O2(g).
A:量纲为1 B:是温度的函数 C:是压力的函数 D:量纲为Pa
AI参考:正确选项为:B, C热力学标准平衡常数是温度的函数,同时也是压力的函数。在化学平衡中,温度变化时,标准平衡常数会随之改变,同时压力变化时也会影响平衡常数的数值。热力学标准平衡常数并不具有量纲,因此选项A和D都是错误的。'
A:降低压力,平衡向气体分子总数增加的方向移动 B:增加压力,平衡向气体分子总数减小的方向移动 C:升高温度,平衡向放热方向移动 D:恒温恒容条件下加入惰性气体,平衡向气体分子总数增加的方向移动
答案:加入惰性气体平衡向总压力减少的方向移动
A:对 B:错
AI参考:这是一个视觉呈现的图片,但从描述和答案来看,这似乎是一道与化学相关的判断题。从图片中无法直接判断出元素的位置与氧化物稳定性之间的关系,因为这需要具体的化学知识和实验数据来支持。在没有更多信息的情况下,无法给出确切的答案。因此,无法判断是A对还是B错。'
A:对 B:错
答案:错
A:错 B:对
答案:错误
A:错 B:对
AI参考:正确答案是B:对。封闭系统,等压,且不做非体积功的情况下系统的焓改变值△H等于等压热。这是热力学中的基本概念,因为焓是描述系统能量的一个状态函数,其改变值只取决于系统始态和终态,与过程无关。而等压热是描述等压过程中系统吸收的热量,两者数值相等。'
A:错 B:对
A:对 B:错
AI参考:答案是B:错。对于双组分液态系统,易挥发组分在平衡气相中的组成应该小于其在平衡液相中的组成。这是因为液体的表面张力使得液体系统倾向于生成一个稳定的液-液界面,在这个界面上,易挥发组分将更倾向于留在液相中,从而使得在平衡气相中的组成低于在平衡液相中的组成。因此,本题判断错误。'
A:错 B:对
A:对 B:错
A:对 B:错
A:对 B:错
AI参考:答案:B:错。二组分真实液态混合物中,总蒸气压与组分B的摩尔分数不成线性关系,因为蒸气压与溶液中气液平衡相内的气体分压是同号相关的,气体的分压随着气体的溶解度或分子扩散系数的平方根的增加而增加。因此,二组分真实液态混合物的总蒸气压与组分B的摩尔分数不是直线关系,而是抛物线关系。'
A:错 B:对
AI参考:答案:B:对。溶液的凝固点降低与溶质的质量摩尔浓度有关,凝固点降低的数值可以用凝固点下降公式计算得出。因此,这个说法是正确的。'
A:错 B:对
AI参考:答案:A:错。在恒温、恒容条件下,增加反应物的量,会使其浓度增大,根据勒夏特列原理,平衡会向减小这种改变的方向移动,即平衡向左移动。所以该题是错误的。'
A:对 B:错
A:对 B:错
A:对 B:错
AI参考:答案:B。从题干中给出的信息可知,CaCO3的分解压小于MgCO3的分解压,即CaCO3不稳定,所以答案为B,说明错误。'
A:错 B:对
AI参考:答案是B:对。标准平衡常数是一个与化学反应本身和反应条件有关的常数,它表示了化学反应达到平衡时反应物和产物浓度的幂次方乘积的乘积之比。在计算标准平衡常数时,化学反应式相加减对应着标准平衡常数的乘除关系,即两个化学反应的标准平衡常数之积等于它们的加和。因此,答案是B:对。'
A:对 B:错
A:错 B:对
A:对 B:错
A:对 B:错
A:错 B:对
A:错 B:对
A:错 B:对
A:错 B:对
A:错 B:对
A:对 B:错
A:错 B:对
AI参考:答案是B:对。根据热力学第一定律,系统内能的变化量等于外界对系统做的功和系统吸收(放出)的热量之和。因此,只要系统的温度有变化,就一定有吸热或放热现象。而温度不变时,系统既不吸热也不放热,除非有其他能量转化或转移过程。因此,这个判断题的答案是B,即“对”。'
A:错 B:对
A:错 B:对
AI参考:正确答案是B:对。绝热过程Q=0,根据熵的定义dS=δQ/T,可得dS=0。所以本题选B。'
A:对 B:错
A:错 B:对
A:对 B:错
A:错 B:对
A:对 B:错
AI参考:答案是B:错。化学反应达到平衡时,平衡系统的分压商与压力和浓度有关。在化学平衡时,系统内的物质组成和浓度会发生变化,从而影响分压商。因此,选项B是错误的。'
A:错 B:对
AI参考:正确答案是B:对。亨利系数的大小与温度、压力以及溶液组成的表示方法有关。因此,该判断题是正确的。'
A:错 B:对
A:对 B:错
AI参考:这个问题的正确答案是【B:错】。对于有纯凝聚物的复相反应,凝聚态物质中不同相的化学势通常是不一样的,因为不同相之间存在界面,界面两侧的化学势存在差异。同时包含气态和凝聚态的化学势是不符合实际情况的。因此,选项B“错”是正确的。'
A:错 B:对
AI参考:B. 对。判断题中给出的图片展示的是元素氧化反应的化学方程式,根据化学方程式可知,氧化反应的反应物和生成物都是以摩尔为单位,因此该判断题是正确的。'
A:对 B:错
AI参考:答案是B:错。在恒温、恒压条件下,增加反应物的量,如果增加的量足够大,会使得体积增大,导致平衡向右移动。但如果增加的反应物的量不足以引起平衡的移动,那么平衡不会发生移动。因此,增加反应物的量不一定一定会使平衡向右移动。'
A:错 B:对
A:对 B:错
A:错 B:对
A:错 B:对
AI参考:正确答案为B:对。U和H确实是状态函数,用于描述系统的状态。因此,这个判断题是正确的。'
A:错 B:对
A:对 B:错
A:对 B:错
A:错 B:对
A:错 B:对
A:对 B:错
AI参考:正确答案是A:对。恒沸物是一种液体混合物,在一定压力下,具有固定的沸点,且组成不变。因此,恒沸物的组成是不变的。'
A:错 B:对
AI参考:答案是B:对。渗透现象是由于纯溶剂的化学势大于溶液中溶剂的化学势所造成的。渗透是指水分子或其他溶剂分子通过半透膜的扩散现象,而渗透现象的发生是因为溶液中的溶剂分子通过半透膜时,其化学势较纯溶剂为低,因此溶剂分子会从化学势较高的溶液向化学势较低的纯溶剂方向扩散,直至达到平衡。因此,渗透现象是由于纯溶剂的化学势大于溶液中溶剂的化学势所造成的。'
A:不做非体积功的定容绝热过程 B:只做体积功的定压绝热过程 C:只做体积功的绝热可逆过程 D:只做体积功的绝热过程
AI参考:正确答案是D:只做体积功的绝热过程。根据题目描述,需要判断
A:正向自发进行 B:不能进行 C:逆向自发进行 D:不能判断
AI参考:根据热力学第二定律,当等温等压条件下,化学反应自发进行的方向总是向着熵增加的方向进行。由于这个反应是熵减的反应,因此在这种情况下,该反应逆向自发进行,选项C是正确答案。需要注意的是,尽管答案已经给出,但在实际的反应中,仍然需要进一步的实验来验证这个反应能否进行。'
A:6个 B:5个 C:4个 D:3个
A:; B:; C:; D:;
A:dS = 0,dW = 0; B:dG = 0,dH = 0; C:dH = 0,dU = 0; D:dU = 0,dG =0。
A:P=4 B:P=3 C:P=1 D:P=2
A:极细的斜方硫和单斜硫混合物 B:大小不一的一堆单斜硫碎粒 C:漂白粉 D:墨汁
A:ΔS环不确定; B:ΔS体 > 0; C:ΔG体 < 0。 D:ΔS体 + ΔS环 > 0;
A:ΔU。 B:ΔS隔离; C:ΔG; D:ΔH;
A:三相点就是三条两相平衡线的交点 B:三相点的温度可随压力改变 C:纯物质和多组分系统均有三相点 D:三相点是纯物质的三个相平衡共存时的温度和压力所决定的相点
A:1 B:1/3 C:2/3 D:1/2
A:TdS是过程热; B:在可逆过程中,pdV等于体积功,TdS即为过程热。 C:TdS是可逆热; D:pdV是体积功;
AI参考:正确答案是D:pdV是体积功。根据热力学第一定律,热力学系统在经历一个过程时,内能的变化量等于外界对系统做的功和系统从外界吸收的热量之和。对于理想气体,体积功可以表示为pdV,因此选项D是正确的。在可逆过程中,根据热力学第二定律,热量的传递方向是单向的,所以选项A、C不正确。而选项B中所描述的内容不明确,不能确定它是过程热还是可逆热。因此,只有选项D是正确的。'
A:ΔS体 < 0,ΔS环 = 0; B:ΔS体 < 0,ΔS环 > 0; C:ΔS体 > 0,ΔS环 = 0。 D:ΔS体 > 0,ΔS环 < 0;
A:ΔU=0 B:ΔH=0 C:ΔG=0 D:ΔS=0
A:热力学第三定律及热的基本性质 B:热力学第一定律及热的基本性质 C:热力学第一定律及状态函数的基本特征 D:热力学第一定律和热力学第三定律
A:该溶液的渗透压为负值 B:该溶液的饱和蒸气压必高于同温度下纯液体A的饱和蒸气压 C:该液体的凝固点必低于相同压力下纯液体A的凝固点(溶液凝固时析出纯固态 D:该液体的沸点必低于相同压力下纯液体A的沸点
A:NH3 ; B:O2 ; C:N2 ; D:CO
A:互不相溶双液系 ; B:完全互溶双液系 ; C:所有双液系 。 D:部分互溶双液系 ;
A:(2) (3) B:(2) (4) C:(3) (4) D:(1) (4)(1)偏摩尔量必须有恒温恒压条件; (2)偏摩尔量不随各组分浓度的变化而变化;(3)偏摩尔量不随温度T和压力p的变化而变化; (4)偏摩尔量不但随温度T、压力p的变化而变化,而且也随各组分浓度变化而变化。
A:ΔH = 0; B:ΔG = 0; C:ΔU = 0。 D:ΔS > 0;
A:不变; B:无法判断。 C:增加; D:减少;
A:1 ; B:2 ; C:3 ; D:0 。
A:0.5 B:0.25 C:1 D:2
AI参考:正确答案是C:1。根据化学平衡常数的定义,反应物和生成物的平衡常数与化学计量数的比值相等。因此,在氨的合成反应中,平衡常数与氨的合成反应的化学计量数成正比,所以答案为C。'
A:等于141.1K B:低于141.1K C:高于141.1K D:缺少条件,无法确定
AI参考:B:低于141.1K 。这是因为该理想气体在恒定外压下进行绝热膨胀时,体积会增大,对外做功,内能减小,温度会降低。在题目给出的条件下,无法确定膨胀后的温度是否会降至141.1K以下。因此,答案为B。'
A:好 B:差 C:不变 D:不确定
A:影响相平衡的只有强度因素 B:平衡的各相中, 系统包含的每种物质都不缺少时相律才正确 C:相律不适用于有化学反应的多相系统 D:自由度为零意味着系统的状态不变
A:ΔS体 + ΔS环 < 0; B:ΔS体 + ΔS环 > 0; C:ΔS体 + ΔS环 = 0; D:ΔS体 + ΔS环的值无法确定。
A:无热效应 B:焓不变 C:热力学能不变 D:蒸汽压不变
AI参考:正确选项是B:焓不变。液体在其沸点汽化时,温度恒定,假设蒸汽为理想气体,焓不变,根据热力学第一定律,没有其他力做功,也没有对外放热或吸收热量,因此热力学能不变。焓是一个复合物态参量,包含内能和热力学压强。所以选择B选项,焓不变。'
A:①C = 2,f = 2 ②C = 3,f = 3 ③C = 1,f = 1 ; B:①C = 1,f = 2 ②C = 2,f = 3 ③C = 3,f = 3 。 C:①C = 1,f = 1 ②C = 2,f = 2 ③C = 3,f = 3 ; D:①C = 3,f = 3 ②C = 1,f = 1 ③C = 2,f = 2 ;
AI参考:正确答案是B:对于下列平衡系统:①高温下水被分解;②同①,同时通入一些H2(g) 和O2(g);③H2和O2同时溶于水中,其组分数C和自由度数f的值完全正确的是:①C = 1,f = 2 ②C = 2,f = 3。解释:在系统①中,只有水分解的反应,反应物和产物都是确定的,所以组分数C为1,而该系统处于高温下,无气体参与,所以自由度数f = 2。在系统②中,除了水分解的反应外,还通入了氢气和氧气,这两个组分是未知的,所以组分数C为2。同时,由于还通入了气体物质,系统的总自由度数f = 3(因为至少要确定两个独立变量才能判断系统处于平衡状态)。在系统③中,反应物是氢气和氧气,产物是水,所以组分数C为3。同时,由于氢气和氧气同时溶于水中,所以系统的自由度数f = 3(因为至少要确定三个独立变量才能判断系统处于平衡状态)。因此,只有B选项符合题意。'
A:某些自发过程中可以为系统创造出熵; B:熵变等于过程的热温商; C:系统的熵等于系统内各部分熵之和。 D:环境的熵变与过程有关;
A:5 B:3 C:2 D:4
A:Q < 0; B:ΔU = 0; C:ΔS隔离 = 0; D:ΔH = 0。
A:其值与温度、浓度和压力有关 B:其值与温度、溶剂和溶质的性质及浓度标度等因素都有关 C:其值与溶剂性质、温度和浓度大小有关 D:其值只与温度、溶质性质和浓度标度有关
A:等于零; B:小于零; C:大于零; D:不能确定。
A:. B:. C:. D:.
AI参考:正确答案是C。状态函数是一组随时间恒定不变的物理量,只受系统的初始状态(初始时刻的物理状态)的影响,而与过程的具体方式无关。选项C中的热容、熵、焓等都是状态函数,而选项A、B、D中的量都与过程有关,不是状态函数。'
A:ΔS体 < 0,ΔS环 = 0。 B:ΔS体 > 0,ΔS环 < 0; C:ΔS体 < 0,ΔS环 > 0; D:ΔS体 > 0,ΔS环 = 0;
A:NaCl过饱和水溶液 B:NaCl水溶液与纯水达渗透平衡 C:NaCl水溶液 D:NaCl饱和水溶液
AI参考:正确答案是C:NaCl水溶液。相律适用于不同相物质之间的平衡条件,选项中只有C项为单一物质的水溶液,不属于不同相物质之间的平衡条件,因此不适用相律。A、B、D三项均属于不同相物质之间的平衡条件,相律适用于这些情况。'
A:pB=knnB B:pB=kxxB C:pB=kmmB D:pB=kccB
AI参考:正确答案是:常在保护气体Ar中加入少量氧气,可以获得良好的熔透性和焊缝成形。不锈钢MIG焊时,加入少量氧气可以改善熔滴过渡,获得良好的熔透性和焊缝成形。这是因为氧气可以促进电弧的稳定性,使熔滴更容易过渡到熔池中,从而获得均匀的焊缝成形。同时,氧气还可以提高熔池的流动性,使焊缝更加致密、均匀。因此,在不锈钢MIG焊时,常在保护气体Ar中加入少量氧气,可以获得良好的熔透性和焊缝成形。'
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!

