提示:内容已经过期谨慎付费,点击上方查看最新答案
定量化学分析
- 用
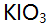 标定
标定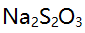 所涉及的反应是
所涉及的反应是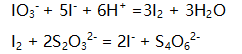 在此标定中
在此标定中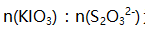 为( )。
为( )。 - 在
 HCl溶液中,已知
HCl溶液中,已知 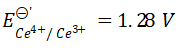 ,当
,当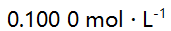 的
的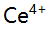 有99.9%被还原成
有99.9%被还原成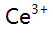 时,该电对的电极电势为( )。
时,该电对的电极电势为( )。  ( )。
( )。- 络合滴定中,若T E≤0.1%、
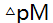 =±0.2,被测离子M浓度为干扰离子N浓度的1/10,欲用控制酸度滴定M,则要求1gK(MY)-lgK(NY)大于 ( )。
=±0.2,被测离子M浓度为干扰离子N浓度的1/10,欲用控制酸度滴定M,则要求1gK(MY)-lgK(NY)大于 ( )。 - 用EDTA滴定
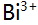 时,消除
时,消除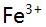 干扰宜采用( )。
干扰宜采用( )。 - 下列各项定义中不正确的是( )。
- 为标定HCl溶液可以选择的基准物是( )。
- 以下叙述正确的是( )。
- 分析测定中偶然误差的特点是 ( )。
- 现有同体积的四种溶液
(1)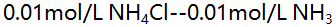
(2)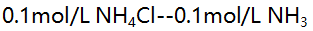
(3) 0.01mol/L HAc--0.01mol/L NaAc
(4)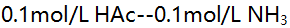
分别加入0.05mL 1mol/L HCl引起pH值变化最大的是( )。 - 下列哪种说法违背非晶形沉淀的条件 ( )。
- 在定量分析中,精密度与准确度之间的关系是( )。
- 测定
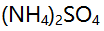 中的氮时,不能用NaOH标准溶液直接滴定,这是因为( )。
中的氮时,不能用NaOH标准溶液直接滴定,这是因为( )。 - 某溶液含
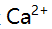 ,
,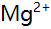 及少量
及少量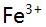 ,
,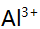 今加入三乙醇胺,调至p=10,以铬黑T为指示剂,用EDTA滴定,此时测定的是( )。
今加入三乙醇胺,调至p=10,以铬黑T为指示剂,用EDTA滴定,此时测定的是( )。 - 用邻苯二甲酸氢钾为基准物标定0.1 mol/L NaOH溶液,每份基准物的称取量宜为( )。(Mr( KHC8H8O4)=204.2)
- 今欲用H3PO4与Na2HPO4来配制pH为 7.2的缓冲溶液,H3PO4与Na2HPO4物质的量之比(n(H3PO4):n(Na2HPO4))应当是( )。(
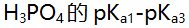 分别是2.12、7.20、12.36)
分别是2.12、7.20、12.36) - 在络合滴定中有时采用辅助络合剂,其主要作用是( )。
- 在重量分析中对无定形沉淀的洗涤,洗涤液应选择 ( )。
- 在含有NH3-NH4Cl的pH=10.0的介质中,以0.0200 mol/L EDTA溶液滴定20.0 mL 0.0200 mol/L
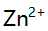 溶液,当加入400mL EDTA溶液时,在下列叙述中,正确的是( )。
溶液,当加入400mL EDTA溶液时,在下列叙述中,正确的是( )。 - 今在铵盐存在下,利用氨水作为沉淀剂沉淀
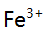 ,若铵盐浓度固定,增大氨的法度,
,若铵盐浓度固定,增大氨的法度, 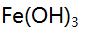 沉淀对
沉淀对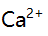 ,
, 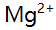 ,
, 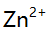 ,
, 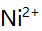 等四种离子的吸附量将 ( )。
等四种离子的吸附量将 ( )。 - 移取
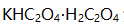 溶液 25.00 mL, 以0.1500 mol/L
溶液 25.00 mL, 以0.1500 mol/L 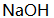 溶液滴定至终点时消耗25.00 mL。今移取上述
溶液滴定至终点时消耗25.00 mL。今移取上述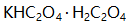 溶液20.00 mL, 酸化后用0.0400 mol/L
溶液20.00 mL, 酸化后用0.0400 mol/L 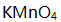 溶液滴定至终点时消耗溶液体积(mL)是( )。
溶液滴定至终点时消耗溶液体积(mL)是( )。 - 用邻苯二甲酸氢钾标定NaOH溶液浓度时会造成系统误差的是 ( )。
- 在pH=10的氨性缓冲液中以EDTA商定
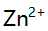 至150%处时,下面说法正确的是( )。
至150%处时,下面说法正确的是( )。 - 用挥发法测定某试样的吸湿水时,结果偏高,可能是由于 ( )。
- 已知乙二胺(L)与
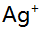 形成络合物的
形成络合物的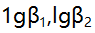 分别为4.7与7.7,当AgL络合物为主要存在形式时,溶液中游离L的浓度范围是( )。
分别为4.7与7.7,当AgL络合物为主要存在形式时,溶液中游离L的浓度范围是( )。 - 下列有关偶然误差的论述中不正确的是 ( )。
- 称取含氮试样0.2 g, 经消化转为
 ,后加碱蒸馏出
,后加碱蒸馏出 ,用10 mL 0.05 mol/L HCI吸收,返滴时耗去0.05 mol/L HaOH 9.5 mL。若想提高测定准确度,可采取的有效方法是 ( )。
,用10 mL 0.05 mol/L HCI吸收,返滴时耗去0.05 mol/L HaOH 9.5 mL。若想提高测定准确度,可采取的有效方法是 ( )。 - 关于总体平均值的概念不正确的理解是 ( )。
- 下列各组溶液中可用作标准缓冲溶液的是( )。
- 用0.1 mol/L HCl滴定
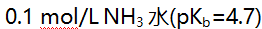 的pH突跃范围为6.3-4.3,若用0.1 mol/L HCl滴定0.1 mol/L
的pH突跃范围为6.3-4.3,若用0.1 mol/L HCl滴定0.1 mol/L 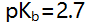 的某碱,pH突跃范围为( )。
的某碱,pH突跃范围为( )。 - 莫尔法测定
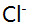 含量的时候,要求介质的pH在6.5-10范围内,若酸度过高则 ( )。
含量的时候,要求介质的pH在6.5-10范围内,若酸度过高则 ( )。 用EDTA直接滴定有色金属离子,终点所呈现的颜色是( )。
- 下列表述中,最能说明系统误差小的是( )。
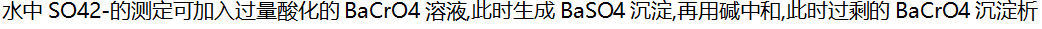
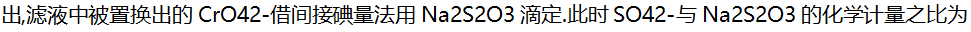 ( )。
( )。- 将等体积的pH=3的HCl溶液和pH=10的NaOH溶液混合后,溶液的pH区间是( )。
- 在下列溶液中,用
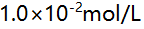 EDTA 滴定
EDTA 滴定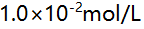 Zn2+至化学计量点时,
Zn2+至化学计量点时, 值最小的是( )。
值最小的是( )。 - 0.05 mol/L
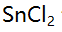 溶液10 mL与0.10 mol/L
溶液10 mL与0.10 mol/L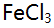 溶液 20 mL 相混合,平衡时体系的电位是( )。(已知此条件时
溶液 20 mL 相混合,平衡时体系的电位是( )。(已知此条件时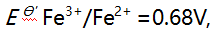
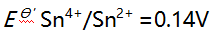 )
) - 以下关于偶然误差的叙述正确的是( )。
- 多元酸分步滴定时,若浓度均增加10倍,滴定突跃大小变化的pH单位是( )。
- 以甲基红为指示剂,能用Na0H标准溶液准确滴定的酸是( )。
- 对Ox-Red电对, 25
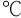 时条件电位
时条件电位 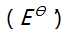 等于 ( )。
等于 ( )。 - 用NaOH标准溶液滴定浓度均为0.1mol/L的
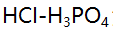 混合液,在滴定曲线上出现几个突跃( )。
混合液,在滴定曲线上出现几个突跃( )。 - 有一组平行测定所得的数据,要判断其中是否有可疑值,应采用 ( )。
- 欲配制pH=9的缓冲溶液,可取下列两种物质中的哪一种加入盐酸来配制 ( )。
- 以某吸附指示剂 (pKa =5.0) 作银量法的指示剂,测定的pH应控制在 ( ) 。
- 配制以下标准溶液必须用间接法配制的是( )。
- 磺基水扬酸(L)与
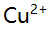 络合物的
络合物的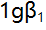 为9.5,
为9.5,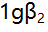 为16.5,[CuL]达最大的pL值当为( )。
为16.5,[CuL]达最大的pL值当为( )。 - 已知
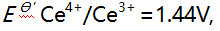
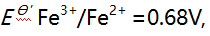 则下列反应
则下列反应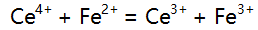 在化学计量点时,溶液中
在化学计量点时,溶液中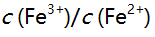 值为 ( )。
值为 ( )。 - 用EDTA滴定
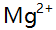 ,采用铬黑T指示剂,少量
,采用铬黑T指示剂,少量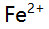 的存在将导致( )。
的存在将导致( )。 - 若醋酸的pKa = 4.74,则其有效数字位数为 ( )。
- 以下表述正确的是 ( )。
- 某溶液可能含有NaOH和各种磷酸盐,今用一HCl标准溶液滴定,以酚酞为指示剂时,用去12.84mL,若改用甲基橙为指示剂则需20.24 mL,此混合液的组成是( )。
- 做滴定分析遇到下列情况时,会造成系统误差的是( )。
- 某有色络合物的透光率T=9.77%,则吸光度值lg (1/T)为 ( )。
- 欲配制
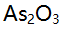 标准溶液以标定0.02 mol/L
标准溶液以标定0.02 mol/L 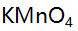 溶液,如要使标定时两种溶液消耗的体积大致相等,则
溶液,如要使标定时两种溶液消耗的体积大致相等,则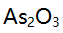 的浓度约为( )。
的浓度约为( )。 - 在p=10含酒石酸(A)的氨性缓冲溶液中,用EDTA滴定同浓度的
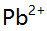 ,已计算得此条件下
,已计算得此条件下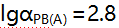 ,
,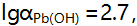 则
则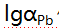 值为( )。
值为( )。 - 乙酰丙酮(L)与
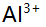 络合物的
络合物的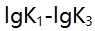 分别是8.6,6.9,5.8,则[Al]=[AIL2]时的pL值约为( )。
分别是8.6,6.9,5.8,则[Al]=[AIL2]时的pL值约为( )。 - 下列数据中有效数字为四位的是 ( )。
- 能消除测定方法中的系统误差的措施是 ( )。
- 在下列多元酸或混合酸中,用NaOH溶液滴定时出现两个滴定突跃的是( )。
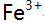 与
与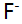 形成络合物的
形成络合物的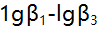 分别为5.3,9.3和12.1,已知在某一pH值时溶液中游离F-的浓度为
分别为5.3,9.3和12.1,已知在某一pH值时溶液中游离F-的浓度为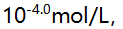 则溶液中铁络合物的主要存在形式是( )。
则溶液中铁络合物的主要存在形式是( )。- 用
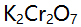 滴定
滴定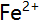 ,在化学计量点时,有关离子浓度的关系是 ( )。
,在化学计量点时,有关离子浓度的关系是 ( )。 - 若用0.1000mol/L KOH溶液分别滴定25.00mL 某
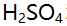 和HAc溶液,若消耗的体积相
和HAc溶液,若消耗的体积相
等,则表示这两种溶液中( )。 - 用重量法测定试样中的砷,首先使其形成
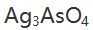 沉淀,然后转化为AgCl,并以此为称量形式,则用
沉淀,然后转化为AgCl,并以此为称量形式,则用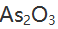 表示的换算因数是 ( )。
表示的换算因数是 ( )。 - 为标定KMnO4溶液的浓度宜选择的基准物是( )。
- 在含有0.10mol/LAgNO3和0.20mol/L
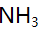 的混合溶液中,下列关于
的混合溶液中,下列关于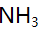 的物料平衡方程正确的是( )。
的物料平衡方程正确的是( )。 - 在pH=5.0时,用EDTA溶液滴定含有
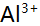 ,
,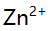 ,
,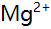 和大量
和大量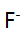 等离子的溶液,已知lgK(AlY)=16.3,JgK(ZnY)=16.5,1gK(HgY)=8.7,
等离子的溶液,已知lgK(AlY)=16.3,JgK(ZnY)=16.5,1gK(HgY)=8.7,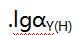 =6.5,则测得的是( )。
=6.5,则测得的是( )。 - 以下试剂能作为基准物的是( )。
- EDTA与金属离子络合时,一分子的EDTA可提供的配位原子数是( )。
- 1.0 moI/L
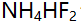 溶液的pH值是( )。(
溶液的pH值是( )。( 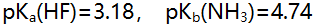 )
) - 用铈量法测定铁时,滴定至50%时的电位是 ( )
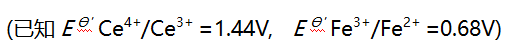
- 已知甲胺的
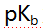 为3.38,苯胺
为3.38,苯胺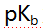 为9.38,甲酸的
为9.38,甲酸的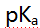 为3.74,以下混合液(浓度均为0.1mol/L)能用中和法准确滴定画线组分的是( )。
为3.74,以下混合液(浓度均为0.1mol/L)能用中和法准确滴定画线组分的是( )。 - 已知
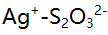 络合物的
络合物的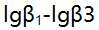 分别是9.0,13.0,14.0。以下答案不正确的是 ( )。
分别是9.0,13.0,14.0。以下答案不正确的是 ( )。 - 含0.10mol/L HCl和0.20mol/L
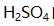 的混合溶液的质子条件式是( )。
的混合溶液的质子条件式是( )。 - 对正态分布特性描述错误的是 ( )。
- 已知乙二胺(L)与
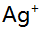 络合物的
络合物的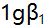 ,
,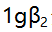 分别是4.7与7.7,则当[AgL]=
分别是4.7与7.7,则当[AgL]=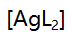 时的pL值是( )。
时的pL值是( )。 - 在pH=10氨性缓冲液中,以EDTA滴定
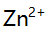 ,已计算出
,已计算出
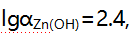 此时
此时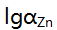 值为( )。
值为( )。 - pH=7.00的
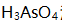 溶液有关组分平衡浓度的关系应该是 ( )。(已知
溶液有关组分平衡浓度的关系应该是 ( )。(已知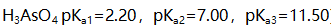 )
) - 表示一组数据离散特性的最好标志是 ( )。
- 若两电对的电子转移数均为2,为使反应完全度达到99.9%,两电对的条件电势差至少应大于( )。
- 在一定酸度和一定浓度
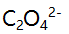 存在下,
存在下,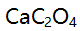 的溶解度计算式为 ( )。
的溶解度计算式为 ( )。 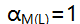 表示( )。
表示( )。- 实验中出现以下情况引起偶然误差的是 ( )。
- 测定铁矿中Fe的百分含量,求得置信度为95%时平均值的置信区间为35.21±0.10。对此区间的正确理解是 ( )。
- 将13.5g六次甲基四胺加到4.0mL 12mol/L HCl中,稀释至100mL,其pH值为( )。(
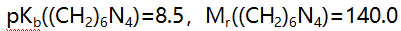 )
) - 用NaQH标准溶液滴定一元弱酸时,若弱酸和NaOH的浓度都比原来增大十倍,则滴定曲线中( )。
- 今欲配制pH=4.0、pCa=3.8的溶液,所EDTA与
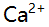 物质的量之比(n(Y):n (Ca))为( 已知pH=4.0时,
物质的量之比(n(Y):n (Ca))为( 已知pH=4.0时,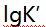 (CaY)=4.1 ) ( )
(CaY)=4.1 ) ( ) - 将酚酞指示剂加到某无色溶液中,溶液仍无色,表明溶液酸戚性为( )。
- 在氨性缓冲液中用EDTA商定
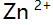 至化学计是点时,以下关系正确的是( )。
至化学计是点时,以下关系正确的是( )。 - 用0.2 mol/L NaOH溶液滴定0.2 mol/L HCl和0.2 mol/L柠檬酸(
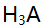 )的混合液(
)的混合液(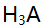 的
的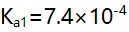 ,
,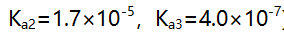 ),如果允许滴定误差为0.1%,则终点时溶液组成应为( ) 。
),如果允许滴定误差为0.1%,则终点时溶液组成应为( ) 。 - 用双指示剂法测定可能合有NaOH及各种磷酸盐的混合液。现取一定体积的该试液,用HCl标准溶液滴定,以酚酞为指示剂,用去HCl 18.02 mL。然后加入甲基橙指示剂继续滴定至橙色时,又用去20.50mL,则此溶液的组成是( )。
- 按正态分布
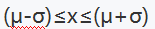 出现的概率为 ( )。
出现的概率为 ( )。 - 含有
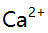 ,
, 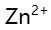 、
、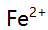 混合离子的弱酸性试液,若以
混合离子的弱酸性试液,若以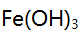 形式分离
形式分离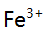 ,应选择的试剂( )。
,应选择的试剂( )。 - EDTA滴定
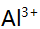 ,
,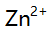 ,
,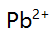 混合液中的
混合液中的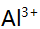 应采用( )。
应采用( )。 - 已知
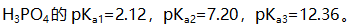 今有一磷酸盐溶液的pH=4.66,则其主要存在形是( )。
今有一磷酸盐溶液的pH=4.66,则其主要存在形是( )。 - 中性水溶液是指( )。
- 对置信区间的理解正确是 ( )。
- 有两组分析数据,要比较它们的精密度有无显著性差异,则应当用 ( )。
- 用重量法测定样品中
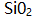 含量时能引起系统误差的是 ( )。
含量时能引起系统误差的是 ( )。 HPO42- 的共轭碱是( )。
A:1:1 B:1:5 C:1:2 D:1:6
答案:1:6
A:0.90 V B:1.22 V C:1.28 V D:1.10 V
AI参考:根据题目描述,已知$HCl$溶液中$,99.9\\%$的$H^{+}$被还原成$H_{2}$,此时电对中的其他物质(如$H_{2}O$、$Cl^{-}$等)可能发生电化学反应,因此无法直接使用标准电极电势进行计算。但根据题目的描述,可以推测出该电对可能是$Cl_{2} \rightleftharpoons {Cl}^{-} + {e}^{-}$。标准电极电势对于这个电对为${Cl}^{-}$对${Cl_{2}}$的电极电势为$1.36V$。所以该电对的电极电势应该在$1.36V$左右,因此选项C是正确答案。需要注意的是,由于题目中没有给出其他电化学反应的具体情况,因此无法得出更精确的数值。同时,对于某些电对,标准电极电势可能需要进行修正才能得到更准确的数值。因此,在实际应用中,需要结合具体的情况进行分析和计算。'
A:6.00 B:12.00 C:10.00 D:5.00
AI参考:正确答案是D:5.00。根据题干中的图片信息,可以得知该图片的宽度为415.2pt,高度为43.15pt。由于题目要求选择一个选项,因此需要将图片的宽度和高度进行比较,找到最接近的数值。选项A、B、C的数值都比图片的宽度和高度大,只有选项D的数值接近图片的宽度和高度,因此答案为D。'
A:5 B:6 C:7 D:8
AI参考:正确答案是C:7。根据络合滴定原理,当控制酸度滴定M时,要求lgK(MY)-lgK(NY)大于7,即lg[M(NH4+)]/c(N)大于7,所以干扰离子N浓度越小越好。题目中干扰离子N浓度为被测离子M浓度的1/10,所以干扰离子N浓度越小,干扰越小。因此,答案为C。'
A:加三乙醇胺 B:加NaOH C:加抗坏血酸 D:加氰化钾
答案:
A:相对误差是绝对误差在真值中所占的百分比 B:总体平均值就是真值 C:绝对误差是测定值与真值之差 D:偏差是指测定值与平均值之差
答案:总体平均值就是真值
A:NaOH B: C: D:
答案:Na2CO3
A:用HCl滴定NaOH,选酚酞为指示剂的终点误差为正值 B:用蒸馏法测,若采用吸收,以HCl滴定至甲基橙变色,终点误差为负值 C:用蒸馏法测,若采用HCl吸收,以NaOH返滴至pH为7,终点误差为负值 D:用NaOH滴定HCl,选甲基橙为指示剂的终点误差是正值
答案:断电时,RAM中保存信息全部丢失,ROM中保存的信息不受影响。;磁盘必须进行格式化后才能使用;Ctrl键是起控制作用的,它一般与其他键同时按下才有用
A:数值无规律可循 B:正负误差出现的概率相同 C:大小误差出现的概率相同 D:数值有一定范围
A:(1)和(3) B:(4) C:(2)和(4) D:(2)
AI参考:正确答案是:C:(2)和(4)。(1)与HCl发生中和反应;(2)的离子积大于水的离子积,加入HCl引起水解平衡向逆反应方向移动,(2)溶液酸性增强;(4)中醋酸根离子水解平衡也向逆反应方向移动,溶液酸性增强。因此,加入HCl引起pH值变化最大的是(2)和(4),答案为C。'
A:沉淀应放置过夜使沉淀陈化 B:沉淀应在热溶液中进行 C:沉淀应在不断搅拌下迅速加入沉淀剂 D:沉淀应在浓的溶液中进行
A:精密度高,准确度必然高 B:精密度是保证准确度的前提 C:准确度高,精密度也就高 D:准确度是保证精密度的前提
A: B: C: D:
AI参考:正确答案是D:测定
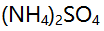 中的氮时,不能用NaOH标准溶液直接滴定是因为亚硝酸盐的性质极不稳定。根据题干中给出的图片,需要用NaOH标准溶液来测定氮含量。然而,亚硝酸盐的性质极不稳定,在酸性条件下容易分解成氮气和水,无法进行直接滴定。因此,不能使用NaOH标准溶液直接滴定该物质中的氮含量。综上,本题答案为D。'
中的氮时,不能用NaOH标准溶液直接滴定是因为亚硝酸盐的性质极不稳定。根据题干中给出的图片,需要用NaOH标准溶液来测定氮含量。然而,亚硝酸盐的性质极不稳定,在酸性条件下容易分解成氮气和水,无法进行直接滴定。因此,不能使用NaOH标准溶液直接滴定该物质中的氮含量。综上,本题答案为D。'A:,,, 总量 B:量 C:,总量 D:量
AI参考:答案:C。由题意可知,溶液中含有的金属离子为钙离子和镁离子,在溶液pH值为10时,铬黑T指示剂可以准确滴定溶液中的钙离子,因此加入三乙醇胺调节溶液pH值为10后,可以测定溶液中的钙离子总量。因此,答案为C。'
A:0.2 g左右 B:0.8 g-1.6 g C:0.4 g- 0.8 g D:0.2 g-0.4 g
A:1:1 B:1:3 C:3:1 D:1:2
A:作指示剂 B:将被测离子保持在溶液中 C:控制溶液的酸度 D:掩蔽干扰离子
A:冷水 B:热的电解质稀溶液 C:沉淀剂稀溶液 D:有机溶剂
A: B: C:都不正确 D:
A:四种离子都增加 B:,增加而,减少 C:,增加而,减少 D:四种离子都减少
A:31.25 B:20.00 C:25.00 D:40.00
A:每份加入的指示剂量不同 B:NaOH溶液吸收了空气中的 C:用甲基橙作指示剂 D:每份邻苯二甲酸氢钾质量不同
A:加热后的称量时间过长 B:试样加热后没有冷到室温就称量 C:加热时间不足 D:加热的温度过低
A: B: C: D:
AI参考:答案:C推理过程:根据题意,$L$与$Ag^{+}$形成的络合物类型为配位化合物,且已知$L$与$Ag^{+}$形成络合物的稳定常数分别为$K_{1} = 4.7$和$K_{2} = 7.7$。当$AgL$络合物为主要存在形式时,溶液中游离$L$的浓度范围为$K_{1} \times K_{2} < c(L) < K_{1}$。因此,本题答案为C选项。注:由于配位化合物的稳定常数与温度有关,因此本题答案仅供参考,实际浓度可能因温度变化而变化。'
A:偶然误差是由一些不确定的偶然因素造成的 B:偶然误差具有单向性 C:偶然误差具有随机性 D:偶然误差在分析中是无法避免的
A:使用更稀的HCI溶液 B:使用更稀的NaOH溶液 C:增加试样量 D:增加HCI溶液体积
A:标准正态分布的 B:随机变量有向某个中心值集中的趋势 C:总体平均值就是真值 D:无限多次测定的平均值即为总体平均值
A:邻苯二甲酸氢钾--HCl B:甲酸--NaOH C: D:0.05mol/L 邻苯二甲酸氢钾
A:8.3-2.3 B:8.3-4.3 C:4.3-6.3 D:6.3-2.3
AI参考:正确答案是C:4.3-6.3。根据题意,用0.1mol/LHCl滴定某碱的pH突跃范围为6.3-4.3,若用同样浓度的盐酸滴定该碱,因为滴定前后的氢离子浓度相同,因此碱的pH值将整体向上移动一个数量级,即4.3-6.3。因此,答案为C。'
A:沉淀不易形成 B:AgCl沉淀不完全 C:AgCl沉淀易胶溶 D:AgCl吸附Cl-增强
A:游离指示剂的颜色与EDTA-金属离子络合物的颜色的混合颜色 B:指示剂-金属离子络合物的颜色 C:EDTA-金属离子络合物的颜色 D:游离指示剂的颜色
A:高精密度 B:标准偏差大 C:与已知含量的试样多次分析结果的平均值一致 D:仔细校正所用砝码和容量仪器等
A:1:6 B:1:2 C:1:3 D:1:1
AI参考:正确答案是C:1:3。两个图片宽度相同,高度不同,说明它们的长度与宽度比不同,题目要求比例一致,只有选项C 1:3符合条件。'
A:3-4 B:6-7 C:1-2 D:11-12
AI参考:正确答案是B:6-7。混合后溶液的pH值取决于溶液中氢离子和氢氧根离子的相对浓度。将等体积的pH=3的HCl溶液和pH=10的NaOH溶液混合后,氢离子和氢氧根离子的浓度大约都变成了原来的一半。因为HCl的酸性更强,混合后的溶液中的氢离子浓度应该接近氢氧化钠中氢氧根离子浓度的1/2。因为中性溶液中氢离子和氢氧根离子的浓度相等,所以混合后的溶液应该在pH接近7的位置。因此,选项B是正确答案。'
A: B: C: D:
AI参考:正确答案是:B:EDTA的浓度太低了。滴定到化学计量点时,$Zn^{2 +}$浓度越小,误差越大,本题选B。【注】图片内容:在化学计量点时,由于滴定溶液浓度越低,消耗的$EDTA$溶液越多,使得滴定终点判断困难。为了准确判断滴定终点,在$EDTA$滴定$Zn^{2 +}$溶液时,一般控制$EDTA$溶液的浓度较大。本题答案的给出,是符合实际操作的。因此,选择B选项。【说明】由于本题为单选题,故其他选项错误。实际上,如果$EDTA$溶液浓度过高,则会导致滴定终点变色不明显,不利于准确判断滴定终点。因此,在实际操作中,一般选择合适的$EDTA$溶液浓度。【拓展】本题考查了$EDTA$标准溶液的配制和标定等知识点。为了使$Zn^{2 +}$溶液的浓度与标准物质中$ZnO$含量符合,需要进行测定并配制适当的溶液浓度。具体方法为称取一定质量的锌粒或锌粉与过量$EDTA$溶液反应,控制适宜的滴定温度并观察到滴定终点(滴入少量指示剂即发生颜色变化),从而得到测定结果。如果$EDTA$溶液浓度不合适,则会导致测定结果不准确。因此,在实际操作中需要选择合适的$EDTA$溶液浓度。【注意】本题中给出的图片内容是解题的关键信息之一。在实际操作中,需要注意控制适宜的滴定温度和指示剂用量等细节问题。本题也可以采用选项A作为答案(即在实验中允许存在误差的情况下),只要考生能说清楚其原因即可。'
A:0.14V B:0.32V C:0.50V D:0.68V
AI参考:正确答案是C:0.50V。混合后溶液的体积为30mL,根据电位差公式E=2.303RT/nF可知,混合后溶液的电位为0.50V。因此,答案为C。'
A:负误差出现的概率大于正误 B:正误差出现的概率大于负误差 C:正负误差出现的概率相等 D:大小误差出现的概率相等
AI参考:选项C“正负误差出现的概率相等”是正确的。偶然误差是由于测量工具、测量方法、环境条件等因素的影响,导致测量结果偏离真值,但偏离方向和大小是不确定的。因此,正误差和负误差出现的概率是相等的,大小误差出现的概率也是相等的。选项A、B、D都存在错误。'
A:10个单位 B:1个单位 C:不变化 D:2个单位
AI参考:正确答案是B:1个单位。多元酸分步滴定时,若浓度均增加10倍,滴定突跃大小变化的pH单位是1个单位。这是因为多元酸的解离常数只与溶液的pH有关,而与溶液的浓度无关。因此,当浓度增加10倍时,溶液的pH只发生一个单位的改变。因此,答案为B。'
A:硫酸 B:草酸 C:甲酸 D:乙酸
AI参考:正确答案是B:草酸。草酸是一种有机酸,其水溶液呈酸性,能与碱反应,所以可以用NaOH标准溶液准确滴定。而硫酸、甲酸、乙酸均具有强酸性,无法用NaOH标准溶液滴定。因此,本题答案为B。'
A: B: C: D:
AI参考:正确答案是C。根据氧化还原电对的标准电极电位图可知,该电对的条件电位是氧化型(氧化剂)与还原型(还原剂)浓度的比值(也称浓差电位)。根据氧化还原反应的方向及自发进行的条件判断该氧化还原反应的条件是存在的。从条件电位曲线可得出C项答案为条件电位等于的条件是加入固体氢氧化钠(0.1mol/L)。故答案为C。'
A:2 B:3 C:1 D:4
AI参考:正确答案是C:1。根据题目描述,混合液的浓度均为0.1mol/L,因此只有一个强度的酸或碱,只有一个滴定突跃。因此,答案为C。'
A:F检验 B:Q检验 C:t检验 D:检验
AI参考:正确答案是B:Q检验。Q检验是一种用于判断一组平行测定数据中是否存在可疑值的统计方法。这种方法通过计算一组数据中各测定值与总体平均值的离差平方和,再根据这些离差平方和的均值是否显著不同于零来判定是否存在可疑值。因此,要判断一组平行测定所得的数据中是否有可疑值,应采用Q检验。选项ACD都不是用于判断可疑值的统计方法,因此不正确。'
A: B:
AI参考:本题未给出答案,只有一种物质是未知的。而A物质似乎不太适合用来配制缓冲溶液,因此选项A可能不太准确。相反,B选项是一个相对合适的选择,通常用碳酸氢钠和盐酸来配制pH为9的缓冲溶液。因此,正确答案是B。'
A:pH﹤5.0 B:5.0﹤pH﹤10.0 C:pH﹥5.0 D:pH﹥10.0
A:NaCl B: C:NaOH D:
AI参考:正确答案是:C:NaOH。本题考查的是标准溶液的配制方法。氢氧化钠具有强腐蚀性,不能直接配制,需要用邻苯二甲酸氢钾标准溶液标定。故选C。'
A:16.5 B:8.3 C:9.5 D:7.0
AI参考:选项C:9.5。解析:本题中,[CuL]达到最大值时,应该满足配位平衡,即:$L + Cu^{2+} = LCu^{2+}$。此时,L浓度为$9.5$,$Cu^{2+}$浓度为$16.5$,满足$L$与$Cu^{2+}$的摩尔比为$1:16$,即$L$与$Cu^{2+}$的配位数为$16$。因此,[CuL]最大时,pL值应该为$9.5$。'
A: B:92.5 C: D:36.2
AI参考:根据题目中的描述,给出的四个选项中只有B选项92.5是符合题意的正确答案。因为在化学计量点时,溶液中的物质浓度应该是一个固定的数值,而题目中给出的三个图像中,只有第二个图像中的物质浓度在化学计量点时是一个固定的数值,即92.5。其他两个图像中的物质浓度随着反应的进行而变化,不符合题目要求。因此,正确答案是B选项92.5。'
A:与指示剂形成沉淀,使其失去作用 B:终点颜色变化不明显以致无法确定终点 C:在化学计量点前指示剂即开始游离出来,使终点提前 D:使EDTA与指示剂作用缓慢,终点延长
AI参考:正确答案是B:终点颜色变化不明显以致无法确定终点。由于铬黑T指示剂与少量镁离子形成络合物,导致滴定终点颜色变化不明显,无法确定终点,因此答案为B。其他选项中,A、C、D都与题干描述不符。'
A:四位 B:二位 C:三位 D:一位
A:铬黑T指示剂只适用于酸性溶液 B:铬黑T指示剂适用于弱碱性溶液 C:二甲酚橙可适用于酸性也适用于弱戚性溶液 D:二甲酚橙指示剂只适于pH>6时使用
AI参考:以下表述正确的是B:铬黑T指示剂适用于弱碱性溶液。铬黑T指示剂可以用于pH范围为5~9的溶液,所以B选项“铬黑T指示剂适用于弱碱性溶液”是正确的。A选项“铬黑T指示剂只适用于酸性溶液”是错误的,因为铬黑T指示剂可以在弱酸性或中性溶液中应用。C、D选项中,二甲酚橙指示剂既可以用于酸性溶液也可以用于弱碱性溶液,但具体应用pH范围还需根据实际实验结果来确定。'
A: B: C: D:
A:移液管转移溶液后管尖处残留有少量溶液 B:确定终点的颜色略有差异 C:称样用的双盘天平不等臂 D:滴定管读数时最后一位估计不准
A:1.010 B:1.0101 C:1.01 D:1.0
A:0.016 mol/L B:0.050 mol/L C:0.032 mol/L D:0.025 mol/L
A:2.7 B:5.5 C:2.8 D:3.1
A:7.8 B:6.4 C:6.9 D:8.6
A:35.070 B:pH=4.008 C:0.7000 D:0.056
A:称样量在0.2 g以上 B:认真细心地做实验 C:增加平行测定次数 D:用标准样品进行对照试验
A: B: C: D:
A: B: C: D:
AI参考:根据题目描述,三个络合物的组成分别为Fe(5.3)、Fe(9.3)和Fe(12.1),其中铁的浓度最高的是Fe(12.1)。在某一pH值时,溶液中游离的F-浓度为61.5,这表明F-的存在不会对铁的络合物产生影响。因此,溶液中铁络合物的主要存在形式是Fe(12.1)。因此,正确答案是C:铁的主要存在形式是Fe(12.1)。'
A: B: C: D:
AI参考:正确答案是C: 。滴定在化学计量点时,溶液中氢离子浓度和氢氧根离子浓度相同,和两个图片无关。因此选项C是正确答案。在滴定过程中,酸碱滴定液的浓度一定,所以有关离子浓度的关系取决于溶液的体积变化和反应物浓度的变化。两个图片中展示的只是两个不同的物质在化学计量点时的状态,不会影响离子浓度的关系。因此,我们可以推断出答案是C,即两个溶液的pH值相等,不会因为溶液中有物质产生或者消耗而对pH值产生影响。总之,这个问题需要关注的是化学计量点时的离子浓度关系,而与图片展示的内容无关。所以答案为C。'
A: B: C: D:
A: B: C: D:
A: B: C: D:
A: B: C: D:
A:Zn的含量 B:Zn和Mg的总量 C:Al,Zn,Mg总量 D:Mg的含量
AI参考:单选题在pH=5.0时,用EDTA溶液滴定含有
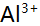 ,
,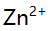 ,
,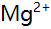 和大量
和大量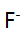 等离子的溶液,已知lgK(AlY)=16.3,JgK(ZnY)=16.5,lgK(HgY)=8.7,
等离子的溶液,已知lgK(AlY)=16.3,JgK(ZnY)=16.5,lgK(HgY)=8.7,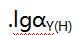 =6.5,滴定所用的EDTA浓度为c(EDTA),体积为VmL,下列分析不正确的是()。选项中的关系式在问题中并没有提及,我们需要通过实验中可获取的数据来确定所用的金属离子和溶液总量的关系。由于金属离子的总浓度在实验条件下未知,无法判断该选择题的正确答案。因为答案并未提供所需的金属离子浓度信息,无法通过解析获得正确的选项。因此,本题的答案为D:Mg的含量。'
=6.5,滴定所用的EDTA浓度为c(EDTA),体积为VmL,下列分析不正确的是()。选项中的关系式在问题中并没有提及,我们需要通过实验中可获取的数据来确定所用的金属离子和溶液总量的关系。由于金属离子的总浓度在实验条件下未知,无法判断该选择题的正确答案。因为答案并未提供所需的金属离子浓度信息,无法通过解析获得正确的选项。因此,本题的答案为D:Mg的含量。'A:分析纯 B:99.99%金属铜 C:干燥过的分析纯CaO D:光谱纯三氧化二铁
AI参考:正确答案是D:光谱纯三氧化二铁。基准物应符合以下要求:纯度高,主成分含量在99.9%以上;性质稳定,不易吸湿、不易氧化等;具有较大的分子量或式量,以减少称量时可能产生的误差;对于所配制的溶液浓度,应使称取的基准物的质量远大于所配制的溶液体积。ABC都不满足基准物的要求,只有D满足。因此答案为D光谱纯三氧化二铁。'
A:4 B:8 C:2 D:6
A:9.26 B:6.22 C:1.59 D:3.18
AI参考:单选题1.0 moI/L溶液的pH值是(B:6.22)。pH值是表示溶液酸碱度的一种方法,其数值通常由氢离子浓度确定,在标准温度下(通常为25℃),当氢离子浓度为10的负pH次方时,溶液为酸性,数值越小,酸性越强。在这个问题中,1.0 moI/L的溶液表示溶质中溶质的浓度为1mol/L,根据PH值公式PH = -lg[H+],其中[H+]表示氢离子浓度,因为1mol/L的溶液中氢离子浓度大约为10的负14次方mol/L(即1.0E-14mol/L),因此pH值为6。因此,选项B:6.22是正确的答案。'
A:1.06V B:0.86V C:1.44V D:0.68V
A: B:NaOH - 苯胺 C:HCl - 甲酸 D:NaOH - 甲胺
AI参考:正确答案是C:HCl - 甲酸。题目要求选择一个混合液能用中和法准确滴定,且浓度均为0.1mol/L。A选项中苯胺和NaOH无法用中和法准确滴定,因为苯胺和NaOH的反应不符合中和法的原则,B选项NaOH与苯胺的混合液可以发生酸碱中和反应,但由于苯胺过量且生成苯胺碱(离子),后续处理非常困难。C选项中HCl和甲酸的混合液符合中和法的原则,HCl与甲酸发生中和反应,反应物与生成物均显酸性或碱性,可滴定生成物以判断反应是否完全。D选项中NaOH与甲胺无法用中和法准确滴定,因为甲胺在碱性条件下会发生水解反应生成甲醇和氨气,无法准确判断反应是否完全。因此,只有C选项符合要求。'
A: B: C: D:
AI参考:答案:D:不需要络合物参与的反应,如取代反应、加成反应等。题目中给出的是络合物中的原子或基团,说明与反应中的其他原子或基团形成化学键。但是不需要络合物参与的反应类型(如取代反应、加成反应等)并不受此影响。因此,答案D不正确。'
A: B: C: D:
AI参考:答案是D。混合溶液的质子条件式是:0.10mol/LHCl + OH- = 0.20mol/LH2O + H+。这个质子条件式表明,溶液中的H+和OH-的数量必须相等,才能保持溶液的电中性。在这个特定的例子中,HCl和水的分子量相等,所以这个质子条件式也是可行的。A、B、C选项没有考虑HCl和水的分子量相等的情况,因此不正确。因此,正确答案是D。'
A: B: C: D:
A:3.0 B:4.7 C:6.2 D:7.7
AI参考:根据题目所给的信息,乙二胺(L)与络合物的pL值分别为4.7和7.7,而[AgL]的值介于两者之间。因此,可以推断出pL值应该接近于乙二胺(L)的pL值,即4.7。所以,正确答案是B:4.7。'
A:4.7 B:7.1 C:2.3 D:2.4
A: B: C: D:
A:标准偏差 B:全距 C:偏差 D:平均偏差
A:0.27V B:0.36V C:0.09V D:0.18V
A: B: C: D:
AI参考:答案为【C】。公式为S = (cKa)^0.5其中S表示溶质的溶解度,c为酸的浓度,Ka为酸的电离常数。此题主要考察弱酸盐在特定酸度和浓度下的溶解度计算。弱酸盐在水中的溶解度主要取决于酸的电离程度,即电离常数。电离常数越大,说明酸的电离程度越高,相应的盐的溶解度也越大。因此,根据公式S = (cKa)^0.5,可以得出答案为C。'
A:[M]=[L] B:M的副反应较小 C:M与L的副反应相当严重 D:M与L没有副反应
AI参考:单选题【单选题】
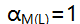 表示( )。答案:D:M与L没有副反应。解释:根据题目中的图片样式,可以看出它是一个图像标签,但并未给出任何关于M和L的副反应的信息,因此无法从图片中得出任何结论。所以选项D“M与L没有副反应”是正确的。选项A、B、C都无法从图片中得出。'
表示( )。答案:D:M与L没有副反应。解释:根据题目中的图片样式,可以看出它是一个图像标签,但并未给出任何关于M和L的副反应的信息,因此无法从图片中得出任何结论。所以选项D“M与L没有副反应”是正确的。选项A、B、C都无法从图片中得出。'A:滴定管最后一位估计不准 B:重量法测定硫时,加HCl过多 C:砝码受腐蚀 D:天平两臂不等长
AI参考:正确答案是A:滴定管最后一位估计不准。误差分为系统误差和偶然误差,系统误差是由某种固定的原因造成的,在相同条件下重复测定同一试样时,误差数值保持恒定;而偶然误差是由一些偶然的、不可预测的因素造成的,在相同条件下重复测定同一试样时,误差数值时大时小。选项中,滴定管最后一位估计不准属于偶然误差,因为滴定管本身存在一定的误差,只是这个误差是在一定的条件下出现的,并且数值较小,所以是偶然误差。因此,答案为A。其他选项中的问题属于系统误差或影响测量结果的其他因素,不属于偶然误差。'
A:在此区间内包括总体平均值的把握有95% B:若再作测定有95%将落入此区间内 C:总体平均值落入此区间的概率为95% D:在已测定的数据中有95%的数据在此区间内
AI参考:正确选项为C:总体平均值落入此区间的概率为95%。根据题目描述,置信度为95%,平均值的置信区间为35.21±0.10。这意味着在这个区间内,总体平均值的真实值有95%的可能性在其内。因此,总体平均值落入此区间的概率为95%。选项A和D描述的是包含总体平均值的把握程度,而选项B和D描述的是进一步测定的概率,与题目描述不符。因此,选项C是正确的。'
A:2.57 B:0.32 C:4.43 D:5.15
A:化学计量点前后0.1%的pH均减小 B:化学计量点前0.1%的pH减小,后0.1%的pH增大 C:化学计量点前0.1%的pH不变,后0.1%的pH增大 D:化学计量点前后0.1%的pH均增大
A:2:3 B:1:2 C:2:1 D:3:2
A:碱性 B:酸性 C:中性 D:不能确定其酸碱性
A: B: C: D:
A: B: C: D:
A: B: C: D:
A: B: C: D:
AI参考:正确答案是B:。这是一个正态分布图,通常用于描述数据分布的情况。正态分布曲线以平均值为中心,左右对称,曲线的宽度由标准差决定。因此,在正态分布图中,出现的概率是由平均值和标准差共同决定的。在这个图中,平均值为X=μ,标准差为σ,所以图中出现的概率为1减去标准正态分布函数的值,即P(X<μ)=1-Φ(−σ)。其中Φ()是标准正态分布函数。因此,答案为B:。'
A: B: C:NaOH D:
AI参考:正确答案是D:【硝酸银溶液】。本题考察混合离子的分离。题干中给出了三种图片形式的离子混合溶液,而题目要求分离其中的某种离子。通过分析可知,图片中的三种离子分别为氢离子、镁离子和铜离子,它们在弱酸性条件下会发生反应生成沉淀。因此,需要选择一种能够与氢离子反应生成沉淀的试剂,而硝酸银溶液恰好可以与氢离子反应生成白色沉淀。因此,答案为D。A选项的氢氧化钠溶液是用来与镁离子和铜离子反应生成沉淀的,而硝酸银溶液可以与氢离子反应生成白色沉淀,故不适合;B选项硫酸钡不能溶解在弱酸性溶液中,也无法作为分离氢离子的试剂;C选项是用于与铜离子反应生成蓝色沉淀的试剂,也不适合本题要求。因此,正确答案是D。'
A:直接滴定法 B:置换滴定法 C:回滴法 D:间接法
A: B: C: D:
A: B: C: D:
A:一定置信度下以真值为中心的可靠范围 B:一定置信度下以真值为中心包括测定平均值的区间 C:真值落在某一可靠区间的概率 D:一定置信度下以测定平均值为中心包括真值的范围
A:Q检验 B:F检验 C:检验 D:t检验
A:硅酸的溶解损失 B:加动物胶凝聚时的温度略有差别 C:称量样品时天平零点稍有变动 D:析出硅酸沉淀时酸度控制不一致
A: B: C: D:
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!


