吉林大学
- 元素基态原子的次外层电子数大于8,最外层仅有一个电子,该电子的四个量子数是n = 4, l = 0, m = 0, ms = +1/2,问:(1) 符合上述条件的元素有哪些? 原子序数各为多少?(6分) (2) 写出相应元素基态原子的电子排布式,并指出在周期表中所在周期、族、区。 (4分)
- 根据下列反应: H2+2AgCl==2H++2Cl-+2Ag 及其热力学常数,计算EӨ(Ag+/Ag)。已知该反应在25℃时的DrHmӨ = -80.80kJ·mol-1, DrSmӨ = -127.20 J·K-1·mol-1,F = 96485 C·mol-1,KspӨ(AgCl)=1.77×10-10。(保留到小数点后四位)
- 作为塑料使用时,要求Tg适当___(高/低)些;作为橡胶,Tg 越___越好,Tf越___越好。
- 0.4 mol·kg-1 HAc溶液中b(H+)是0.1mol·kg-1 HAc溶液中b(H+)的____倍。
- 对双原子分子来说,偶极矩可衡量其分子极性的大小和键的极性大小。( )
- 在ΔrGmӨ-T图中,直线位置越低,ΔrGmӨ越负,则反应速度越快。( )
- AgCl在NaCl溶液中的溶解度比在纯水中的溶解度小。( )
- ⅧB族元素的价电子层构型为(n-1)d6ns2。( )
- 系统经历一个循环,无论多少步骤,只要回到初始状态,其热力学能和焓的变化量均为零。( )
- 升高温度可增大反应速率,主要因为降低了活化能。( )
- 标准电极电势的数值越小,在标准状态下,其氧化型的氧化性越弱,其还原型的还原性越强。( )
- 正催化剂能降低反应活化能,增大正反应速率,同时减小逆反应速率。( )
- 不同化合物同种原子间化学键的键长越短,其键能越大,化学键也越稳定。( )
- 因为H原于中只有1个电子,故它只有1个轨道。( )
- 下列原子半径大小顺序中正确的是 ( )
- 适宜作为塑料的高聚物是 ( )
- 下列溶液不是缓冲溶液的是( )。
- 下列化学键中,哪些均不具有方向性和饱和性( )
- 一个气相反应mA(g) + nB(g) « qC(g),达到平衡时( )。
- 某元素基态原子失去3个电子后,l = 2的轨道半充满,其原子序数为( )
- 下列溶液混合不能组成缓冲溶液的是 ( )
- 下列分子或离子中不含孤电子对的是 ( )
- 已知Ni(en)32+的KƟ(稳) = 2.14×1018 ,将2.00 mol·L-1的en溶液与0.200 mol·L-1的NiSO4溶液等体积混合,则平衡时c(Ni2+) / (mol·L-1)为 ( )
- 下列分子中,属于非极性分子的是( )
- 某元素原子基态的电子构型为1s2 2s2 2p6 3s2 3p5,它在周期表中的位置是 ( )
- 下列电子排布属于激发态的是 ( )
- 下列关于氧化数的叙述正确的是 : ( )

- 反应4Al +3O2 + 6H2O = 4Al(OH)3(s),△GӨ=-nFEӨ中的n为( )。
- 熵减小的反应(或过程)是 ( )
- 催化剂的作用是通过改变反应历程来加快反应速率,这一作用主要是由于( )
- 在0.10 mol·L-1氨水中加入等体积的0.10 mol·L-1下列溶液后,使混合液的pH最大,则应加入( )
- 在氨水中加入NH4Cl后,氨水的溶解度α和pH值变化 ( )
- 升高温度,反应速率常数增加的主要原因是 ( )
- 在晶态高聚物中,其内部结构为: ( )
- Zn(OH)2的Ksp=1.8 ×10-5,其溶解度约为( )。
- pH = 14 时,水作氧化剂的半反应为()。
- 根据下列反应:2FeCl3 + Cu →2FeCl2 + CuCl2 2KMnO4 + 10FeSO4+ 8H2SO4 →2MnSO4+ 5Fe2(SO4)3+ K2SO4+ 8H2O2Fe3++ Fe →3Fe2+判断相应条件下电极电势最大的电对是 ( )
- 下列化合物中,键的极性最弱的是 ( )
- 下列分子中电偶极矩为零的是 ( )
- 反应A + B → C 为基元反应,该反应的速度常数的单位应当是 ( )
- 若[M(NH3)2]+的稳定常数KƟ(稳) = a,[M(CN)2]−的稳定常数KƟ(稳) = b,则反应[M(NH3)2]+ + 2CN− === [M(CN)2]− + 2NH3的平衡常数KƟ为 ( )
- 原子n = 2的电子层中的电子数目最多时为 ( )
- https://image.zhihuishu.com/zhs/teacherExam_h5/COMMONUEDITOR/202112/2ebef7fee1ca44eaa5549f0ac918f318.png
答案:(1) 符合条件的元素有:钾(K)、铜(Cu)、银(Ag)、金(Au)。原子序数分别为:19、29、47、79。 (2) 电子排布式及周期表位置: - 钾(K):[Ar] 4s^1,第四周期,IA族,s区。 - 铜(Cu):[Ar] 3d^10 4s^1,第四周期,IB族,ds区。 - 银(Ag):[Kr] 4d^10 5s^1,第五周期,IB族,ds区。 - 金(Au):[Xe] 4f^14 5d^10 6s^1,第六周期,IB族,ds区。
答案:0.2228V
答案:作为塑料使用时,要求Tg适当高些;作为橡胶,Tg越低越好,Tf越低越好。
答案:答案:B. 2倍
A:错 B:对
答案:对
A:错 B:对
答案:错
A:错 B:对
答案:对
A:对 B:错
答案:错
A:错 B:对
答案:对
A:对 B:错
A:对 B:错
A:错 B:对
A:对 B:错
A:错 B:对
A:Be<Mg<Na
B:I<Br<K
C:B<C<N
D:Be<Na<Mg
A:Tg较低的晶态高聚物
B:Tf较低的晶态高聚物
C:Tg较低的非晶态高聚物
D:Tg较高的非晶态高聚物
A:20cm3 0.l0mol·dm-3HCl和20cm3 0.l0mol·dm-3NH3混合 B:20cm3 0.l0mol·dm-3NaOH和20cm3 0.20mol·dm-3NH4Cl混合 C:300cm3 0.500mol·dm-3H3PO4和500cm3 0.500mol·dm-3NaOH混合 D:20cm3 0.20mol·dm-3HAc和20cm3 0.l0mol·dm-3NaOH混合
A:氢键和金属键 B:共价键和离子键 C:金属键和分子间作用力 D:配位键和离子键
A:反应商Q = 1 B:DrGmӨ = 0 C:反应商Q = KӨ D:反应物分压和等于产物分压和
A:25
B:26
C:27
D:24
A:HCl 和过量的氨水
B: NH3 和 NH4Cl C: H2PO4- 和 HPO42- D:氨水和过量的HCl
A: H3O+
B:H2O
C:NH3
D:NH4+
A:1.36×10-18 B:2.91×10-18 C:4.36×10-20 D: 1.36×10-19
A:ClO2 B:SO2 C:CO2
D:NO2
A:p区ⅥA族
B:s区ⅡA族
C:ds区ⅡB族
D:p区ⅦA族
A:1s22s22p63s23p6
B:1s22s22p4
C:1s22s22p3 D:1s22s22p63d1
A:氧化数在数值上与化合价相同。
B:氢在化合物中的氧化数皆为+1。
C:氧化数均为整数。
D:在单质中,元素的氧化数为零。
A: c(Fe3+)/ c( Fe2+)<1
B: c( Fe2+)<1 C:c(Fe3+)<1 D: c( Fe2+)/ c(Fe3+)<1
A:3 B:2 C:4 D:12
A: NaCl晶体从溶液中析出
B:固态I2的升华 C:CuSO4·5H2O晶体溶于水 D:反应C(s) + 1/2O2(g) = CO(g)
A:减小速率系数值
B:降低反应活化能
C:增大平衡常数
D:增大碰撞频率
A:H2SO4 B:HCl
C: HNO3 D:HAc
A:α减小,pH值增大
B:α和pH值都减小
C:α和pH值都增大
D:α增大,pH值减小
A:压力增加
B:活化分子百分数增加
C:混乱度增加
D:活化能增加
A:晶态与非晶态同时存在
B:不存在非晶态
C:只存在晶态
D:取向态结构
A:3.3 ×10-5 C.1.7 ×10-5 B:1.4 ×10-7 C:6.7 ×10-8
A:H2O + e- ⇌ 1/2H2 + OH-
A: MnO4-/Mn2+ B:Cu2+/Cu
C: Fe3+/Fe2+
D: Fe2+/Fe
A: AlCl3
B: SiCl4
C: PCl5
D: FeCl3
A:CO2
B: CH3Cl C:HCl
D:NH3
A: S-1
B: L·S-1
C:mol·L-1·S-1
D:mol-1·L·S-1
A:a+b
B:a/b
C:ab
D:b/a
A:10
B:32
C:6
D:8
A:
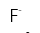
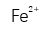
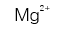
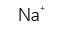
温馨提示支付 ¥5.00 元后可查看付费内容,请先翻页预览!

