第七章测试1.写出
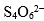 中S原子的氧化数( )。
中S原子的氧化数( )。A:
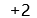 B:
B: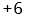 C:
C: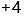 D:
D: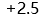
答案:D
2.方程式
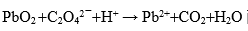 配平后的中,Pb的系数是( )。
配平后的中,Pb的系数是( )。A:2 B:1 C:3 D:4 3.
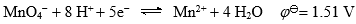 ,高锰酸钾是强氧化剂,因为它在反应中得的电子数多。( )
,高锰酸钾是强氧化剂,因为它在反应中得的电子数多。( )A:对 B:错 4.已知
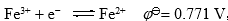 , 测定一个
, 测定一个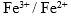 电极
电极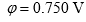 ,则溶液中必定是 ( )。
,则溶液中必定是 ( )。A:
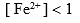 B:
B: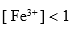 C:
C: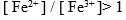 D:
D: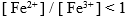 5.下列氧化剂中增加
5.下列氧化剂中增加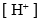 ,其氧化能力增强的物质是 ( )。
,其氧化能力增强的物质是 ( )。A:
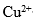 B:
B: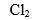 C:
C: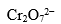 D:
D: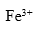 6.两个半电池,电极相同,电解后溶液中各物质相同,都可以进行电极反应,但溶液浓度不同,将两个半电池用盐桥和导线联接,这个电池的电动势( )
6.两个半电池,电极相同,电解后溶液中各物质相同,都可以进行电极反应,但溶液浓度不同,将两个半电池用盐桥和导线联接,这个电池的电动势( )A:
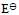 = 0,
= 0, 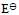 ≠ 0
B:
≠ 0
B: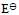 = 0,
= 0, 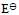 = 0
C:
= 0
C: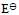 ≠0,
≠0, 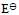 ≠ 0
D:
≠ 0
D: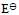 ≠0,
≠0, 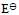 = 0
7.用两铅片分别插入两
= 0
7.用两铅片分别插入两 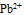 溶液中,做成电极I和II,分别得到电极电位:
溶液中,做成电极I和II,分别得到电极电位: 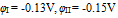 ,说明两溶液中
,说明两溶液中 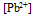 为( )
为( )A:II > I B:I > II C:无法判断 D:I = II 8.配平好下列反应:
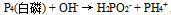 ,
,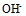 的系数是( )
的系数是( )A:3 B:4 C:2 D:1 9.已知在酸性介质中,
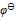
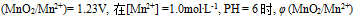 等于( )V
等于( )VA:0.52 B:0.71 C:1.94 D:1.23 10.将
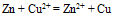 反应设计为原电池,若在铜半电池溶液中加入氨水后,则电池电动势E值将( )
反应设计为原电池,若在铜半电池溶液中加入氨水后,则电池电动势E值将( )A:增大 B:减小 C:不变 D:无法判断 11.下列哪一个反应设计出来的电池不需要用到惰性电极材料( )
A:
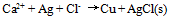 B:
B: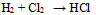 C:
C: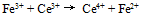 D:
D: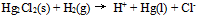 12.已知
12.已知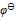
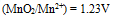 ,
, 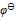
 , 从标准电极电势看,
, 从标准电极电势看, 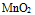 不能氧化
不能氧化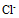 ,但用
,但用 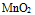 加浓盐酸,可以生成
加浓盐酸,可以生成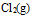 这是因为( )
这是因为( )A:
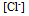 增加,
增加, 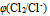 减小
B:(两个
减小
B:(两个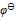 相差不太大 、酸度增加,
相差不太大 、酸度增加, 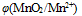 、
、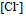 增加,
增加, 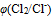 减小)三个因素都有
C:酸度增加,
减小)三个因素都有
C:酸度增加, 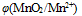 D:两个
D:两个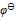 相差不太大
13.下列叙述中正确的是( )
相差不太大
13.下列叙述中正确的是( )A:已知
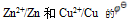 各为-0.762V和0.345V, 铜锌原电池的电动势之所以为1.105V, 原因在于
各为-0.762V和0.345V, 铜锌原电池的电动势之所以为1.105V, 原因在于 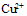 离子的浓度较
离子的浓度较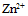 离子的大
B:含氧酸根的氧化能力通常随溶液的pH值减少而增强
C:因为电对
离子的大
B:含氧酸根的氧化能力通常随溶液的pH值减少而增强
C:因为电对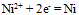 的
的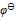 为-0.25v, 故
为-0.25v, 故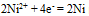 的
的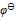 为-0.50v
D:因为
为-0.50v
D:因为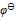
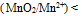
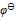
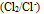 所以绝不能用
所以绝不能用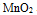 与盐酸作用制取
与盐酸作用制取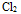 14.电对
14.电对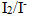 的
的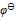 为0.534V,250C时,当
为0.534V,250C时,当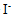 离子浓度为
离子浓度为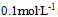 时的
时的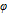 为( )
为( )A:0.471V B:0.593V C:0.534V D:0.650V 15.已知
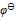
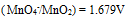 ,
, 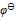
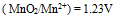 ,则
,则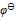
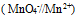 为( )
为( )A:1.499V B:1.825V C:0.635V D:1.70V 16.下列电对中,
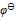 最大者是( )
最大者是( )A:
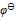
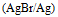 B:
B: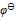
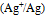 C:
C: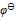
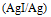 D:
D: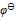
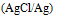 17.反应
17.反应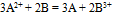 标准状态下电池电动势为1.80V,某浓度时,反应的电池电动势为1.60V,则此时该反应的lg
标准状态下电池电动势为1.80V,某浓度时,反应的电池电动势为1.60V,则此时该反应的lg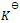 为( )
为( )A:
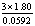 B:
B: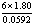 C:
C: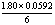 D:
D: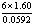 18.已知
18.已知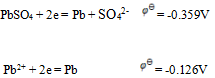 则
则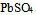 的溶度积为( )
的溶度积为( )A:
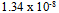 B:
B: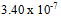 C:
C: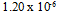 D:
D: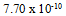 19.已知电极电势图:
19.已知电极电势图: 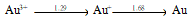 根据上列电势图可预测能自发进行的反应是( )
根据上列电势图可预测能自发进行的反应是( )A:
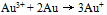 B:
B: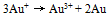 C:
C: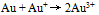 D:
D: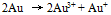 20.根据溴元素电势图:
20.根据溴元素电势图: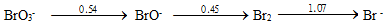 可求得
可求得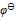 (BrO-/Br)为 ( )
(BrO-/Br)为 ( )A:0.364V B:0.728V C:0.76V D:1.52V 21.已知下列数据
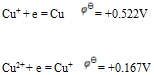 确定
确定 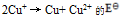 为( )
为( )A:–0.689V B:+0.355V C:+0.689V D:-0.355V 22.将反应Ni + Cu2+ = Ni2+ + Cu设计为原电池,下列哪一个为正确的电池符号? ( )
A:
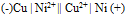 B:
B: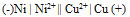 C:
C: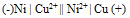 D:
D: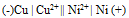 23.KMnO4与H2O2反应,可写出下列两个反应( )(1)2KMnO4 +H2O2 +3H2SO4 = 2MnSO4 + K2SO4 +3O2+4H2O(2)2KMnO4+5H2O2+3H2SO4 = 2MnSO4 + K2SO4 +5O2+4H2O
23.KMnO4与H2O2反应,可写出下列两个反应( )(1)2KMnO4 +H2O2 +3H2SO4 = 2MnSO4 + K2SO4 +3O2+4H2O(2)2KMnO4+5H2O2+3H2SO4 = 2MnSO4 + K2SO4 +5O2+4H2OA:(2)式对 B:(1)式对 C:两式都对 D:两式都不对 24.根据
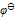 值判断下列各组离子在酸性介质中不能够共存的是( )
值判断下列各组离子在酸性介质中不能够共存的是( ) 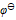 ( ClO3-/Cl-) =1.451V,
( ClO3-/Cl-) =1.451V, 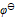 ( BrO3-/ Br2) =1.482V,
( BrO3-/ Br2) =1.482V, 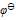 ( Fe3+/ Fe2+) = 0.771V,
( Fe3+/ Fe2+) = 0.771V, 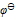 ( Pb2+/ Pb) = - 0.126 V,
( Pb2+/ Pb) = - 0.126 V, 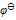 ( Sn4+/ Sn2+) =0.151V,
( Sn4+/ Sn2+) =0.151V, 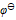 ( I2/ I-) = 0.54V
( I2/ I-) = 0.54VA:Fe2+ 和Pb2+ B:Fe2+ 和Sn4+ C:Br2和ClO3- D:Sn2+ 和I2 25.有三个电池
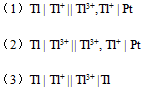 设这三个电池中各物质浓度都是
设这三个电池中各物质浓度都是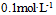 ,则它们的( )
,则它们的( )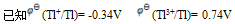
A:电池反应式相同,E不同 B:电池反应式不同,E不同 C:电池反应式相同,E相同 D:电池反应式不同,E相同 26.某溶液中含有
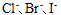 三种离子。要求只把
三种离子。要求只把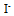 氧化出来而
氧化出来而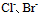 们留在溶液中,应选择哪种氧化剂( )。已知:
们留在溶液中,应选择哪种氧化剂( )。已知: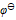
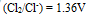 ,
,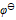
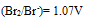 ,
,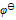
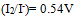
A:
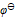
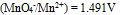 B:
B: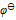
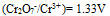 C:
C: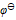
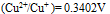 D:
D: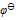
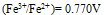
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!