第六章在标准条件下,下列反应均向正方向进行:Cr2O72- +6Fe2+ +14H+ = 2Cr3+ +6Fe3+ +7H2O2Fe3+ +Sn2+ = 2Fe2+ +Sn4+他们中间最强的氧化剂和最强的还原剂是()
Cr2O72-和Fe3+
Sn2+和Fe3+
Cr3+和Sn4+
答案:Cr2O72-和Sn2+
对于反应 Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,其ΔrGm=–nFE,式中n等于()25℃时,将铂丝插入含有Sn4+ 和Sn2+ 离子浓度分别为0.1和0.01mol·L-1 的溶液中,电对的电极电位为()
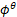 -0.0592/2
-0.0592/2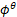 +0.0592
+0.0592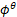 -0.0592已知MnO4-/Mn2+=1.49V,若其他物质均处于标态,当pH=2时,此电对的电极电位是
-0.0592已知MnO4-/Mn2+=1.49V,若其他物质均处于标态,当pH=2时,此电对的电极电位是1.39V
1.30V
1.03V
0.89V某氧化还原反应的标准电动势Eθ>0,则应有知原电池中两电极的标准电极电位值,就能判断该电池自发进行的方向。电池标准电动势越大,氧化还原能力越大,反应速率越快。标准电极电位和标准平衡常数一样,都与反应方程式的化学计量系数有关。两电对组成原电池,标准电极电位大的电对中的氧化型物质在电池反应中一定是氧化剂。往银电极中加入一定量的氯化钠,电极电位降低。
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!
