- 向AgCl的溶液中加入浓氨水,其溶解量会增大,但溶度积不变。
- 邻硝基苯酚的熔点小于对硝基苯酚,主要是由于对硝基苯酚中存在分子间氢键。
- 根据热力学第一定律,系统对外作功,必须从环境吸收热量
- H3PO4和NaOH混合可以配制3种不同缓冲对的缓冲溶液。
- 为了减小测定的相对误差,当吸光度读数太大时,可将溶液稀释或改用液层厚度较薄的吸收池。
- 向0.1mol·L-1H3PO4的溶液中加入NaOH固体,所得溶液一定为缓冲溶液。
- 在一定温度和压力下,某反应的标准摩尔吉布斯能变大于零,可选用合适的催化剂使反应正向进行
- 浓度愈大,吸光系数愈大。
- NH4Cl-NH3缓冲溶液中,若c(NH4+)>c(NH3),则该缓冲溶液的抗碱能力大于抗酸能力。
- 绝热不可逆过程的∆S < 0>
答案:错
- 反应H3PO4 + OH-=H2PO4- + H2O的平衡常数等于Ka1(H3PO3)。
- 缓冲溶液由共轭酸碱对组成,所以HAc与NaAc形成的溶液一定具有缓冲作用。
- 中心原子的配位数在数值上等于配位键的数目。
- 具有成对电子的原子轨道也可以进行杂化。
- 吸收光谱曲线的基本形状与溶液的浓度无关。
- 在同一短周期内由左至右,原子半径逐渐增大。
- 温度可同时改变正逆反应的速率常数。
- 配合物空间构型取决于中心原子所提供的杂化轨道的类型和数目。
- 在氢原子中,电子的能量与角量子数无关。
- 任何界面都存在表面能,分散度很大的纳米系统,其表面能很大。
- 吸光度偏离Lambert-Beer定律的原因有
- 下列关于沉淀平衡的叙述正确的是
- 空间构型为三角锥型的分子是
- 不能描述核外电子运动状态的量子数组合有
- 下列关于螯合物的说法,正确的是
- 在下列分子中,中心原子采用等性sp3杂化的是
- 下列各对溶液中,中间用半透膜隔开,水分子自左向右渗透的是
- 若第一个反应的速率常数k1大于第二个反应的速率常数k2,则这两个反应的活化能Ea1和Ea2的关系为
- 一级反应中,与反应时间t 成线性关系的是
- EDTA可提供的配位原子数为
- 下列有关缓冲溶液的叙述中,错误的是
- 下列各组溶液中,哪组不是缓冲溶液
- 已知pKa(HNO2)= 3.25,pKa(HClO)= 7.40,pKa(HAc)= 4.76,pKa(HCN)= 9.21,酸性最强的是
- 1mol液态水在373K,100kPa下分别经恒温可逆和向真空中蒸发为373K,100kPa下的水蒸气,这两个过程中的功和热的关系为
- 化学反应达到平衡时
- 某化学反应速率常数的单位为L·mol-1·s-1,该反应是
- 在H3PO4的水溶液中,下列哪种离子浓度近似等于H3PO4的 Ka2
- 人体血浆中主要的电解质离子有:Na+,K+,Mg2+,Ca2+,Cl-,HCO3-,HPO42-,SO42-等,其中的HCO3-属于
- 欲使半透膜隔开的两种稀溶液间不发生渗透现象,两溶液应满足下列哪一个条件
- 配合物一氯·一硝基·四氨合钴(Ⅲ)的化学式为
- 大分子溶液与溶胶有许多相似的性质,是因为
- 放热反应2NO+O2=2NO2达平衡后,若分别采取:①增加压力;②减少NO2的分压;③增加O2分压;④升高温度;⑤加入催化剂,能使平衡正向移动的是
- 分光光度法中,测定结果的相对误差与被测物浓度的关系是
- 聚沉AgI负溶胶所需电解质量最少的是
- 可使MgCO3的溶解度显著增加的是
- 分光光度法测量方法中,标准曲线法所测结果比标准对照法的更为准确可靠。
- 符合Lambert-Beer定律的有色溶液稀释时,其吸收光谱将·
- 摩尔吸光系数ε愈大,表明溶液对入射光越易吸收,测定的灵敏度越高。一般ε值在103以上即可进行分光光度法测定。
- 某一有色溶液浓度为c,测得透光率为T0,把浓度稀释至原来的1/2,在同样条件下测得的透光率应为·4
- 对于分光光度法,说法正确的是
- 影响吸光物质摩尔吸光系数大小的主要因素是··················
- 分光光度法中,若试样基体、显色剂和其他试剂均有颜色时,可选的空白溶液为
- 可见分光光度法只能测定有色溶液,对于无色溶液,必须加入显色剂与被测物质反应,生成稳定的有色物质后才能进行测定。
- 溶液中无干扰物质存在时,应选择最大吸收波长lmax的光作入射光进行分光光度法测定。
- 在分光光度法中,应用Lambert-Beer定律进行定量分析时,采用的入射光必须为·
- 螯合物的螯环数目越多,螯环越大,则螯合物越稳定。
- 由于配体大多为质子碱,提高溶液的pH值有利于增加配离子的稳定性。
- 可与中心原子形成两个或两个以上配位键的配体为多齿配体。


- 加入配位剂使沉淀溶解时,最有利于沉淀转化为配合物的条件是

- 下列配体中,能与中心原子形成螯合物的是

- 将含有1mol [Cr(H2O)5Cl]Cl2的溶液中加入足量AgNO3,所得AgCl沉淀的物质的量为
- 关于下列Co的配合物,内界为阴离子的是
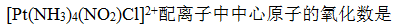
- 中心原子的配位数在数值上等于配体数。


- NH3和H2O分子中的中心原子均发生sp3杂化,但氧原子的2对孤对电子占据2个杂化轨道而产生更大的斥力,使O-H键键角小于氨分之中N-H键键角。
- 非极性分子中的化学键不一定是非极性键。
- C-C单键的键能是C≡C叁键键能的三分之一。
- π键电子云重叠程度较σ键大,所以π键比σ键稳定。
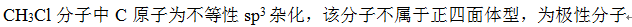
- s电子与s电子配对形成的键一定是σ键,p电子与p电子配对形成的键一定为π键。
- 键能与键长有关,通常是键越长,键能越大。
- 键能是同种键各级解离能的平均值。
- 配位键是通过成键原子中的一个单独提供电子对共用而形成的,所以配位键不属于共价键。
- 中心原子采用不等性sp3杂化的分子是
- 几何构型为直线形的是
- 中心原子采用sp2杂化的分子是
- σ键是原子轨道沿键轴方向以“头碰头”方式重叠形成的,原子轨道的重叠部分沿键轴呈圆柱形对称分布。
- 原子形成共价键的数目等于基态原子的未成对电子数。
- 在下列化合物中C原子采用sp杂化的是
- 分子之间色散力最大的是
- 分子之间同时存在色散力、诱导力、取向力的是
- 能形成分子内氢键的分子是
- 分子之间只存在色散力的是
- 下列元素的电负性大小顺序为
- 某元素中性基态原子的价电子组态为3s23p3,该元素属于
- 多电子原子中,能量最高的原子轨道是
- 原子的电子排布式中出现3d4,意思是3个d轨道中有4个电子。
- 电子云图中黑点越密集,表示在那里运动的电子越多。
- 中性基态原子的最后一个电子排在d轨道或s轨道上的,属于ds区。
- 只有当四个量子数组合合理时,才能确定电子的一种空间运动状态。
- 形状和伸展方向完全相同的原子轨道称为简并轨道。
- 将氢原子的1s电子激发至3s轨道或者3p轨道所需要的能量相等。
- s电子在一个球面上运动,而p电子在一个双球面上运动。
- 第三电子层(非最外层)最多可容纳的电子数为
- 原子轨道或波函数ψ可用来描述
- 基态Na原子(z = 11)最外层有一个电子,描述这个电子运动状态的四个量子数组合(n.l,m,s)是
- 下列描述原子核外某电子运动状态的量子数组合(n、l、m、s),其中错误的是
- 下图表示基态Fe原子的价电子组态,其中正确的是
- 29号元素Cu的基态电子组态为
- 决定氢原子轨道能量的量子数为
- 决定核外电子运动状态的量子数组合是
- 当n = 4时,l最大取值应当是
- 决定氧原子轨道能量的量子数为
- 在等电点时,蛋白质的粘度、渗透压、溶解度及稳定性最大。
- 某蛋白的等电点为4.6~4.9,将其置于pH值为6.5的缓冲溶液中,该蛋白质应该
- 大分子溶液既能使溶胶聚沉又能保护溶胶。
- 只有在比表面很大时才能明显地表现出界面现象,所以系统表面增大是表面张力产生的原因。
- 大分子溶液属于分子分散系,因此是热力学稳定体系。
- 只有超过临界胶束浓度,表面活性剂才有明显的增溶作用。
- 溶胶能在一定程度上稳定存在的最主要原因是
- 蛋白质完全溶于水所得分散系属于
- 将大分子电解质NaR的水溶液与纯水用半透膜隔开,达到Donnan平衡后,膜外水的pH值
- 对于Donnan平衡(膜平衡),下列哪种说法是正确的
- 水解法制备氢氧化铁溶胶,最易使其聚沉的电解质为
- 在KI溶液中加入稍过量的AgNO3溶液,得到的溶胶胶团结构可表示为
- Tyndall现象是光照射到粒子上发生下列哪种现象的结果
- 由10 mL 0.05 mol·L-1 KCl溶液与100 mL 0.002 mol·L-1 AgNO3溶液混合制备的AgCl溶胶,下列电解质的聚沉能力顺序为
- 直流电场作用于胶体溶液,向某一电极运动的是
- 对于AgI水溶液,以KI为稳定剂时胶团结构式为[(AgI)m·nI-(n﹣x)K+]x-·xk+,其中称为胶粒的是
- 溶胶与大分子溶液均属于
- 平衡后,由高处到低处,浓度逐渐增加的分散系是
- 区别溶胶和大分子溶液,最常用的简单方法是
- 用AgNO3与NaCl溶液反应制备AgCl溶胶,经实验测得溶胶带正电,则说明胶粒主要吸附
- 在难溶电解质的饱和溶液中,加入含有共同离子的另一种强电解质,可使难溶电解质的溶解度降低。
- AgCl水溶液的导电性很弱,所以AgCl为弱电解质。
- 溶液中有两种以上的离子可与同一试剂反应产生沉淀,首先析出的是离子积最先达到溶度积的化合物。

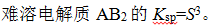
- 难溶强电解质M2X3加入水中,其溶解度为S,则溶度积为
- 定温下,Fe(OH)3在水中溶解平衡后,其溶度积常数Ksp与溶解度S(mol·L-1)的关系是
- AgBr在下列哪一溶液中溶解度最大
- Cu3(PO4)2沉淀的条件是
- 欲使CaCO3溶解,可在其溶液中加入
- 已知298K下Ksp(PbCl2)=1.6×10-5,则此温度下,饱和PbCl2溶液中c(Cl-)为
- 已知Ksp(AgCl)= 1.77×10-10,25℃时,在0.10mol·L-1的AgNO3溶液中AgCl的溶解度(mol·L-1)是
- 在已饱和的BaSO4溶液中,加入适量的NaCl,则BaSO4的溶解度
- 已知AgCl、AgBr、Ag2CrO4的Ksp分别为1.77×10-10、5.35×10-13、1.12×10-12,在一混合溶液中含有KCl、KBr、K2CrO4,其浓度均为0.01mol·L-1,向溶液中逐滴加入0.01mol·L-1AgNO3溶液时,最先和最后沉淀的物质是
- 一定范围内,难溶电解质AgCl的溶解度随溶液pH的减小而
- 下列各组溶液中,能以一定体积比组成缓冲溶液的是.
- 用H3PO4(pKa1=2.16,pKa2=7.21,pKa3=12.32)和NaOH所配成的pH=7.0的缓冲溶液中,抗酸成分是

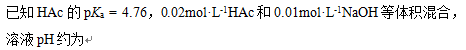
- 将浓度为c的氨水稀释一倍,溶液中的[OH-]为
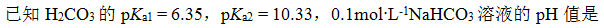
- 水中加入强酸,水解离出的氢离子和氢氧根离子浓度都减少,因此水的离子积减少。
- NaHCO3为两性物质,其酸常数Ka和碱常数Kb的乘积等于Kw。
- 缓冲溶液的缓冲范围与共轭酸的解离常数有关,与溶液pH关系不大。
- 下列各缓冲容量最大的是溶液
- 根据酸碱质子理论,下列物质只能作碱的是
- CH3NH2的共轭酸为
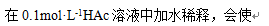
- 在373K时,pH = 7 的溶液属于
- 在0.1mol·L-1HCl和0.1mol·L-1HAc的混和溶液中,氢离子浓度为
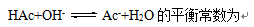
- 一元弱酸HA、HB、HC、HD的Ka依次减小,则同浓度的下列溶液pH最大的是
- 下面哪两种物质不属于共轭酸碱对
- 在NH3溶液中加入固体NH4Cl,溶液的pH
- 已知NH3的pKb = 4.75,则NH4+的酸常数pKa等于
- 将红细胞放置于NaCl水溶液中,于显微镜下观察出现溶血现象,则该NaCl溶液相对于红细胞内液来说是高渗溶液。
- 下列溶液中渗透浓度最低的是
- 难挥发性非电解质稀溶液的依数性主要取决于
- 质量浓度为10g·L-1KNO3(Mr=101)溶液、10g·L-1CaCl2(Mr=111)溶液和100g·L-1蔗糖(Mr=342)溶液,它们的渗透压大小顺序为
- 在临床上,当病人需要大剂量补液时,一般应选用
- 为阻止半透膜隔开的两种不同浓度的溶液间发生渗透现象,应在浓溶液液面上施加一额外压强,该压强等于
- 医学上的等渗溶液,其渗透浓度为
- 9.0g·L-1生理盐水的渗透浓度是
- 用合适的半透膜将不同浓度的两种水溶液隔开,则溶剂水分子的渗透方向是
- 以任意体积比混合生理盐水和50g·L-1葡萄糖溶液,将红细胞置于其中,则红细胞会
- 对于同一化学反应,反应速率及速率常数的大小与计算所选择的物质种类无关。
- 质量作用定律可以用于任何实际进行的反应,包括简单反应和复杂反应。
- 阿伦尼乌斯活化能Ea定义为活化分子所具有的能量。
- 在一定温度下,对于某化学反应,随着化学反应的进行,反应速率逐渐减慢,反应速率常数逐渐变小。
- 从反应速率常数的单位可以判断简单反应的反应级数。
- 已知反应2A+B = 产物,则其速率方程式
- 质量作用定律适用于
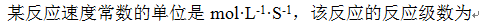
- 已知反应2NO(g)+Br2(g) = 2NOBr(g)为基元反应,一定温度下,当系统总体积扩大一倍时,正反应速率为原来的
- 某反应的速率常数k为0.0231mol-1×L×s-1,反应物初始浓度为1mol×L-1,则其半衰期为

- A反应的活化能为100kJ,B反应的活化能为500kJ,温度均由300K升至320K, A反应的速率增加倍数为a,B反应的速率增加倍数为b,则
- 一级、二级、零级反应的半衰期
- 反应A→B,实验测得反应物浓度与时间呈线性关系,则该反应的级数为
- 2A=B是二级反应,起始浓度为c0,速度常数为k,其t1/2应为
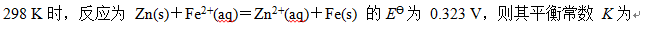
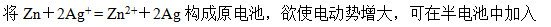
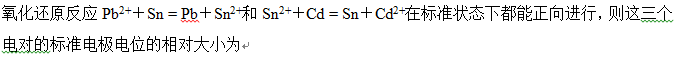
- 电极电位与电池电动势的大小与反应方程式的写法有关。
- 原电池的电动势越大,电池反应的速率越快。

- CH4中C与4个H形成四个共价键,因此C的氧化数是4。
- 根据KCl溶液浓度,常用甘汞电极分为饱和甘汞电极、摩尔甘汞和0.1mol·L-1甘汞电极。其电极反应为 Hg2Cl2(s)+2e=2Hg(l)+2Cl-(aq),设饱和甘汞电极、摩尔甘汞电极和0.1mol·L-1甘汞电极的电极电势分别为φ1、φ2、φ3,则室温下,三者的相对大小为
- 电极电位只取决于电极本身的性质,而与其他因素无关。
- 组成原电池的两个电对的电极电位相等时,电池反应处于平衡状态。
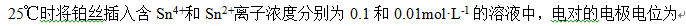
- 若其他物质均处于标准态,溶液pH由0变到5时,电极电位改变最大的是
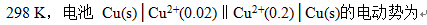

- 若电池电动势为负值,表示此电池反应的方向是
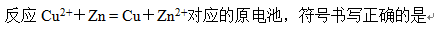
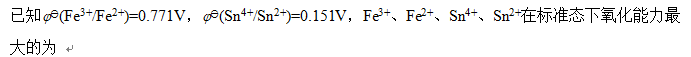
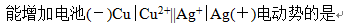
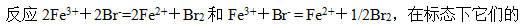

- SO2(g)+O2(g)=SO3(g)为放热反应,欲使反应向产物方向进行,应
- 系统与环境存在热交换时,系统的温度必定变化。
- 稳定单质的标准摩尔熵等于零。
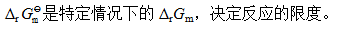
- 当ξ=1时,表示该反应已经进行完全。

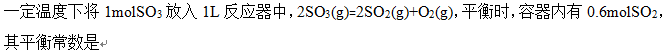
- 由于ΔH=Qp,ΔU=Qv,故Qp,Qv是状态函数。


- 利用S是否小于零判断过程方向,所适用的系统为( )
- CO2(g)的标准摩尔生成焓等于
- 化学反应的恒压热效应与恒容热效应之间关系是
- 在恒温恒压下,某一化学反应正向自发进行,一定是其
- N2 + 3H2 = 2NH3的反应进度 ξ = 1mol,表示系统中
- 只与参与反应的物质数量有关,而与反应方程式写法无关的是
- 下列参数中,属于广度性质状态函数的是
- 恒压过程中的“恒压”是指
- 显色剂的选择原则是显色剂的ε值愈大愈好。
- 比表面能是指恒温恒压下组成不变时可逆地增大单位表面积,系统所增加的吉布斯能,表面张力则是指表面单位长度上存在的表面紧缩力,因此,比表面能并不等于表面张力。
- HCl分子是直线形的,故Cl原子采用sp杂化轨道与H原子成键。
- 键能的大小与键的极性成正比。
- 根据Lambert-Beer定律,浓度增加一倍,吸收池厚度增加一倍,吸光度将变为原来的4倍。
- 渗透平衡时,膜两侧的渗透浓度一定相同。
- 平衡系统中,各物质的浓度(或分压)保持不变
- 影响显色反应的因素有显色剂的用量、溶液的酸碱度、显色时间和显色温度等。
- 表面活性物质是指浓度很小即可显著降低溶液表面张力的物质。
- 原子轨道沿键轴方向以“肩并肩”方式重叠形成的键为π键,π键的重叠部分垂直于键轴并呈镜面反对称分布。
- 电子排布式为1s22s22p23s1的原子虽然不稳定,但可以存在。
- 一定温度下,难溶强电解质的Ksp是常数。
- 用半透膜隔开两个不同浓度的溶液,一定会产生渗透现象。
- 金属元素的电负性一般小于2。
- 下列各组量子数中,可描述 p 电子运动状态的是
- 关于原电池,下列说法正确的是
- 酸度增加时,对配离子的稳定性影响较大的是
- 下列分子中,其中心原子采用不等性杂化的是
- 表面活性剂溶于水,将
- 若反应 A2+B2 = 2AB 的速率方程为 v = kcA2cB2,则此反应
- 若使HAc的离解度和溶液pH均减小,可向HAc溶液中加入
- 与缓冲容量有关的因素是
- 均由极性键组成的非极性分子是
- 丁铎尔现象的本质是胶体粒子对光的
- 有四种中性基态元素价电子层结构为 :① 2s22p5,② 4s24p5,③ 5s22p0, ④4s24p0,它们中电负性最大的是
- 下列难溶盐的饱和溶液中,Ag+浓度最大的是
- 水中加入Ca3(PO4)2,饱和时若c(Ca2+)=3.0×10-6mol·L-1,则c(PO43-)为
- HAc溶液中加入固体NaAc,溶液的pH
- 恒温过程中
- 某一化学反应,其活化能为Ea,设温度从300K升温至350K时,反应速率增加为原来的a倍,设温度从400K变到450K时反应速率增加为原来的b倍,a和b大小正确的是
- 恒温恒压且不作非体积功条件下的自发过程,属于
- 相同物质的量浓度的下列化合物的水溶液,pH最高的是
- 某反应完全所需时间为c0/k,该反应级数为
- 浓度为0.098 mol·L-1的Na2HPO4溶液为
- 下列关于血液的pH能保持基本不变,说法错误的是
- [Ag(S2O3)2]3- +2CN- = [Ag(CN)2]- + 2S2O32- 的平衡常数为
- 聚沉 AgI 负溶胶,聚沉能力最强的是
- 难溶电解质MA2的S = 1.0×10-3mol·L-1,其Ksp是
- 难溶物的溶解度不仅与难溶强电解质的本性有关,还与温度及溶液中共存的其它离子有关。
- 水的沸点大于硫化氢,归因于水分子间存在氢键。
- 其它因素一定时,吸光度值与测定波长成正比。
- 螯合物的螯环数目越多,螯合物的稳定性越强。
- 微观粒子均具有波粒二象性。
- 不发生化学反应的等渗溶液以任意体积比混合均可得到等渗溶液。
- 不可逆过程一定是自发的,自发过程一定是不可逆的
- 在进行显色反应时,所加显色剂的用量只要比理论计算量稍多一点即可。
- Cl2、Br2、I2与H2反应生成卤化氢的反应均可以写为H2+X2=2HX,因此,他们的反应级数应该是相同的。
- 两电对组成原电池,标准电极电位大的电对中的氧化态在电池反应中做氧化剂。
- Brown运动可以溶胶稳定,但加热可以使Brown运动加剧,反而会导致溶胶聚沉。
- 氢键具有方向性和饱和性,因此是化学键
- 质量作用定律适用于任意正向反应
- 两原子的单电子自旋方向相同时,可形成稳定的共价键。
- s电子在球内运动,p电子在双球内运动。
- 缓冲溶液中,其他条件相同时,缓冲对的pKa越接近缓冲溶液的pH时,缓冲容量越大。
- 物质由固体蒸发为气体时,其熵值增大。
- 摩尔吸光系数ε为
- 关于标准曲线法,下列说法正确的是
- 关于杂化轨道理论,下列说法正确的是
- 下列关于功、热和吉布斯能的说法,正确的是
- 某缓冲溶液的理论缓冲范围为5.30~7.30,则该缓冲溶液共轭酸的解离平衡常数为
- 1mol液体苯在298K时置于弹式量热计中(恒容)完全燃烧,生成水和二氧化碳气体,同时放热3264kJ.mol-1,则其恒压燃烧热为()kJ.mol-1
- 室温下,在电池Pt | H2(p) | H+(a=1) || CuSO4(0.01 mol·kg-1) | Cu(s)的右侧半电池中加入 0.01 mol·L-1 Na2S 溶液,则电池的电动势将
- 热力学第三定律规定
- 由H2PO4--HPO42- (H3PO4,pKa1= 2.12,pKa2= 7.21,pKa3= 12.32) 组成的缓冲溶液的理论缓冲范围
- 已知反应AB = A+B的速率常数k = 0.0693s-1,则当AB的浓度分别为0.1mol·L-1和1.0mol·L-1时,反应的半衰期分别为
- 研究表明,有相当一部分肾结石是由CaC2O4组成的,正常人每天排尿量约为1.4L,其中约含0.1g Ca2+,为了不使尿中形成CaC2O4沉淀,其中C2O42-离子的最高浓度为多少?[CaC2O4的Ksp = 2.3×10-9 , Mr(Ca) = 40)
- 在下列分子中,属于正三角构型的是
- 关于酸和碱,下列叙述错误的是
- 当n = 3时,l 可能的取值为
- 向某带负电的溶胶中加入下列电解质,其中聚沉能力最小的是
- 若反应 A+B=C 对 A、B 来说都是一级反应,下列说法正确的是
- SrCO3在下列哪种溶液中溶解度最大?
- 下列原子轨道中,可容纳电子数最多的是
- 与一般分子相比,配合物结构复杂,其命名要遵守一定次序,下列命名正确的是
- 在298.15K时,1 mol 理想气体由2 L恒温膨胀至4 L,系统则所做的最大体积功为
- 同一原子中,主量子数n为3的轨道最多可以填充18个电子。
- 电池 (1) 1/2H2(p1)+1/2Cl2(p2)=HCl (aq)和(2) H2(p1)+Cl2(p2)=2HCl(aq)的电动势分别为E1、E2,平衡常数分别为K1、K2,因E1= E2,所以有K1 = K2。
- 碘化氢的沸点比氯化氢的沸点高的原因是碘化氢的色散力强。
- 在乙醇分子中,只有σ键,没有π键。
- σ键电子云重叠程度大,比π键稳定。
- BCl3分子的极性小于BeCl2分子的极性。
- 可见分光光度法中,将有色溶液稀释可使显色溶液的吸收波长改变,但摩尔吸光系数不变。
- 弱酸溶液浓度越小,解离度越大,因此溶液中[H3O+]越大。
- 第一电子层上,有自旋相反的两个轨道。
- 从同一温度升温,其它条件不变的情况下,活化能越大的反应,反应速率增加得越快。
- 根据分子间作用力理论,Br2与H2O之间只存在色散力。
- 反应商 Q 大于平衡常数 K 时,反应逆向进行。
- 具有未成对电子的两个原子相互接近时都可以形成稳定的共价键。
- 有几个原子轨道参加杂化,就能形成几个杂化轨道。
- 氢电极的电极电位是0.0000V。
- 3s轨道,其中的3意味是3个原子轨道。
- 根据质子酸碱的定义和酸碱反应实质,叙述正确的是
- 已知FeO(s)+C(s)=CO(g)+Fe(s)为吸热熵增反应,欲使反应正向进行,应采取的措施为
- 溶胶与大分子溶液的区别是
- 已知氢电极(H+ | H2(100kPa) | Pt)的电极电位为-0.05916V,则[H+]应为
- 可见光的波长范围
- 一定温度下,NH4HCO3(s)= NH3(g)+H2O(g)+CO2(g),设在两个体积相等的密闭容器a和b中,分别加入纯NH4HCO3(s) 1kg及20kg,298.15K达到平衡后,下列哪种说法正确的是
- 反应(1)2H2(g) + O2(g)=2H2O 和(2)H2(g) + 1/2O2(g)=H2O,用这两种不同的表示式算出的E、ΔrGm 和K 的关系是
- 下列基态离子中,外层 d 轨道达半充满状态的是
- 已知298.15K时,Ag2CrO4的溶度积常数为1.12×10-12,在0.1mol·L-1AgNO3溶液中铬酸根离子的浓度为
- 对As2S3负溶胶,MgCl2的聚沉能力比K2SO4
- 用明矾净水,主要是利用的是
- 25℃时,向pH=4 的醋酸溶液中,加入少量碱,该酸常数会发生如何变化
- 已知Ca(OH)2(Ksp=5.02×10-6),Mg(OH)2(Ksp=5.61×10-11),AgCl(Ksp=1.77×10-10),下列说法正确的是
- 已知在BaCO3的饱和溶液中,c(Ba2+)=5.08×10-5mol·L-1,c(CO32-)= 5.08×10-5 mol·L-1,则BaCO3的Ksp为
- 两溶液 pH 明显不同的是
- 已知反应2NO(g+O2(g)=2NO2(g)是基元反应,则v(NO)等于
- 价电子组态为3d64s0的元素,可能是
- 决定波函数的形状,并在多电子原子中决定电子能量的量子数是
答案:对
答案:对
答案:错
答案:对
答案:对
答案:错
答案:错
答案:错
答案:对
答案:错
温馨提示支付 ¥5.00 元后可查看付费内容,请先翻页预览!
