第九章测试1.在用离子-电子法配平酸性介质半反应方程式时,方程式左边多了n个O ,应在方程式左边加上n个H+。( )
A:对 B:错
答案:B
2.电对的氧化型和还原型都生成沉淀,如氧化型的溶解度比还原型小,则电极电势变小。( )
A:错 B:对 3.氧化还原反应平衡常数的大小与其反应所组成原电池正、负极的电极电势差值有关,差值越大,平衡常数越小。( )
A:错 B:对 4.在有H+参与的氧化还原反应中,如果两个电极的标准电极电势相差不大,适当改变酸度,可能改变反应的方向。( )
A:错 B:对 5.在反应H3AsO4 + Zn + HNO3 → AsH3 + Zn (NO3 )2 + H2O 中,下列说法错误的是( )
A:还原剂是Zn ,得到电子
B:被氧化的物质是Zn
C:氧化剂是H3AsO4
D:被还原的物质是H3AsO4
6.用离子电子法配平碱性介质中的反应式:Cl2 + NaOH → NaCl + NaClO3,则( )
A:配平的氧化半反应为:Cl2 + 12OH- - 10e- →2ClO3- + 6H2O
B:在多O的一边加2倍OH-以平衡质量守恒
C:在少O的一边加同倍OH-以平衡质量守恒
D:配平的还原半反应为:Cl + e-→Cl-
7.将银和硝酸银溶液组成的半电池与锌和硝酸锌溶液组成的半电池通过盐桥构成原电池,该电池符号是( )
A:(-) Zn | Zn (NO3 )2 (aq)|| AgNO3 (aq) | Ag (+)
B:(-) Ag,AgNO3 (aq) || Zn (NO3 )2 (aq) | Zn (+)
C:(-) Ag | AgNO3 (aq) || Zn (NO3 )2 (aq) | Zn (+)
D:(-) Ag | AgNO3 (aq)|| Zn (NO3 )2 (aq) | Zn (+)
8.已知EΘ(Cr2O72-/Cr3+)>EΘ(Fe3+/Fe2+)>EΘ(Cu2+/Cu)>EΘ(Fe2+/Fe),则上述诸电对的各物种中最强的氧化剂和最强的还原剂分别为( )。
A:Cr2O72-,Fe
B:Fe3+,Cu
C:Cr2O72-,Fe2+
D:Cu2+,Fe2+
9.已知:Eө(Zn2+/Zn) =-0.763 V, Eө (Cu2+/Cu) =0.337 V ,则此 Zn|Zn2+(0.5mol•L-1)
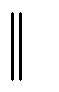 Cu2+(0.1mol•L-1)|Cu原电池的电动势为( )
Cu2+(0.1mol•L-1)|Cu原电池的电动势为( )A:1.08 V
B:1.109 V
C:1.071 V
D:1.100 V
10.已知Eө(Ag+/Ag)=0.799V,Kspө(AgBr)=5.010-13。Eө([Ag(S2O3)2]3-/Ag)=0.017V,则[Ag(S2O3)2]3-的稳定常数Kfө为( )
A:7.62 * 1014
B:7.62 * 1012
C:1.62 * 1013
D:1.62 * 1012
11.根据电势图
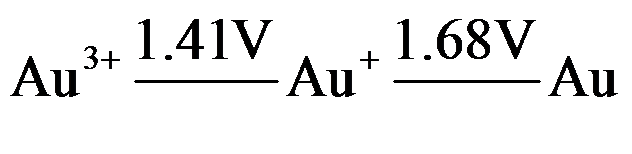 判断能自发进行反应的是 ( )
判断能自发进行反应的是 ( )A:Au3+ + 2Au → 3Au+
B:2Au → Au+ + Au3+
C:Au + Au+ → 2Au3+
D:3Au+ → Au3+ + 2Au
12.已知钒元素的电势图及下列各电对的Eθ值:
V(V)1.00VV(Ⅳ)0.31V V(Ⅲ)-0.255V V(Ⅱ)
Eθ(Zn2+ / Zn)=-0.763V Eθ(Sn4+ / Sn2+)=0.154V;
Eθ(Fe3+ / Fe2+)=0.771V Eθ(Fe2+ / Fe)=-0.44V;
欲将V(V)只还原到V(Ⅳ),下列还原剂中合适的是( )
A:Zn
B:Fe2+
C:Sn2+
D:Fe
温馨提示支付 ¥4.99 元后可查看付费内容,请先翻页预览!