第七章测试1.弱酸溶液越稀,其解离度越大,所以溶液中的H+浓度越大。( )
A:错 B:对
答案:A
2.根据质子理论,凡是给出质子的物质是碱,凡是接受质子的是酸。( )
A:错 B:对 3.把pH=3和pH=5的两稀酸溶液等体积混合后,混合液的pH值应等于4。 ( )
A:错 B:对 4.可以利用同离子效应来控制某些酸根离子的浓度,从而达到分离某些混合离子的目的。( )
A:对 B:错 5.按照酸碱质子理论,下列物质中即可作为酸又可以作为碱的是( )。
A:HCO3-
B:PO43-
C:S2-
D:〔Al(H2O)6〕3+
6.计算NH4Ac的溶液中H+浓度的最简式为( )
A:
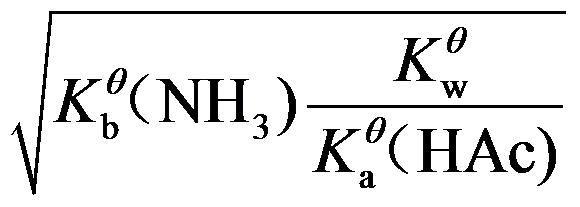
B:
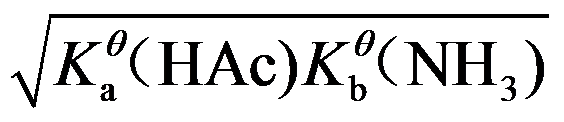
C:
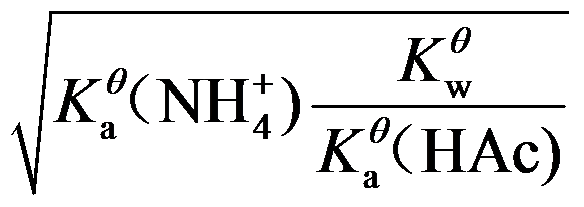
D:
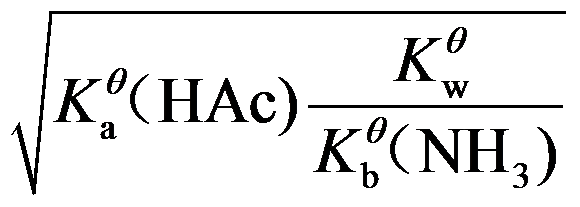
7.已知:Kaθ(HAc)=1.75×10-5, Kaθ(HCN)=6.2×10-10, Kaθ(HF)=6.6×10-4, Kbθ(NH3·H2O)=1.8×10-5。下列溶液的浓度均为0.1 mol·L-1,其溶液pH按由大到小的顺序排列正确的是( )
A:NaF>NaAc>NaCN>NaCl>NH4Cl
B:NaCN>NaAc>NaF>NaCl>NH4Cl
C:NaAc>NaCN>NaF>NaCl>NH4Cl
D:NH4Cl>NaCl>NaF>NaAc>NaCN
8.已知Ka1Ө(H2S) =1.1×10-7 ,Ka2Ө (H2S) = 1.3 ×10-13,在0.10 mol·L-1的HCl溶液中通入H2S至饱和,则溶液中S2-的浓度为( )
A:1.4×10-19
B:1.4×10-17
C:1.4×10-20
D:1.4×10-18
9.在酸碱滴定中,选择指示剂可不必考虑的因素是( )
A:指示剂的变色范围
B:指示剂的颜色变化
C:指示剂的分子结构
D:pH突跃范围
10.下列能做缓冲溶液的是:( )
A:0mL 0.1mol·L-1 HAc和30mL 0.1mol·L-1 HCl混合液
B:60ml 0.1mol·L-1 HAc和30mL 0.2mol·L-1 NaOH混合液
C:60ml 0.1mol·L-1 HAc和30ml 0.1mol·L-1 NaOH混合液
D:60mL 0.1mol·L-1 NaCl和30mL 0.1mol·L-1 NH4Cl混合液
11.将50.0mL0.100mol.L-1(NH4)2SO4溶液,加入到50.0mL 0.200mol.L-1 NH3·H2O溶液中,得到的缓冲溶液pH值是(Kbө(NH3·H2O)=1.8×10-5)( )
A:9.26
B:9.00
C:9.56
D:8.70
12.已知HAc的pKa=4.74,则在pH=4时,HAc和Ac-的分布分数分别为( )
A:0.85 和0.15
B:0.25 和0.75
C:0.15 和0.85
D:0.75 和0.25
温馨提示支付 ¥4.99 元后可查看付费内容,请先翻页预览!