第八章 氧化还原平衡:氧化还原反应的基本概念及用离子电子法配平氧化还原方程式;原电池的有关概念;电极电势的概念,影响电极电势的因素,能用能斯特方程式作有关计算;电极电势的应用,能判断氧化剂、还原剂的强弱,氧化还原反应可能进行的方向和限度等;了解元素电势图及其应用。8.1氧化还原反应的基本概念:氧化还原反应的基本概念[判断题]
8.2氧化还原反应方程式的配平:用离子电子法配平氧化还原方程式
8.3原电池与电极电势:原电池和电极电势的有关概念;影响电极电势的因素,用能斯特方程式求算电极电势;掌握电极电势的应用,能判断氧化剂、还原剂的强弱,氧化还原反应可能进行的方向和限度等
8.4元素电势图及其应用:元素电势图及其应用
已知Cu++e-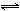 Cu E
Cu E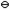 =+0.515V
=+0.515V
Cu2++e-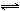 Cu+ E
Cu+ E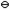 =+0.159V
=+0.159V
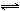 Cu2++Cu的E
Cu2++Cu的E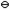 =+0.356V。选项:[错, 对]
=+0.356V。选项:[错, 对] [判断题]根据电势图ClO3-
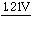 HClO2
HClO2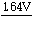 HClO
HClO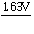 Cl2可知,能发生歧化反应的物质只有HClO。选项:[错, 对]
Cl2可知,能发生歧化反应的物质只有HClO。选项:[错, 对][判断题]2CCl4+CrO42-®2COCl2+CrO2Cl2+2Cl-,这是一个氧化还原反应。选项:[对, 错]
[判断题]已知:E
 (Pb2+/Pb)=-0.126V,E
(Pb2+/Pb)=-0.126V,E (Cu2+/Cu)=0.337V,则反应Cu+Pb2+
(Cu2+/Cu)=0.337V,则反应Cu+Pb2+ Pb+Cu2+能向左进行。选项:[错, 对]
Pb+Cu2+能向左进行。选项:[错, 对][单选题]已知E
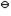 (H3AsO4/H3AsO3)=0.58V,E
(H3AsO4/H3AsO3)=0.58V,E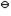 (I2/I-)=0.54V,关于反应H3AsO3+I2+H2O
(I2/I-)=0.54V,关于反应H3AsO3+I2+H2O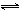 H3AsO4+2I-+2H+的下列叙述中,错误的是( )。选项:[该反应的E
H3AsO4+2I-+2H+的下列叙述中,错误的是( )。选项:[该反应的E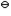 =-0.04V很小,因此,在任何条件下正反应不可能自发进行, 溶液的pH值改变,反应进行的方向会发生改变, 溶液的pH值增大,As(Ⅴ)的氧化性减弱, 标准状态下,正反应不能自发进行]
=-0.04V很小,因此,在任何条件下正反应不可能自发进行, 溶液的pH值改变,反应进行的方向会发生改变, 溶液的pH值增大,As(Ⅴ)的氧化性减弱, 标准状态下,正反应不能自发进行]
温馨提示支付 ¥1.00 元后可查看付费内容,请先翻页预览!

