提示:内容已经过期谨慎付费,点击上方查看最新答案
无机化学(东北林业大学)
已知E
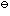 (Fe3+/Fe2+)=0.771V,E
(Fe3+/Fe2+)=0.771V,E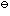 ([Fe(CN)6]3-/[Fe(CN)6]4-)=0.36V。
([Fe(CN)6]3-/[Fe(CN)6]4-)=0.36V。
则lg[K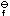 ([Fe(CN)6]3-)/K
([Fe(CN)6]3-)/K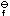 ([Fe(CN)6]4-)]的值是( )。
([Fe(CN)6]4-)]的值是( )。下列各组原子或离子半径大小顺序,其中错误的是( )。
下列化合物的水溶液呈碱性的是( )。
某温度时,反应Br2(g)+H2(g)
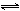 2HBr(g)的K
2HBr(g)的K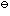 =a,则反应HBr(g)
=a,则反应HBr(g)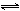
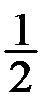 Br2(g)+
Br2(g)+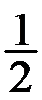 H2(g)的K
H2(g)的K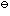 =( )。
=( )。欲使CaCO3在水溶液中的溶解度增大,宜采用的方法是( )。
关于pz原子轨道角度分布图与电子云角度分布图,下列叙述中错误的是( )。
380K时,Ag2CO3(s)
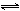 Ag2O(s)+CO2(g)的K
Ag2O(s)+CO2(g)的K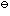 =9.51×10-3,将Ag2CO3固体放入烘箱中于380K下干燥。为防止其分解通入含有CO2的空气保护,空气中CO2的体积分数应不低于( )。
=9.51×10-3,将Ag2CO3固体放入烘箱中于380K下干燥。为防止其分解通入含有CO2的空气保护,空气中CO2的体积分数应不低于( )。反应:MnO4-+8H++5Fe2+
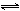 Mn2++4H2O+5Fe3+达到平衡时,下列等式中正确的是( )。
Mn2++4H2O+5Fe3+达到平衡时,下列等式中正确的是( )。- 某元素的原子序数是48,它在周期表中属于( )。
已知某元素+2价离子的外层电子排布是3s23p63d4,则该元素的价电子构型和族数是( )。
将浓度均为0.1mol·L-1的下述溶液稀释一倍,其pH值基本不变的是( )。
- 化学反应达到平衡的标志是( )。
按照分子轨道理论,N2+中电子占有的能量最高的轨道是( )。
已知[Zn(NH3)4]2+的K
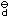 =3.47´10-10。在其溶液中c(NH3)=2.0mol·L-1时,则
=3.47´10-10。在其溶液中c(NH3)=2.0mol·L-1时,则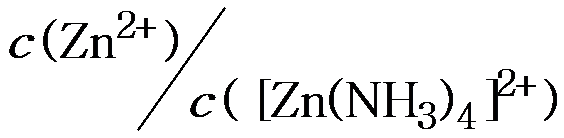 的值为( )。
的值为( )。已知C(s)+
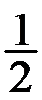 O2(g)→CO(g)的△r
O2(g)→CO(g)的△r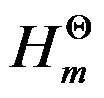 =-110.5kJ·mol-1,C(s)+O2(g)→CO2(g)的
=-110.5kJ·mol-1,C(s)+O2(g)→CO2(g)的
△r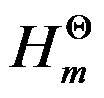 =-393.5kJ·mol-1,则CO(s)+
=-393.5kJ·mol-1,则CO(s)+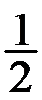 O2(g)→CO2(g)的△r
O2(g)→CO2(g)的△r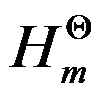 =( )。
=( )。- 某元素原子仅有的2个价电子填充在n=4,l=0亚层上,则该元素的原子序数为( )。
用价层电子对互斥理论推测SnCl2的几何形状为( )。
配合物Cu2[SiF6]的正确名称是( )。
- 下列关于催化剂的叙述中,错误的是( )。
下列各组配离子中,晶体场稳定化能均为零的一组是( )。
- 已知某化学反应是放热反应,如果升高温度,则对反应的反应速率系数k和标准平衡常数K
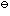 的影响是( )。
的影响是( )。 要使100mL0.10mol·L-1H2SO4溶液的pH=7.00,需加入NaOH固体的物质的量为( )。
下列反应中属于非氧化还原反应的是( )。
反应:2CO(g)+O2(g)
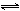 2CO2(g)(DrHm<0),在一定条件处于平衡状态。下列叙述中正确的是( )。
2CO2(g)(DrHm<0),在一定条件处于平衡状态。下列叙述中正确的是( )。可逆反应:Cl2(g)+H2O(g)
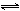 2HCl+
2HCl+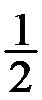 O2(g)(DrHm>0),在一定条件下达到平衡。下列叙述中,正确的是( )。
O2(g)(DrHm>0),在一定条件下达到平衡。下列叙述中,正确的是( )。- 内轨型配合物往往比外轨型配合物稳定,螯合物比简单配合物稳定,则螯合物必定是内轨型配合物。( )
- 当可逆反应达到平衡时,各反应物和生成物的浓度一定相等。( )
- 溶度积规则的实质是沉淀反应的反应商判据。( )
- 对同一配离子而言,相同温度时应有K
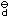 =1/K
=1/K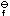 。 ( )
。 ( )
答案:对 - 难溶电解质的K
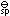 是温度和离子浓度的函数。( )
是温度和离子浓度的函数。( ) - 由于水分子间存在氢键,所以水的沸点比同族元素氢化物的沸点高。( )
- 气体膨胀或被压缩所做的体积功是状态函数。( )
标准态下,通常多数稳定单质的△fG
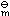 =0kJ·mol-1、△fH
=0kJ·mol-1、△fH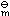 =0kJ·mol-1。
=0kJ·mol-1。晶体场理论认为,在八面体配合物中,中心离子五重简并的d轨道受配体的排斥作用,将分裂成能量不同的两组,一组为能量较高的dr(eg)轨道,一组为能量较低的de(t2g)轨道。
E
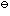 (PbO2/Pb2+)>E
(PbO2/Pb2+)>E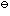 (PbO2/PbSO4)。
(PbO2/PbSO4)。- 价键理论认为,所有中心离子(或原子)都既能形成内轨型配合物,又能形成外轨型配合物。( )
- 系统的焓等于系统的热量。( )
- 对任何有气体参与的反应,体积缩小,平衡一定向分子总数减小的方向移动。( )
- 所有反应的速率都随时间而改变。( )
含有N2和H2的混合气体中,N2的分体积V(N2)=n(N2)RT/p(总)。( )
A:-13.9 B:-6.94 C:13.9 D:6.94
答案:0.36
A:Na+>Mg2+>Al3+ B:Ne>N3->Br- C:Ca2+
答案:2++2-
A:NH4NO3 B:Na3PO4 C:MgCl2 D:CaCl2
答案:NaNO2;
A:a1/2 B:()1/2 C:a D:1/a
答案:0.2
A:加入1.0mol·L-1CaCl2 B:加入0.1mol·L-1edta C:加入1.0mol·L-1Na2CO3 D:加入2.0mol·L-1NaOH
答案:. 加入0.1 mol·L-1 EDTA
A:前者有正、负,后者全为正(习惯上不标出+) B:前者值小,后者值大 C:前者“胖些”,后者“瘦些” D:前者为“双球形”,后者为“双纺锤”形
A:0.5% B:2% C:1% D:0.7%
AI参考:正确答案是C:1%。根据题目中的化学平衡方程式,可以得出K的值为9.51×10⁻³,已知初始物质的量比为$2AgCO_3:Ag_2O$,温度为380K时,且该温度下K的值与浓度成反比。设空气中有$x\\%$的$CO_{2}$,则$CO_{2}$的体积分数为$x\\% \times 22.4/380$。根据题目要求,为了防止$Ag_{2}CO_{3}$分解,空气中的$CO_{2}$体积分数应不低于某个数值。而K值是和浓度成反比的,浓度越高K值越小,因此只需要求出高于给定浓度$CO_{2}$的体积分数对应的浓度,就是空气中的$CO_{2}$体积分数应不低于的数值。根据题目中的初始物质的量比和$K$值,可以列出如下方程式:$(2AgCO_3 \rightleftharpoons Ag_2O + CO_2) \times K = (CO_2) \times 9.51 \times 10^{- 3}$带入已知条件,可得:$(x\\% \times 22.4/380) \times 9.51 \times 10^{- 3} = (CO_2) \times 9.51 \times 10^{- 3}$化简可得:$x\\% = 1\\%$因此,空气中$CO_{2}$的体积分数应不低于$1\\%$。答案为C。'
A:E(MnO4-/Mn2+)-E(Fe3+/Fe2+)=0V B:E(MnO4-/Mn2+)-E(Fe3+/Fe2+)=0V C:E(MnO4-/Mn2+)-E(Fe3+/Fe2+)=0V D:E(MnO4-/Mn2+)-5E(Fe3+/Fe2+)=0V
AI参考:正确答案是:D:E(MnO4-/Mn2+)-5E(Fe3+/Fe2+)=0V。该反应中,根据能斯特方程,可以得到:E(MnO4-/Mn2+)=E(MnO4-/Mn2+)(标准) + RT/nF × ln[(c(MnO4-)×c(H+))^(n-1)/c(MnO4-)],E(Fe3+/Fe2+) = E(Fe3+/Fe2+)(标准) + RT/nF × ln[c(Fe3+)],二者相减即可得到E(MnO4-/Mn2+) - E(Fe3+/Fe2+) = Eθ(MnO4-/Mn2+) - Eθ(Fe3+/Fe2) + RT/nF × ln(H+) c(MnO4-) c(H+)n。选项中D选项等式右边的化学计量数全部正确,即上述计算中[c(H+)n],得到选项D是正确的。因此本题选D。'
A:p区 B:d区 C:ds区 D:s区
AI参考:正确答案是D:s区。元素周期表中分为s区、p区、d区、ds区等,其中s区包含元素族元素,该元素的原子序数是48,说明其属于s区元素。因此,本题的正确答案是D。'
A:3d64s2Ⅷ B:3d44s2ⅥB C:3d54s1ⅥB D:3d64s1Ⅷ
AI参考:正确答案是D:3d64s1Ⅷ。该元素为钪元素,其价电子构型为3d64s1,属于Ⅷ族元素。因此,正确选项为D。'
A:NaF B:(NH4)2SO4 C:NH4Cl D:NH4Ac
AI参考:答案选D。因为铵根离子水解显酸性,所以氯化铵溶液显酸性,稀释一倍后,铵根离子浓度减半,水解程度也减半,所以氢离子浓度基本不变。所以选项D是正确的。而选项A、B、C都有可能改变溶液的pH值。A.氟化钠水解显碱性,稀释后碱性减弱;B.硫酸铵溶液中铵根离子水解显酸性,稀释后酸性减弱;C.氯化铵溶液中铵根离子水解显酸性,稀释后酸性减弱;因此,只有D选项中的铵盐在稀释后pH值基本不变。'
A:各反应物和生成物的浓度等于常数 B:各物质浓度不再随时间而改变 C:正逆反应的速率系数相等 D:各反应物和生成物的浓度相等
AI参考:正确答案是B:各物质浓度不再随时间而改变。化学反应达到平衡的标志是各物质浓度不再随时间而改变,因此选项B是正确答案。其他选项中,A、C、D都是判断化学反应是否处于动态平衡的方法,但并非是平衡的唯一标志。化学平衡的判断方法需要考虑具体反应的特征,需要根据具体的化学反应条件、平衡条件和概念理解来综合判断。因此,只有在掌握了相关化学知识和理论体系的情况下,才能准确地做出判断。'
A:p2p B:s2p* C:p2p* D:s2p
AI参考:正确答案是B:s2p*。按照分子轨道理论,氮气离子中电子占有的能量最高的轨道是能量最低的轨道,即s2p*轨道。因此,答案为B。'
A:8.7´10-11 B:5.6´10-9 C:1.7´10-10 D:2.2´10-11
AI参考:根据题目中的信息,已知[Zn(NH3)4]2+的K=3.47×10-10,在该溶液中c(NH3) = 2.0mol/L时,需要求的是[Zn(NH3)4]2+的稳定性。根据盐的稳定性常数与离子浓度的关系,该稳定性常数与离子浓度的关系为K = c(盐)×c(配离子)。因此,所需的值为[Zn(NH3)4]2+的稳定性常数与已知的NH3浓度的乘积,即3.47×10-10 × 2.0mol/L = 6.94×10-10。因此,正确答案是C:1.7´10-10。'
A:283.0kJ·mol-1 B:-504.0kJ·mol-1 C:-283.0kJ·mol-1 D:-110.5kJ·mol-1
AI参考:根据题目描述,已知两个反应的反应热分别为-110.5kJ/mol和-393.5kJ/mol。由于反应热是反应物总键能与生成物总键能之差,即ΔH=ΣE(反应物)-ΣE(生成物),所以CO(s)+O2(g) → CO2(g)的反应热应该是上述两个反应热之和再减去反应中消耗的碳与氧气分子的数目的能量(1C + 2O = CO),也就是ΣE(反应物)(所有物质)-ΣE(生成物)(生成物C+O)=(2C-1CO)+(-393.5+1C)=-283.0kJ/mol,所以答案为C:$- 283.0kJcdot mol^{- 1}$。'
A:20 B:33 C:19 D:14
AI参考:正确答案是B:33。题目中指出某元素原子仅有的两个价电子填充在n=4,l=0的亚层上,因此该元素属于第四周期的元素。又因为该元素的原子序数等于质子数,所以可以判断该元素的原子序数为2+8+8+18+3=33。因此,正确选项为B。'
A:直线形 B:“V”字形 C:“T”字形 D:三角形
AI参考:答案:D推理过程:根据价层电子对互斥理论,$SnCl_{2}$中中心原子$Sn$原子的价层电子对数为$4 + 2 \times (6 + 1 - 2 \times 2) = 6$,且没有孤电子对,所以其几何形状为三角锥形。故本题答案为D。'
A:六氟合硅(Ⅳ)化铜 B:六氟硅酸铜(Ⅰ) C:六氟硅酸铜 D:六氟合硅(Ⅳ)酸亚铜
AI参考:正确答案是C:六氟硅酸铜。配合物名称由中心原子(离子)和配位体组成,配位体写在中心原子(离子)的右下方,并用括号括起来。该配合物中铜原子为中心原子,六氟化硅为配位体,其正确的名称是六氟硅酸铜。因此,本题答案为C。'
A:在几个反应中,某催化剂可选择地加快其中某一反应的反应速率 B:催化剂使正、逆反应速率增大的倍数相同 C:催化剂不能改变反应的始态和终态 D:催化剂可改变某一反应的正向与逆向的反应速率之比
AI参考:正确答案是D:催化剂可改变某一反应的正向与逆向的反应速率之比。催化剂不能改变反应的平衡状态,因此催化剂不能改变反应的正向和逆向的反应速率之比。所以选项D是错误的。其他选项都是正确的,催化剂可以加快反应速率,且使正、逆反应速率增大的倍数相同,不会改变反应的始态和终态。'
A:[Fe(H2O)6]3+,[Zn(H2O)6]2+,[Cr(H2O)6]3+ B:[Ti(H2O)6]3+,[Fe(H2O)6]3+,[Fe(H2O)6]2+ C:[Fe(H2O)6]3+,[Cr(H2O)6]3+,[Ti(H2O)6]3+ D:[Mn(H2O)6]2+,[Fe(H2O)6]3+,[Zn(H2O)6]2+
A:k增加,K减小 B:k、K均减小 C:k、K均增加 D:k减小,K增加
A:0.010mol B:0.10mol C:0.20mol D:0.020mol
AI参考:正确答案是:B:0.10mol。根据硫酸根离子浓度为0.1mol/L,需要加入的氢氧化钠物质的量为硫酸根离子浓度的两倍,即0.2mol/L,故需要加入氢氧化钠物质的量为0.2mol/L×0.1L=0.02mol,故答案为B。根据硫酸根离子浓度求出需要加入的氢氧化钠物质的量,再根据选项进行选择。故选B。'
A:CCl4+K2Cr2O7®COCl2+CrO2Cl2+KCl B:H2O2+NaCrO2+NaOH®Na2CrO4+H2O C:PbS+HNO3®Pb(NO3)2+H2SO4+NO+H2O D:La2(SO4)3®La2O2SO4+SO2+O2
AI参考:正确答案是【D:La2(SO4)3®La2O2SO4+SO2+O2】。本题为单选题,需要从给出的四个选项中选出非氧化还原反应。D选项中,La2(SO4)3被分解为La2O2SO4,整个过程中没有发生氧化还原反应,符合题意。A选项中,Cr元素发生了氧化还原反应;B选项中,氧元素发生了氧化还原反应;C选项中,硫元素发生了氧化还原反应。因此,本题答案为D。'
A:使体积增大,减小压力,平衡向右移动 B:升高温度,正反应速率增大,逆反应速率减小 C:加入催化剂,只增大正反应速率 D:压缩体积,增大压力,平衡向右移动
A:降低温度,标准平衡常数增大 B:加入催化剂,HCl(g)的物质的量将增加 C:增大压力,O2(g)的量将增加 D:提高H2O(g)压力,HCl(g)的物质的量将增加
A:错 B:对
A:错 B:对
A:对 B:错
AI参考:正确。判断题中所述溶度积规则的实质是沉淀反应的反应商判据,因此答案为A:对。溶度积规则是沉淀溶解平衡的一个重要特征,它描述了溶液中离子浓度与沉淀溶解度之间的关系,而反应商则是反应平衡的重要参数,两者在沉淀溶解平衡中具有密切关系。'
A:对 B:错
AI参考:答案是A:对。根据配位平衡的原理,配离子的稳定常数与热力学温度成正比,即温度升高,稳定常数增大。对于同一配离子而言,相同温度时,它们的稳定常数应该相等。因此,题目中的判断是正确的。'
A:对 B:错
A:错 B:对
A:对 B:错
A:错 B:对
A:对 B:错
A:错 B:对
AI参考:B:对。根据题目中的化学式和化学计量数,可以判断出PbO₂和PbSO₄的相对分子质量不同,因此它们的氧化性不同。PbO₂具有更强的氧化性,所以题目中的判断是正确的。因此,答案为B:对。'
A:错 B:对
A:对 B:错
A:对 B:错
A:错 B:对
A:错 B:对
AI参考:答案是B:对。根据题目描述,混合气体中氮气的分体积等于氮气的物质的量乘以气体常数R除以总压强。因此,该判断题是正确的。'

