第六章 酸碱平衡:本章主要介绍酸碱质子理论、各类酸碱溶液pH值的计算方法以及缓冲溶液的作用、原理和缓冲溶液pH的计算方法。其中涉及酸碱质子理论的定义、共轭酸碱对的关系、酸碱反应的实质、水的离子积、弱酸、弱碱的解离平衡常数的表示方法及相关计算、一元弱酸碱,多元弱酸碱溶液pH值的计算、缓冲溶液的缓冲原理,缓冲容量,缓冲范围,缓冲溶液pH计算以及缓冲溶液的配置方法。6.1酸碱质子理论:酸碱质子理论的定义,特点以及酸碱反应的实质。[多选题]
6.2酸碱解离平衡:水的离子积常数、弱酸弱碱的解离常数以及共轭酸碱对解离常数的关系。
6.3稀释定律与两个效应:稀释定律、解离度、同离子效应与盐效应。
6.4溶液酸度的计算:一元弱酸弱碱的pH值的计算、多元弱酸弱碱的pH值的计算。
6.5缓冲溶液:缓冲溶液的作用、缓冲原理、影响缓冲容量的因素及缓冲溶液pH值的计算。
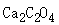 在下列物质的水溶液中溶解度大于其在纯水中溶解度的是( )。选项:[Ba(NO3)2, Na2C2O4, CaCl2, KCl]
在下列物质的水溶液中溶解度大于其在纯水中溶解度的是( )。选项:[Ba(NO3)2, Na2C2O4, CaCl2, KCl] [单选题]下列各组缓冲溶液中缓冲能力最强的一组是( )。选项:[
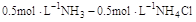 ,
, 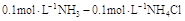 ,
, 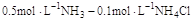 ,
, 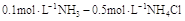 ]
][单选题]把少量
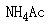 固体加入到
固体加入到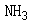 溶液中,则溶液的pH将( )。选项:[先减小后增大, 先增大后减小, 增大, 减少]
溶液中,则溶液的pH将( )。选项:[先减小后增大, 先增大后减小, 增大, 减少][判断题]缓冲溶液中加入少量强酸或者强碱其pH基本不变。选项:[对, 错]
[判断题]一对共轭酸碱中,共轭酸的酸性越强,共轭碱的碱性就越弱。选项:[错, 对]
温馨提示支付 ¥1.00 元后可查看付费内容,请先翻页预览!

