提示:内容已经过期谨慎付费,点击上方查看最新答案
无机化学
- 已知
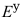 (Fe2+/Fe)= -0.45V,
(Fe2+/Fe)= -0.45V,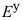 (Ag+/Ag)=0.80V,
(Ag+/Ag)=0.80V,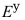 (Fe3+/Fe2+)=0.77V,标准状态下,上述电对中最强的氧化剂和还原剂分别是( )
(Fe3+/Fe2+)=0.77V,标准状态下,上述电对中最强的氧化剂和还原剂分别是( ) - 已知溶度积:
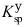 (Ag2CrO4)=1.1×10-12,
(Ag2CrO4)=1.1×10-12, 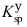 (PbCrO4)=2.8×10-13,
(PbCrO4)=2.8×10-13,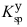 (BaCrO4)=1.2×10-10,
(BaCrO4)=1.2×10-10, (SrCrO4)=2.2×10-5。现有某溶液中含有浓度均为0.01 mol·L-1的四种硝酸盐 AgNO3、Pb (NO3)2、Ba (NO3)2、Sr (NO3)2,若向该溶液逐滴加入K2CrO4溶液时,则沉淀的先后顺序是( )
(SrCrO4)=2.2×10-5。现有某溶液中含有浓度均为0.01 mol·L-1的四种硝酸盐 AgNO3、Pb (NO3)2、Ba (NO3)2、Sr (NO3)2,若向该溶液逐滴加入K2CrO4溶液时,则沉淀的先后顺序是( ) - 按分子轨道理论,下列稳定性排列正确的是( )
- 实际浓度为0.1 mol/L NaCl溶液,其有效浓度为0.078 mol/L对此现象最恰当的解释是( )
- 下列叙述正确的是( )
- 下列说法正确的是( )
- 在0.10 mol·L-1的H2S溶液中,各物种浓度大小次序为( )
- 已知水Kw值是6.4×10-15( 18℃ ) 和1.00×10-14( 25℃ ),下列说法中正确的是( )
- 在KMnO4、K2MnO4、MnO2中Mn的氧化值分别为( )
- Fe3+ 形成的配位数为6的外轨型配合物中,Fe3+ 离子接受孤对电子的空轨道是( )
- 难溶盐 M2B 的 =8.1×10-12。在B2-离子浓度为 6×10-3的溶液中,开始生成 M2B 沉淀需 M+ 离子最低浓度(mol · L-1) 约为( )
- N2、O2、F2分子,三者的键长顺序应为( )
- 在电子云的黑点图中,小黑点表示的是( )
- 欲增加Mg(OH)2在水中的溶解度,可采用的方法是( )
- 对于一元弱酸的水溶液,稀释一倍则其解离α和平衡常数Ka分别( )
- NH3分子中,N原子采取的杂化方式是( )
- 描述基态19K原子最外层电子运动状态的四个量子数应是( )
- 已知0.01 mol/L 的弱酸HA溶液有1%的电离,它的电离常数和pH值分别为( )
- 在多电子原子中,电子的能量由决定( )
- 在Mg(OH)2的饱和溶液中加入少量MgCl2 固体,溶液pH值变化的趋势是( )
- 已知反应A+2B
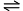 C的平衡常数为K1,反应A+2B+D
C的平衡常数为K1,反应A+2B+D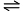 2E的平衡常数为K2,则反应C+D
2E的平衡常数为K2,则反应C+D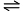 2E的平衡常数为( )
2E的平衡常数为( ) - 氮原子的价电子层上有三个 p 电子,若用四个量子数来描述它们,可以表示为( )
- 两个半电池,电极相同,电解质溶液中的物质也相同,都可以进行电极反应,但溶液的浓度不同,它们组成的电池的电动势( )
- CO2 分子和CO2分 子之间存在以下哪个分子间的作用力( )
- 下列方法中,能改变可逆反应的平衡常数的是( )
- 在所有元素的原子中,电离能、电子亲合能、电负性最大的分别为( )
- 在HF溶液中,加少量固体NH4F后,则HF的( )
- 已知:H3PO4的
 ,
,  ,
, 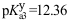 。欲配制pH=12.0的缓冲溶液,可选择的缓冲对是 ( )
。欲配制pH=12.0的缓冲溶液,可选择的缓冲对是 ( ) - Fe2++3Ac- ⇋ [Fe(Ac)3]-向这个平衡体系中,分别进行如下实验操作①加入HCl ②加入少量NaOH,平衡分别( )
- 已知
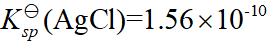 ,
,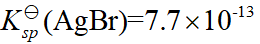 ,
, 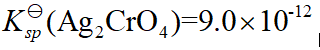 ,则它们的溶解度大小次序是( )
,则它们的溶解度大小次序是( ) - 已知
 (Fe3+/Fe2+)=0.77V,
(Fe3+/Fe2+)=0.77V,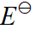 (Br2/Br-)=1.08V,则反应:Br2 + 2Fe2+ = 2Br- + 2Fe3+ 可( )进行
(Br2/Br-)=1.08V,则反应:Br2 + 2Fe2+ = 2Br- + 2Fe3+ 可( )进行 - 某二元弱酸H2A的
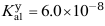 ,
,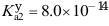 ,若其浓度为0.05 mol·L-1,则溶液中A2-的浓度为( )
,若其浓度为0.05 mol·L-1,则溶液中A2-的浓度为( ) - 已知
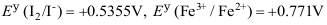 ,则还原性最强的是
,则还原性最强的是
( ) - [CoCl2 (en)2]Cl的名称是( )
- BaSO4在纯水中的溶解度比在0.10 mol·L-1 H2SO4溶液中( )
- 当 pH=10,氢气为标准压力时,氢电极的电极电势是( )
- 下列配体中可形成螯合物的是( )
- 对于主族元素,同一周期从左→右元素的原子半径的变化趋势( )
- Fe3+ 具有d5电子构型,在八面体场中要使配合物为高自旋态,则分裂能△和电子成对能E所用满足的条件是( )
- 在相同体积的水中加入等物质的量的下列物质,使水的凝固点降低最多的是( )
- 原子核外电子排布遵循的原则是( )
- 下列几种说法中,错误的是( )
- 下列物质中,可做作螯合剂的是( )
- 非电解质稀溶液的依数性有哪些( )
- 当溶液中的H+浓度增大时,氧化能力逐渐增强的氧化剂是( )
- 下列分子或离子中几何构型为三角锥型的是( )
- 下列分子中偶极矩为零的是( )
- 实验室配制SbCl3溶液时,必须加入盐能得到澄清溶液,原因是( )
- 下列元素原子半径、电离能、电子亲和能及电负性大小的比较中正确的是( )
- 列基态电子构型属p区元素的是( )
- 对于多种难溶电解质来说,溶度积越小的,其溶解度也越小。( )
- 电极电势的大小与电极本身的性质以及温度、浓度等因素有关。( )
- 在
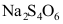 中,
中,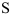 的氧化值为+2.5。( )
的氧化值为+2.5。( ) - 因为
 (Ag+ / Ag) >
(Ag+ / Ag) >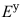 (Zn2+ / Zn),则可从理论上判定在标准状态下,电池反应2Ag+ (aq) + Zn(s)
(Zn2+ / Zn),则可从理论上判定在标准状态下,电池反应2Ag+ (aq) + Zn(s)  2Ag(s) + Zn2+(aq) 是自发进行的。( )
2Ag(s) + Zn2+(aq) 是自发进行的。( ) - 由于d轨道在四面体配体场的分裂能较小,所以四面体配合物中的金属离子的价层d电子都是高自旋排布,且配合物都具有顺磁性。( )
- 已知原电池中两电极的标准电极电动势,则能判断该电池反应自发进行的方向。( )
- 共轭酸碱对中共轭酸的酸性越强,它的共轭碱的碱性也越弱。( )
- 配合物中心原子的配位数不一定等于配体的个数。( )
- 渗透现象是指纯溶剂的净迁移,其渗透方向是纯溶剂通过半透膜从低浓度往高浓度迁移。( )
- 当一个化学反应处于平衡状态时,正反应和逆反应速率都是零。( )
- 主量子数为3时,有3s、3p、3d三条原子轨道。( )
- 铬酸银的溶度积小于氯化银的溶度积,因此,铬酸银的溶解度也小于氯化银的溶解度。( )
- 按照原子轨道的重叠方式,可以把共价键分为σ键和π键。( )
- 某一盐溶液的pH =7,表明该盐溶液不会发生水解。( )
- 根据稀释定律,弱电解质的浓度越小,则电离度越大,因此对某一弱酸来说,其溶液越稀,H+ 浓度越大,pH 值越小。( )
- BeCl2分子是以Be原子的s轨道与Cl原子的2个p轨道杂化而形成。( )
- 电子云是描述核外某空间电子出现的机率密度的概念。( )
- 在碱性介质中,卤素单质的歧化反应产物都是X 和XO3。( )
- 化学键包括金属键、离子键、共价键,其中共价键和离子键没有方向性和饱和性。( )
- 在各种不同的原子中3d 和4s电子的能量相比时 3d > 4s。( )
A:Fe3+,Fe B:Ag+,Fe C:Ag+,Fe2+ D:Fe3+,Fe2+
答案:Ag+,Fe
A:PbCrO4,Ag2CrO4,BaCrO4,SrCrO4。 B:Ag2CrO4,PbCrO4,SrCrO4,BaCrO4; C:SrCrO4,PbCrO4,Ag2CrO4,BaCrO4; D:PbCrO4,Ag2CrO4,SrCrO4,BaCrO4;
答案:PbCrO4,Ag2CrO4,BaCrO4,SrCrO4
A: > O2 > B:O2 > > C: > O2 > D: > > O2
答案:O2+>O2>O22-
A:部分电离 B:离子间相互牵制 C:水发生了电离 D:渗透现象
AI参考:正确选项是B:离子间相互牵制。实际浓度为0.1 mol/L的NaCl溶液中,NaCl的离子之间相互牵制,使得离子的水合过程受到限制,导致有效浓度低于实际浓度。这是因为NaCl中的离子相互作用,使得它们的水合作用减弱,从而降低了溶液的电导率。因此,有效浓度比实际浓度低,但并不是离子发生了电离、水发生了电离或渗透现象。'
A:对用水稀释后仍含有AgCl(s)的溶液来说,稀释前后AgC1的溶解度和它的标准溶度积常数均不改变 B:难溶电解质离子浓度的乘积就是该物质的标准溶度积常数 C: 大的难溶电解质,其溶解度s也大 D:由于AgC1饱和溶液的导电性很弱,所以它是弱电解质
答案:断电时,RAM中保存信息全部丢失,ROM中保存的信息不受影响。;磁盘必须进行格式化后才能使用;Ctrl键是起控制作用的,它一般与其他键同时按下才有用
A:有氢原子的物质分子间就有氢键 B:色散力仅存在于非极性分子之间 C:取向力仅存在于极性分子之间 D:非极性分子内的化学键总是非极性的
AI参考:正确答案是D:非极性分子内的化学键总是非极性的。选项A错误,氢键的形成需要氢原子和电负性强的原子间的相互作用,不是只要有氢原子就有氢键。选项B错误,色散力存在于所有分子之间,不仅仅是非极性分子之间。选项C错误,取向力存在于极性分子和非极性分子之间。只有选项D正确,非极性分子内的化学键总是非极性的,这是由于分子的电中性决定的。'
A:H2S > H+ > S2- > OH- B:H2S > H+> OH-> S2- C:H2S > H+> S2-> HS- D:H+ > H2S > HS-> S2-
答案:H2S>H+>OH->S2-
A:水的电离是放热过程 B:仅在25 ℃时,水才是中性的 C:水的pH值在25 ℃时大于在18 ℃时 D:在18 ℃时,水中氢氧根离子的浓度是8.0×10-8 mol·L-1
A:+6,+5,+2 B:+7,+5,+2 C:+6,+7,+4 D:+7,+6,+4
AI参考:答案:A分析:KMnO4中锰的化合价为+7价,根据化合物中元素正负化合价的代数和为0,所以Mn的氧化值为+6。K2MnO4中锰的化合价为+6价,两个钾离子一共为+2价,氧离子一共-2价,根据化合物中元素正负化合价的代数和为0,所以锰的氧化值为+5。MnO2中锰的化合价为+4价。因此,正确选项为A:在KMnO4、K2MnO4、MnO2中Mn的氧化值分别为+6,+5,+2。'
A:d 2sp3 B:d 5s C:d 4sp D:sp3d 2
A:1.20×10-2 B:1.35×10-9 C:3.67×10-5 D:2.85×10-6
A:F2> N2 > O2 B:O2> F2 >N2 C:F2>O2 >N2 D:N2>O2 > F2
AI参考:正确答案是A:F2> >N2>O2。氮气分子键长为146pm,氧气分子键长为120pm,氟气分子键长为67pm,因此氟气分子键长最小,氮气分子键长大于氧气分子键长,因此正确顺序为F2>N2>O2。'
A:其疏密表示电子出现的几率的大小 B:表示电子 C:表示电子在该处出现 D:其疏密表示电子出现的几率密度的大小
A:加入NaOH B:加入MgSO4溶液 C:加入NH4Cl溶液 D:加适量的水
A:增大,不变 B:增大,减小 C:减小,增大 D:减小,不变
AI参考:正确答案是【D:减小,不变】。对于一元弱酸的水溶液,稀释会促进电离,但由于弱酸只有部分电离,所以其解离度和平衡常数Ka均减小。因此选项D正确。同时,要注意平衡常数只受温度影响,与其他因素无关,因此答案为D,不变。请注意,当选项中有ABCD等均可时,可能需要您自己判断和选择。希望以上解析能帮助您理解这个问题。'
A:sp3d B:sp C:sp2 D:sp3
A:3,0,0,1/2 B:4,0,0,1/2 C:4,1,0,1/2 D:4,1,1,1/2
A:10-8、4 B:10-6、6 C:10-8、5 D:10-6、4
A:n,l,m B:n C:n,l D:l
AI参考:正确答案是【C:n,l】。在多电子原子中,电子的能量由主量子数n和角量子数l决定,即能量主要由主量子数决定,同一轨道的电子能量由角量子数决定。因此,选项C是正确答案。选项A、B、D都只反映了其中一个方面,不能全面描述电子能量的决定因素。'
A:增大 B:减小 C:先增大后变小 D:不变
A:K2 / K1 B:K2 -K1 C:K1 / K2 D:K2 × K1
AI参考:正确答案是A:K2 / K1。已知反应A+2B
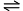 C的平衡常数为K1,反应A+2B+D
C的平衡常数为K1,反应A+2B+D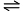 2E的平衡常数为K2,所以C+D
2E的平衡常数为K2,所以C+D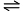 2E的平衡常数等于K2 / K1,因此答案为A。'
2E的平衡常数等于K2 / K1,因此答案为A。'A:( 2,1,0,+ )、 ( 2,1,-1,- )、 ( 2,1,1,+ ) B:( 2,0,0,+ )、 ( 2,1,-1,+ )、 ( 2,1,1,+ ) C:( 2,1,0,- )、 ( 2,1,-1,- )、 ( 2,1,1,+ ) D:( 2,1,0,+ )、( 2,1,1,+ ) 、( 2,1,-1,+ )
A: ≠ 0 , ≠ 0 B: ≠ 0 ,EMF=0 C: =0 , =0 D: =0 , ≠ 0
A:色散力 B:诱导力 C:氢键 D:取向力
AI参考:正确选项是B:诱导力。二氧化碳分子之间存在诱导力、色散力和取向力。其中,诱导力是由于极性分子和非极性分子之间的偶极相互作用而产生的;色散力是极性分子之间由于电子云重叠而产生的非极性相互作用;取向力是极性分子之间由于偶极相互作用而产生的吸引力。因此,二氧化碳分子之间存在诱导力,而二氧化碳分子和CO₂分子之间不存在氢键、取向力和色散力。所以选项B是正确答案。'
A:加入催化剂 B:改变体系的温度 C:改变平衡压力 D:改变反应物浓度
A:He、O、F B:He、Cl、O C:He、Cl、F D:He、F、O
AI参考:正确答案是D:He、F、O。在所有元素的原子中,He的原子核最稳定,因此电离能最大;F元素是电负性最大的元素;电子亲和能大小与元素性质及元素之间的电子结合能力有关,因此不是原子电离能、电子亲和能最大的是电负性最大的氧元素。所以正确选项为D:He、F、O。'
A:Kθa 变大 B:电离度下降 C:电离度升高 D:pH下降
AI参考:在HF溶液中,加少量固体NH4F后,电离度升高。这是因为NH4F会与HF反应生成难电离的物质氟化铵(NH4),使得HF的电离平衡向正方向移动,电离度上升。选项C是正确的。其他选项如A、B、D与此实验现象不符。希望以上解析对你有所帮助。'
A:H3PO4 – B: – C:H3PO4– D: –
AI参考:从题目给出的磷酸H3PO4的数据看,它的PKa大约在7.2和4.7之间,pH=12.0的缓冲溶液,应选择pKa接近12.0的缓冲对,所以应选择C:H3PO4– 。因此,答案为C:H3PO4– 。'
A:均向左移动 B:①向左②向右移动 C:①向右②向左移动 D:均向右移动
A:Ag2CrO4>AgCl>AgBr B:AgBr>AgCl>Ag2CrO4 C:AgCl>Ag2CrO4>AgBr D:AgCl>AgBr>Ag2CrO4
AI参考:正确答案是C:AgCl>Ag2CrO4>AgBr。这三个选项都是卤化银,其中AgCl的溶解度最大,其次是AgBr,最小的是Ag2CrO4。因此,它们的溶解度大小次序是AgCl>AgBr>Ag2CrO4。所以选项C是正确的。'
A:处于平衡 B:逆向自发 C:无法判断 D:正向自发
A: mol·L-1 B: mol·L-1 C: mol·L-1 D: mol·L-1
AI参考:根据电离平衡常数计算公式Ka = c(HA)^2 / c(H2A),可以知道在A^2-浓度和Ka大小的关系为A^2->HA,由于浓度为0.05mol/L的二元弱酸H2A溶液中A^2-的浓度为小于等于0.025mol/L,因此答案为C。因此,正确选项为C:$mol cdot L^{- 1}$。'
A: B: C:I2 D:I -
AI参考:正确答案是C:I2。
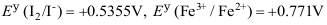 是一个图片链接,链接指向的图片内容中包含碘元素,所以需要还原性的物质与其反应,才能将其还原。碘元素的常见还原剂有I-、I2等。根据题目中的选项,只有C选项中的I2具有强还原性,能够与碘元素发生反应。因此,答案为C。'
是一个图片链接,链接指向的图片内容中包含碘元素,所以需要还原性的物质与其反应,才能将其还原。碘元素的常见还原剂有I-、I2等。根据题目中的选项,只有C选项中的I2具有强还原性,能够与碘元素发生反应。因此,答案为C。'A:氯化二乙二胺·二氯合钴(Ⅲ) B:氯化二氯·二乙二胺合钴 C:氯化二氯·二乙二胺合钴(Ⅲ) D:氯化二氯·二乙二胺合钴(Ⅱ)
AI参考:[CoCl2 (en)2]Cl的名称是:氯化二氯·二乙二胺合钴(Ⅲ)。选项中只有C是符合命名规则的,即先写配合物的中心离子(或原子),再写配位体,最后写配位数的名称。因此,正确答案是C:氯化二氯·二乙二胺合钴(Ⅲ)。'
A:小 B:大 C:一样大 D:无法判断
AI参考:正确答案是【B】:大。BaSO4在纯水中的溶解度比在0.10 mol·L-1 H2SO4溶液中大。这是因为BaSO4在水中存在溶解平衡,而在硫酸溶液中,由于溶液中存在大量的H+离子,可以与BaSO4反应生成可溶性的BaSO4·2H2O,从而促进BaSO4的溶解。因此,BaSO4在纯水中的溶解度比在硫酸溶液中大。'
A:0.592V B:-0.30V C:0.30V D:-0.592 V
A:CH2NH2 B:NH2-CH2-CH2-NH2 C: D:CN-
AI参考:选项B:NH2-CH2-CH2-NH2可以形成螯合物。螯合物通常是由一种多齿配体与中心原子键合形成的一种特殊的配合物,其中配体含有两个或多个可以与中心原子结合的配位基团。选项B中的配体有两个氮原子,可以形成螯合物。其他选项中的配体只有一个配位基团或不含氮原子,不能形成螯合物。因此,本题的答案是B:NH2-CH2-CH2-NH2。'
A:渐小 B:先减后增 C:先增后减 D:增大
AI参考:正确选项是【B:先减后增】。对于主族元素,同一周期从左→右元素的原子半径的变化趋势是先减小后增大,但减小的幅度越来越大,增大的幅度越来越小。这是因为电子层数相同的元素随着核电荷数的递增,原子核对最外层电子的吸引力增强,导致原子半径减小;当进入过渡元素后,由于电子层数逐渐增多,原子半径逐渐增大。因此,正确选项是B:先减后增。'
A:△小于E B:△等于E C:其他选项均正确 D:△大于E
A:MgCl2 B:蔗糖 C:葡萄糖 D:NaCl
AI参考:正确答案是D:NaCl。水的凝固点降低值与加入的溶质分子数成正比,而等物质的量的四种物质中,只有氯化钠溶于水后电离出的钠离子和氯离子能降低水的凝固点,且加入等物质的量的氯化钠,加入的溶质分子数最多,所以水的凝固点降低最多。因此,本题答案为D。'
A:泡里不相容原理 B:洪特规则 C:能量最低原理 D:原子轨道最大重叠原理 E:对称性匹配
A:非极性分子中无极性键 B:四原子分子AB3一定为非极性分子 C:由同一种原子形成的分子可能有极性 D:三原子分子AB2一定为非极性分子 E:双原子形成的分子一定为极性分子
A:Cl- B:C2O4- C:H2N-CH2-CH2-NH2 D:SO42- E:H2N-NH2
A:渗透压 B:熔点升高 C:蒸气压下降 D:沸点升高 E:凝固点降低
A:MnO2 B:Cr2O72- C:Fe3+ D:[PtCl6]2- E:MnO4-
A: B:CH4 C:BF3 D:NH3 E:PCl3
AI参考:正确选项为:D:NH3选项A为正四面体结构,选项B为三角锥结构,选项C为平面三角形结构,选项E为三角双锥结构。因此,只有选项D中的分子或离子几何构型为三角锥型。'
A:BF3 B:H2O C:CO2 D:BeCl2 E:CCl4
A:阻止SbCl3水解 B:盐效应促使SbCl3水解 C:形成缓冲溶液 D:同离子效应 E:发生了氧化还原反应
AI参考:正确答案是【A:阻止SbCl3水解】。实验室配制SbCl₃溶液时,必须加入盐能得到澄清溶液,原因是阻止SbCl₃水解,具体原因如下:A项正确,为了阻止SbCl₃水解,加入适当的盐以降低溶液中水解离子的浓度,从而达到抑制水解的目的;B项错误,盐效应通常是指加入与弱电解质同离子存在,对弱电解质离解平衡产生的促进作用;C项错误,缓冲溶液是由弱酸及其盐、弱碱及其盐组成的混合物,加入缓冲溶液后溶液的pH值不会发生显著变化;D项错误,同离子效应是指加入与弱电解质具有相同离子的其他离子后,会降低弱电解质的浓度,从而影响其电离平衡;E项错误,发生了氧化还原反应不属于阻止SbCl₃水解的原因。综上所述,A为正确选项。'
A:第一电离能:F > Cl > Br > I B:电负性:Si > Al > Mg > Na C:原子半径:O > S > Se > Te D:第一电子亲和能:O > S > Se > Te E:电负性:F > Cl > Br > I
A:3d 84s2 B:4d 105s1 C:5s25p4 D:4d75s1 E:4s2 4p1
AI参考:正确选项为:C:5s25p4 E:4s2 4p1解析:A选项:3d轨道有8个电子,4s轨道有2个电子,电子排布式为[Ar]3d84s2,属于ds区元素;B选项:4d轨道有10个电子,5s轨道有1个电子,电子排布式为[Xe]4d105s1,属于f区元素;D选项:4d轨道有7个电子,5s轨道也有1个电子,电子排布式为[Xe]4d75s1,属于f区元素;因此,只有C和E选项符合p区元素的要求。C选项的电子排布式为[Ne]5s25p4,属于p区元素;E选项的电子排布式为[Ar]4s24p1,也属于p区元素。所以答案是C和E。'
A:错 B:对
AI参考:答案是B:对。根据溶度积规则,溶度积越小的难溶电解质,其溶解度越小。因此,这个判断题是正确的。'
A:对 B:错
AI参考:答案是B:错。电极电势的大小受到电极本身的性质、温度、浓度以及许多实验条件的影响,因此无法准确预测。不同物质间的电极电势差异可能很大,因此不能简单地认为电极电势与电极本身的性质以及温度、浓度等因素有关。因此,这个判断题是错误的。'
A:对 B:错
AI参考:氧化值是用来描述电子在化学键中转移的数量的一个概念。在这个问题中,
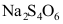 和
和 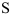 是两个不同的图片,所以它们各自的氧化值无法进行比较。因此,答案是B:错。'
是两个不同的图片,所以它们各自的氧化值无法进行比较。因此,答案是B:错。' A:错 B:对
AI参考:B:对。根据题目给出的信息,由于 Ag⁺/Ag 和 Zn²+/Zn 的电极电势值已知,可以通过比较它们的大小来判断电池反应是否自发进行。根据标准电极电势表,可以得知 Ag⁺/Ag 的电极电势为 0.799 V,而 Zn²+/Zn 的电极电势为 - 0.763 V。因此,由于 Ag⁺/Ag > Zn²+/Zn,所以电池反应 2Ag⁺(aq) + Zn(s) → 2Ag(s) + Zn²+(aq) 是自发的。因此,答案是 B:对。'
A:对 B:错
AI参考:B. 错。虽然d轨道在四面体配体场的分裂能较小,但是并不能直接说明四面体配合物中的金属离子的价层d电子都是高自旋排布。此外,由于存在未成对电子,配合物不一定都具有顺磁性。因此,该判断题是错误的。'
A:错 B:对
A:对 B:错
A:对 B:错
A:对 B:错
A:错 B:对
A:错 B:对
A:错 B:对
A:对 B:错
AI参考:答案是B:错。按照原子轨道的重叠方式,可以把共价键分为σ键和π键。但是需要注意的是,在判断键型时,还需要考虑电子云的取向等因素。因此,这个判断题是错误的。'
A:错 B:对
AI参考:正确答案是B:对。某一盐溶液的pH=7,表明该盐溶液中的离子不水解,溶液为中性。因此,该盐溶液不会发生水解。'
A:错 B:对
A:对 B:错
AI参考:B. 错。BeCl2分子中的Be-Cl键是通过Be原子的2s轨道和Cl原子的2p轨道重叠形成的,而不是通过Be原子的s轨道与Cl原子的2个p轨道杂化而形成的。因此,该判断题错误。'
A:对 B:错
A:对 B:错
AI参考:答案是B:错。在碱性介质中,卤素单质的歧化反应产物不都是X 和XO3,还可能有其他产物。'
A:错 B:对
AI参考:正确答案是B:对。化学键包括金属键、离子键、共价键,其中离子键和共价键都属于相互作用力,它们没有方向性和饱和性。离子键是由阴阳离子之间通过静电作用形成的,没有方向性和饱和性;共价键是由原子间通过共用电子对形成的,也没有方向性和饱和性。因此,答案为B,即“对”。'
A:对 B:错
温馨提示支付 ¥2.35 元后可查看付费内容,请先翻页预览!