第十章 氧化还原反应:氧化还原反应是一类及其重要的化学反应。对氧化还原反应的研究具有重要的实际意义和理论意义。本章重点讨论恒温恒压下有非体积功——电功的化学反应。通过讨论该类反应的进行程度,以及计算该类反应的平衡常数的特有的方法,提出判断该类反应进行方向的特有的热力学判据,从而掌握更加完善的化学热力学理论。10.1氧化还原反应和原电池:化合价和氧化态是两个不同的概念,要注意区别。将化学能转变成电能的装置称为原电池,它利用化学反应中电子转移产生电流。原电池装置中的盐桥作用很重要,可以使两个半电池反应乃至电池反应得以继续,电流得以维持。[单选题]对于银锌电池:(-)Zn│Zn^2+(1mol·L^-1)‖Ag^+(1mol·L^-1)│Ag(+),已知E^θ(Zn^2+/Zn)=-0.76V,E^θ(Ag^+/Ag)= 0.799V,该电池的标准电动势是( )。
10.2电极电势及电动势:电极的电极电势表示电极中极板与溶液之间的电势差,而两电极的电极电势之差就是原电池的电动势。氧化还原反应可以以原电池方式完成。
10.3元素电势图:元素电势图也称为提拉莫图,可以用于表明物质酸性的强弱,获得电对的电极电势数据,判断某种氧化态的稳定性。
选项:[0.076V, 0.039V, 1.56V, 1.180V]
[单选题]E^θ(MnO^4-/Mn^2+)=1.51V,E^θ(MnO^4-/MnO2)= 1.68V,E^θ(MnO^4-/MnO4^2-)=0.56V,则还原型物质的还原性由强到弱排列的次序是( )。
选项:[Mn^2+ > MnO4^2- > MnO2, MnO2 > MnO4^2- > Mn^2+, MnO4^2- > MnO2 > Mn^2+, MnO4^2- > Mn^2+ > MnO2]
[单选题]用反应Zn^+2Ag^+⇌2Ag^+Zn^2+组成原电池,当[Zn^2+]和[Ag^+]均为1mol·dm^-3,在298.15K时,该电池的标准电动势E^θ池为( )。
选项:[E^θ池=E^θ(Zn^2+/Zn)–E^θ(Ag^+/Ag), E^θ池=E^θ(Ag^+/Ag)–E^θ(Zn^2+/Zn), E^θ池=2E^θ(Ag^+/Ag)–E^θ(Zn^2+/Zn), E^θ池=E^θ(Ag^+/Ag)]^2–E^θ(Zn^2+/Zn)]
[单选题]
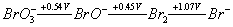 根据碱性溶液中溴的元素电势图,能发生歧化反应的物质是( )。
根据碱性溶液中溴的元素电势图,能发生歧化反应的物质是( )。选项:[BrO^3-, Br2, Br^-, BrO^-]
[单选题]根据E^θ(PbO2/PbSO4) >E^θ(MnO^4-/Mn^2+) >E^θ(Sn^4+/Sn^2+),可以判断在组成电对的六种物质中,氧化性最强的是( )。
选项:[Sn^2+, Sn^4+, PbO2, MnO^4-]
[判断题]原电池是将化学能转化成电能的装置。( )选项:[对, 错]
[判断题]原电池的正极发生氧化反应。( )选项:[错, 对]
[判断题]氧化还原电对是由不同种元素的氧化型物质和还原型物质构成的。( )选项:[错, 对]
[判断题]电极电势值越小,电对的氧化型物质氧化能力越弱,还原型的还原能力越强。( )选项:[错, 对]
[判断题]如果元素电势图中某物质左边的标准电极电势低于右边的标准电极电势 ( E^θ右>E^θ左 ),该物质则可歧化为与其相邻的物种。( )选项:[对, 错]
温馨提示支付 ¥1.00 元后可查看付费内容,请先翻页预览!

