提示:内容已经过期谨慎付费,点击上方查看最新答案
物理化学(上)(湖南科技大学)
- 偏摩尔量因为与浓度有关,因此它不是一个强度性质。( )
- 相图中的点都是代表体系状态的点。( )
- 对于一个定量的理想气体,温度一定,热力学能和焓也随之确定。( )
- 一定量的气体当温度一定时,气体的体积与压力的乘积等于常数。 ( )
- 在临界温度以上,物质的存在形式一定是气态。( )
- 理想气体反应,定温定容条件下添加惰性组分时,平衡将向体积减小的方向移动。( )
- 恒定压力下,根据相律得出某体系的 f = l,则该体系的温度就有一个唯一 确定的值。( )
- 某系统当热力学能、体积恒定时,ΔS<0过程则不能发生。( )
- 标准平衡常数变了,平衡一定会移动。反之,平衡移动了,标准平衡常数一定会改变。( )
- 焓的增加量
等于该过程中系统从环境吸收的热量。( )
- 气体常数R的数值与气体种类无关,因此压缩因子Z的数值也与气体种类无关。( )
- 分压定律和分体积定律都适用于理想气体。( )
- 单组分体系的相图中两相平衡线都可以用克拉贝龙方程定量描述。( )
- 功可以全部转化为热,但热一定不能全部转化为功。( )
- 某系统从始态经历一个绝热不可逆过程到达终态,为了计算某些状态函数的变量,可以设计一绝热可逆过程,从同一始态出发到达同一终态。( )
已知气体A 和B 的临界温度
, 临界压力
, 则这两种气体的vander Waals 常数关系是: ( )
- 温度升高时,固体氧化物的分解压力(分解反应是吸热反应):( )
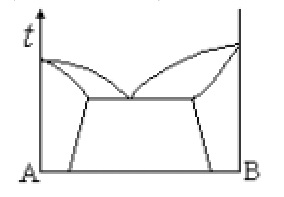
- 如图 A 与 B 是两组分恒压下固相部分互溶凝聚体系相图,图中有几个单相区( )
- 0℃时,
和
气体,根均方速率最大的是:( )
- 对于A、B两种实际气体处于相同的对比状态,则( )。
- 下列过程哪一种是等熵过程( )。
- 对热力学能的意义,下列说法中正确的是 ( )
- 两组分理想液态混合物,在任何浓度下,其蒸气压( )。
- 系统接受环境做功为160 J,热力学能增加了200 J,则系统( )。
- 实际气体处在下列哪种情况下,其行为更接近于理想气体 ( )
- 理想气体模型的基本特征是( )。
- 对于理想混合物中组分B化学势的标准态是( )。
- 吉布斯三角形中点P,其中1个组分含量为12%,第二个组分含量为27%,则第三个组分含量为( )。
- 对封闭系统,当过程的始终态确定后,下列值中不能确定的是 ( )。
- 在一绝热箱内,一电阻丝浸入水中,通以电流。若以水和电阻丝为系统,其余为环境,则( )。
- 当克劳修斯─克拉贝龙方程应用于凝聚相转变为蒸气时则:( )。
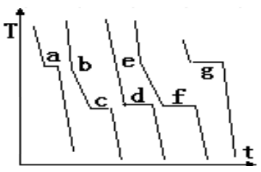
- 用热分析法测绘的Bi-Cd二组分体系的步冷曲线如下图所示,在转折点上出现的情况是:( )
- 若在高温高压下,某实际气体的分子所占有的空间的影响用体积因子b 来表示, 则描述该气体较合适的状态方程是: ( )
- 温度T下,A,B两组分液态完全互溶,其饱和蒸气压分别为
和
,且
。在A,B组成的气-液平衡系统中,当系统组成
时,向系统中加入B(l) 会使系统压力增大;反之,当系统组成
时,向系统中加入B(l) 系统压力降低,则该系统具有( )恒沸点 。
- 具有相同状态的氧气与氮气,在维持恒温恒容条件下混合,此过程系统的熵变为( )。
- 已知
能形成三种水合物:
在101.325 kPa下,与平衡共存的盐最多有( )种。
- 在隔离系统内( )。
- 在体积
的容器中, 装有压强
的理想气体,则容器中分子的平均平动动能总和为:( )。
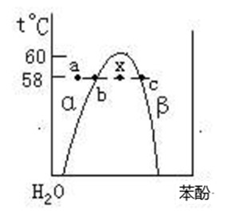
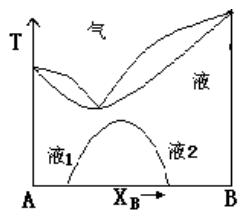
水-苯酚部分互溶双液系T~x相图如图所示,若系统处于a点[t=58℃,x(苯酚)=12%],保持系统温度不变,向系统内加入苯酚,下列叙述不正确的是:( )。
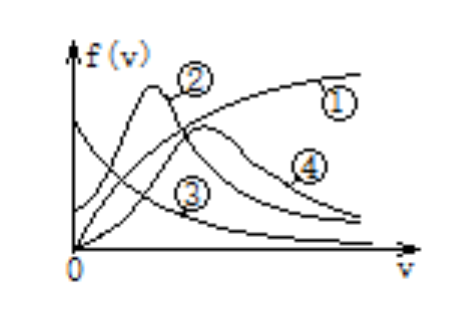
- 如图,横坐标v表示分子速率,纵坐标f(v)表示各等间隔速率区间的分子数占总分子数的百分比。图中曲线能正确表示某一温度下气体分子速率分布规律的是: ( )。
- 关于熵的说法,错误的是( )
- 下列相图中, 正确说法是:: ( )
- 一定量理想气体向真空做绝热自由膨胀,体积由
增至
,此过程中气体的( )。
- 下列说法正确的有( )。
- 在理想气体真空膨胀过程中,系统的ΔU,ΔH,ΔG,ΔA何者为零?( )
- 在非理想气体卡诺循环过程中,系统的ΔU,ΔH,ΔG,ΔA何者为零?( )
- 下列哪些是化学势( )。
- 反应
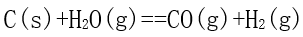 ,在400℃时达到平衡,
,在400℃时达到平衡,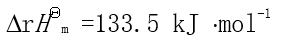 ,为使平衡向右移动,可采取的措施有( )。
,为使平衡向右移动,可采取的措施有( )。 - 298.15K时化学反应:A(g)+B(g)= C(g)改变压力,下列数值发生变化的是( )。
- 系统中一定量理想气体的组成及温度都保持不变,但体积和压力发生变化时ΔU,ΔH,ΔA和ΔG中何者必定为零。( )
A:错 B:对
答案:错
A:错 B:对
答案:对
A:对 B:错
答案:对
A:错 B:对
答案:错
A:错 B:对
答案:正确
A:对 B:错
A:对 B:错
A:对 B:错
A:错 B:对
A:对 B:错
A:对 B:错
A:错 B:对
A:错 B:对
A:对 B:错
A:对 B:错
A: B: C: D:
AI参考:气体A和B的vander Waals常数关系是: A推理过程:Vander Waals常数是描述气体分子相互作用的参数,它是由气体分子的范德华距离、体积和电荷等因素决定的。在题目中,已知气体A和B的临界温度和临界压力,这些参数决定了气体分子的相互作用,因此可以通过这些参数来计算它们的vander Waals常数关系。由于题目没有给出具体的数值,因此无法直接得出答案。但是,根据题目所给的信息,可以得出结论:气体A和B的vander Waals常数关系是A。'
A:恒定 B:降低 C:无法确定 D:增大
A:3 B:2 C:4 D:1
A: B: C: D:
AI参考:根据题目描述,我们需要找出在0℃时,气体根均方速率的最大值。对于两个图像中的气体,我们无法直接比较它们的均方速率,因为图像中没有提供具体的气体种类、压力、温度等参数。然而,我们可以根据题目描述进行推断。通常,均方速率是描述气体运动速度分散程度的一个指标,温度越低,气体分子的平均速度越小,均方速率也越小。因此,在0℃时,气体分子的平均速度最小,均方速率也应该最小。由于我们无法确定具体的气体种类和压力等参数,所以无法确定哪一个气体的均方速率最大。综上所述,正确答案是D:无法确定。'
A:A、B两种气体的临界压力相等 B:A、B两种气体处于相同的状态 C:A、B两种气体的对比参数 和 相等 D:A、B两种气体的压力相等
A:1mol某液体在正常沸点下发生相变 B:1mol氧气经一恒温不可逆过程 C:1mol氮气经一绝热可逆膨胀或压缩过程 D:1mol氢气经一恒温可逆过程
A:当理想气体的状态改变时,热力学能一定改变 B:只有理想气体的热力学能是状态的单值函数 C:系统的热力学能即为系统内分子之间的相互作用势能 D:对应于某一状态的热力学能是不可测定的
A:与混合物组成无关 B:介于两个纯组分的蒸气压之间 C:恒小于任一纯组分的蒸气压 D:恒大于任一纯组分的蒸气压
A:放出热量360J B:放出热量40J C:吸收热量360J D:吸收热量40J
A:低温高压 B:低温低压 C:高温高压 D:高温低压
A:各种分子间的作用相等, 各种分子的体积大小相等 B:所有分子都可看作一个质点, 并且它们具有相等的能量 C:分子间无作用力, 分子本身无体积 D:分子不断地作无规则运动、它们均匀分布在整个容器中
A: B: C: D:
A:21% B:61% C:72% D:39%
A:任意过程的Q + W B:恒容、无其它功过程的Q C:等温可逆过程的W D:绝热过程的W
A: B: C: D:
A:P必不随T而变 B:P随T之升高可变大或减少 C:P必随T之升高而变大 D:P必随T之升高而降低
A:无相变,温度恒定,自由度f*为0 B:有相变,温度恒定,自由度f*为0 C:有相变,温度变化,自由度f*为1 D:无相变,温度变化,自由度f*为1
A: B: C: D:
A:最低 B:最高或最低 C:最高 D:不确定
A:2nRln2 B:-nRln2 C:0 D:nRln2
A:1 B:3 C:2 D:4
A:热力学能守恒,焓守恒 B:热力学能、焓均不一定守恒 C:热力学能不一定守恒,焓守恒、 D:热力学能守恒,焓不一定守恒
AI参考:正确答案是D:热力学能守恒,焓不一定守恒。在隔离系统内,只有热力学能守恒,焓不一定守恒。隔离系统是指在没有热交换、没有物质交换的条件下,各个部分都是独立、封闭的系统。因此,在这个系统中,系统的总热力学能不会发生变化,但是焓值可能会发生变化,因为焓值除了包含热力学能之外,还包含其他因素,如物质的状态变化等。因此,答案为D。'
A:2 J B:3 J C:5 J D:9 J
A:根据杠杆规则,W(α):W(β)=bx:xc B:在帽形线以内Φ=2,帽形线以外Φ=1 C:在帽形线以内两液相各自的质量百分比不变 D:在帽形线以内两液相的平衡组成不变
A:曲线② B:曲线④ C:曲线① D:曲线③
A:可逆过程熵变为零 B:熵与系统的微观状态数有关 C:每单位温度的改变所交换的热为熵 D:不可逆过程熵将增加
A:该体系是具有最低恒沸点的部分互溶的双液系 B:该体系是具有最低蒸气压的双液系 C:用精馏的办法可将 A、B两液体分开 D:用精馏的办法可得到纯 A或纯 B
AI参考:正确选项为:B:该体系是具有最低蒸气压的双液系解释:根据图中的数据,该体系具有最低蒸气压,因此是双液系。同时,由于体系具有部分互溶的性质,因此属于部分互溶的双液系。但是,由于该体系具有最低恒沸点,所以不能用精馏的办法得到纯A或纯B,因为这会导致过热现象,使得无法达到预期的纯度。因此,选项B是正确的。选项A和C也是正确的,但与图中的数据不符;选项D则是错误的,因为精馏不能得到纯A或纯B。总的来说,选择B作为正确答案是最符合图示数据和相关物理化学原理的。'
A:熵增加 B:热力学能不变 C:热力学能增加 D:熵不变
A:溶液的化学势等于溶液中各组分的化学势之和 B:对于纯组分,则化学势等于其吉布斯自由能 C:理想液态混合物中各组分在其全部浓度范围内服从拉乌尔定律 D:理想液态混合物中各组分分子间引力和分子体积都相仿
AI参考:正确答案是:AB。溶液的化学势是指溶质与溶剂的化学势之和,选项A正确;对于纯组分,其化学势等于其吉布斯自由能,选项B正确;理想液态混合物中各组分在某一定范围内服从拉乌尔定律,而非全部浓度范围内,选项C错误;理想液态混合物中各组分分子间不存在着相互作用力,所以引力和分子体积并不相仿,选项D错误。综上所述,本题答案为AB。'
A:ΔA B:ΔH C:ΔG D:ΔU
A:ΔH B:ΔA C:ΔG D:ΔU
A: B: C: D:
AI参考:化学势是一个化学和热力学的概念,它描述了物质在化学反应或热力学过程中自发地向系统内扩散的能力。在给出的选项中,选项A、C和D都是化学势的正确选项。选项A可能指的是某个化学物质的化学势,选项C可能指的是某种混合物的化学势,而选项D则可能指的是某个化学反应的化学势。这些选项都涉及到化学势的概念,因此它们都是正确的答案。请注意,这只是基于题目的理解所给出的答案,具体的答案可能会根据具体的上下文和定义而有所不同。'
A:恒压下加入惰性气体; B:降低压力; C:降低温度; D:增加压力; E:升高温度;
AI参考:正确选项为A:恒压下加入惰性气体这是一个涉及到化学平衡移动的问题。为了使平衡向右移动,我们可以从平衡常数角度来考虑。平衡常数的大小与温度和压力有关。在温度不变的情况下,增加压力会使平衡向气体体积减小的方向移动,也就是向右移动。而加入惰性气体可以增加系统的总压强,相当于增加压力,因此可以使平衡向右移动。其他选项B、D、E对于平衡移动的影响与实际情况不符。降低温度会使平衡向左移动,而降低压力则会使平衡向气体体积增大的方向移动,即向左移动。因此,正确答案为A:恒压下加入惰性气体。'
A: B: C: D:
AI参考:正确选项为C,压力会影响化学反应的平衡状态,当压力变化时,平衡会朝着使压力降低的方向移动,从而导致化学反应速率的变化。因此,当压力改变时,C选项的值也会发生变化。其他选项A、B、D的值通常不会因压力变化而发生变化。'
A:ΔG B:ΔH C:ΔU D:ΔA
温馨提示支付 ¥2.05 元后可查看付费内容,请先翻页预览!

