第二章一个在任何温度下都能自发的反应,属于下列哪种情况
△H >0, △S>0
△H< 0, △S>0
△H <0, △S<0
答案:△H< 0, △S>0
如果一个反应的吉布斯自由能变为零,则反应
是放热反应
是吸热反应
能自发进行
答案:处于平衡状态
对于某一反应,有催化剂和无催化剂作用时,下列说法正确的是
催化反应比无催化反应的焓变大
两种反应的正反应速率一样大
催化反应比无催化反应的平衡常数大
答案:催化反应比无催化反应的活化能小
已知反应aA + bBcC,当cA、cB各增大一倍时,反应速率变为原来的两倍,则该反应的反应级数为
答案:1
下列叙述正确的是
在恒压下,凡是自发的过程一定是熵增的
焓是状态函数,而恒压反应的焓变等于恒压反应热,故热也是状态函数
单质在298.15K时,Smθ为零
答案:恒温恒压不做非体积功的条件下,体系自由能减少的过程都是自发进行的
反应2A(g) =C (g) △H >0,提高A(g)的转化率的方法有
低温高压
高温低压
高温高压
答案:高温高压
已知某反应的△H<0, △S<0, 下列叙述正确的是
低温时正反应可以自发进行
高温时正反应可以自发进行
任何温度下反应自发进行
答案:低温时正反应可以自发进行
下列纯态物质中,标准摩尔生成自由能变不等于零的是
Hg (l)
Fe (s)
Br2 (g)
答案:Br2 (g)
当速率常数的单位为S-1时,反应级数为
答案:1
对一个特定反应来讲,有关标准平衡常数Kθ的描述,错误的是
减少产物浓度,Kθ不变
加入催化剂,Kθ不变
改变反应温度,Kθ不变
答案:改变反应温度,Kθ不变
催化剂能加快反应的速率,它的作用机理是
增大碰撞频率
改变反应途径,降低活化能
增大平衡常数
答案:改变反应途径,降低活化能
反应2A(g) + B(s) →C (g) △H<0,提高A(g)的转化率的方法有
高温低压
高温高压
低温低压
答案:低温高压
已知某反应的高温时正反应可以自发进行,则△H, △S的取值为
△H<0, △S>0
△H>0, △S>0
△H<0, △S<0
答案:△H>0, △S>0
质量作用定律适用于任何化学反应
答案:错
冰在室温下自动熔化成水,是熵增起了主要作用
答案:对
放热反应均是自发反应
答案:错
平衡常数和转化率都能表示反应进行的程度,但平衡常数与浓度无关,而转化率与浓度有关
答案:对
放热、且混乱度变小的反应一定是自发反应
答案:错
平衡常数是衡量反应进行程度的特征常数,其大小只与温度有关,与计量数无关
答案:错
质量作用定律只适用于一级反应
答案:错
质量作用定律适用于双分子的简单化学反应
答案:错
当化学反应处于平衡状态时,正逆反应速率相等,反应混合物中各组分的平衡浓度相等
答案:错
质量作用定律只适用于单分子反应的基元反应
答案:错
平衡常数和转化率均表示反应进行的程度,但平衡常数与浓度无关,而转化率与浓度有关
答案:对
下列反应达平衡时,2 SO2(g) + O2 (g) = 2 SO3 (g) , 保持体积不变,加入惰性气体使总压力增加一倍,则
条件不足,不能判断
衡向右移动
平衡不发生移动
答案:平衡不发生移动
已知在一定温度下SnO2(s) + 2H2(g)Sn(s) + 2H2O(g) K1θ= 21.0CO(g) + H2O(g)CO2(g) + H2(g) K2θ= 0.0340因此下列反应SnO2(s) + 2CO(g)Sn(s) + 2CO2(g) 的K3θ值为
0.714
21.1
0.0243
答案:0.0243
已知:
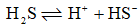 的
的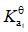 ;
;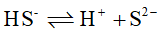 的
的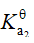 ;
;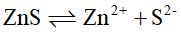 的
的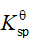 ,则反应
,则反应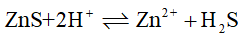 的
的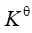 等于
等于答案:
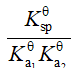
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!

