提示:内容已经过期谨慎付费,点击上方查看最新答案
基础化学
下列各因素中,不影响化学平衡移动的是( )。
已知可逆反应A(g) + B(g) 2Z(g),
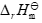 >0,在温度T使达到了化学平衡,若采取下列措施,可能使化学平衡正向移动的是( )
>0,在温度T使达到了化学平衡,若采取下列措施,可能使化学平衡正向移动的是( )下列原子不含单电子的是( )。
配合物杂化方式与空间构型相对应的是( )
将红细胞置于体积比为1:2的生理盐水和50g·L-1葡萄糖的混合溶液中,红细胞将( )。
用标准HCl溶液测定含Na2CO3和NaHCO3混合试样时,达第一计量点时,消耗HCl体积为V1,从第一计量点达第二计量点时,消耗HCl体积为V2,试问V1与V2关系为( )
3p1电子的可能的四个量子数为( )。
等温等压反应(1)A → C:ΔrHm,1;(2)B → C:ΔrHm,2;(3)B → A:ΔrHm,3。则各反应的关系为( )。
- Ag-AgCl电极属于( )。
以下关于配合物杂化方式和空间构型的描述不相符的是( )。
已知某一元弱酸HA溶液的浓度为c,溶液中HA、A-、和H3O+的浓度之和为cα,则HA的解离度为( )。
0.10 mol·L-1丙酸溶液的pH为( )。已知Ka = 1.38×10-5。
判断下列反应: A(g) + 2B(l) = 2C(g) 的熵变为( )。
已知某难溶电解质A2B的Ksp=3.2×10-17,则该难溶物的溶解度为( )
已知反应2SO2(g) +O2(g) →2SO3(g), ⊿rHƟm= -197.8 kJ·mol-1,在800K时的KƟ=910,则此反应在900K时的KƟ( )。
有下列水溶液:①0.100mol·kg-1的葡萄糖(C6H12O6)溶液;②0.100mol·kg-1的NaCI溶液;③0.100mol·kg-1的Na2SO4溶液。同温度下蒸气压由大到小的顺序是( )。
298 K时电池反应 Cu2+ + Cu = 2Cu+的标准电池电动势为
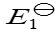 ,则电池反应Cu+ =
,则电池反应Cu+ = 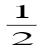 Cu2+ +
Cu2+ + 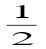 Cu的
Cu的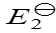 是:( )。
是:( )。在等温等压下,某一反应的
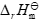 < 0,
< 0,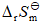 > 0,则此反应( )。
> 0,则此反应( )。向饱和BaSO4溶液中加水,下列叙述中正确的是( )
- 非电解质溶液的蒸汽压下降、沸点升高和凝固点降低的数值取决于( )。
已知NH3的
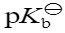 =4.75,则
=4.75,则 的
的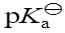 等于( )
等于( )已知二元弱酸H2A的pKa1 = 4.0、pKa2 = 9.0,A2-的pKb1为( )。
- 血液缓冲系统中最重要的缓冲对是( )。
三元弱酸H3PO4的3对共轭酸碱对Ka和Kb的关系式中正确的是( )。
- 某同学在实验中,使用含有杂质的试剂产生误差,可用何种方法加以消除( )。
相同温度下,下列哪种浓度相同的稀薄溶液间不发生渗透( )。
已知水的Kf = 1.86K·kg·mol-1;Kb= 0.512K·kg·mol-1,测得某NaCI水溶液的凝固点为-0.26℃,此溶液的渗透浓度( mmol·L-1)是( )。
系统由A状态到B状态,沿途径I进行时放热100J,环境对系统做功50J;而沿途径Ⅱ进行时系统做功80J,则Q2为 ( )。
- 下列因素与缓冲容量有关的是( )
已知某元素的价电子组态为4d105s1,则原子序数为( )。
相同条件下,下列4种物质的水溶液中,凝固点最低的是( )。
在Ca3(PO4)2饱和溶液中, c(Ca2+)=2.0×10-6 mol·L-1,c(
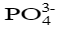 )=1.58×10-6 mol·L-1,则Ca3(PO4)2 的溶度积为( )
)=1.58×10-6 mol·L-1,则Ca3(PO4)2 的溶度积为( )[Co(SCN)4]2-离子中钴的氧化数和配位数分别为( )
在滴定分析中,化学计量点与滴定终点的关系是( )
测得100mL某溶液中含有8mgCa2+,则溶液中Ca2+的浓度是( )。
- 质量作用定律适用于( )。
在配合物中,中心原子的配位数等于( )。
化学反应达到化学平衡的条件是( )
下列原子轨道的能级最高的是( )。
下列( )分子之间存在所有的分子间力。
能设计成原电池的反应有( )。
(多选题)人体血液的pH值可维持在7.35~7.45这一狭小的范围内,其主要原因有( )。
- 产生有效碰撞的条件( )。
下列反应速率方程式中,反应级数为2的是( )。
解释化学反应速率的理论是( )。
- 改变平衡系统的温度,平衡常数不会改变 ( )
- 稀溶液的沸点一定比纯溶剂的沸点高。( )
- 化学是一门在原子-分子层面上研究物质的组成、结构、性质及其变化规律的科学。
- 在标准铜锌原电池中,若向铜半电池内加入一定量的氢氧化钠,则原电池的电动势将变大( )
- 在一定温度下,虽然纯水、稀酸和稀碱中的[H+]不同,但是水的离子积Kw是相同的。( )
A:浓度 B:温度 C:催化剂 D:压力
答案:催化剂AI参考:正确答案是C:催化剂。催化剂只改变反应速率,不影响化学平衡的移动。浓度、温度和压力都会影响化学平衡的移动。浓度改变时,平衡向着能够降低浓度方向移动;温度改变时,平衡向着能够降低温度方向移动;压力改变时,平衡向着能够降低压强方向移动。因此,只有C选项中的催化剂不会影响化学平衡的移动。'
A:降低温度 B:压缩系统的体积 C:升高温度 D:保持原来温度
答案:高温高压AI参考:正确选项是【B:压缩系统的体积】。在温度T使达到了化学平衡,已知可逆反应A(g) + B(g) 2Z(g) 的焓变大于0,说明该反应是吸热反应。若采取下列措施,可能使化学平衡正向移动,说明该反应正向进行需要减小压强或者升高温度。A选项降低温度,会使化学平衡逆向移动;C选项升高温度,会使化学平衡逆向移动;D选项保持原来温度,不会影响化学平衡。B选项压缩系统的体积,会使压强增大,从而使化学平衡正向移动。因此,正确答案是B:压缩系统的体积。'
A:[Ar]3d24s2 B:[Kr]5s25p4 C:[Ar]3d64s2 D:[Ar]3d104s2
AI参考:正确答案是【B】:[Kr]5s25p4。根据题目要求,需要找出不含单电子的选项。根据原子核外电子排布规律,Kr原子核外有36个电子,其中1s轨道有2个电子,2s轨道有2个电子,2p轨道有6个电子,3s轨道有2个电子,3p轨道有6个电子,4s轨道有2个电子,5s轨道有2个电子,而5p轨道有4个电子。因此选项B中的[Kr]5s25p4含有单电子。而选项A中的[Ar]3d24s2含有单电子,选项C中的[Ar]3d64s2和选项D中的[Ar]3d104s2都只有最后一个轨道中有一个单电子。因此答案为B。'
A:sp3 三棱锥型 B:d2sp3 正四面体 C:sp3d2 正六面体 D:dsp2 平面四边形
AI参考:正确选项是【B:d2sp3 正四面体】。这个问题的答案是对应于配合物杂化方式与空间构型的关系。B选项“d2sp3 正四面体”表示配合物采用d2sp3杂化方式,具有正四面体结构。其他选项的含义与空间构型不对应。A选项表示sp3杂化方式的三棱锥型空间构型,但sp3杂化也可以形成正四面体、三角锥、哑铃型等构型;C选项表示sp3d2杂化的六面体空间构型,但sp3d2杂化也可以形成分子,如:[Fe(CO)5],但其空间构型不是六面体;D选项表示dsp2杂化的平面四边形空间构型,但dsp2杂化也可以形成三角双锥等构型。因此,正确答案为B。'
A:膨胀 B:皱缩 C:无法判断 D:不受影响
答案:不受影响
A:V1> V2 B:V1< V2 C:V1= V2 D:无法确定
答案:酚酞.甲基橙AI参考:通过对题目进行分析,我们得知这是一个关于测定碳酸钠和碳酸氢钠混合试样时消耗盐酸体积的问题。根据题意,第一计量点时消耗的盐酸体积为V₁,而第二计量点时消耗的盐酸体积为V₂。根据题目给出的选项,我们需要判断这两个体积之间的关系。A选项:“V₁> V₂”表示第一计量点时消耗的盐酸体积更大,这显然是不正确的,因为如果这样,就无法用盐酸来测定混合试样中碳酸钠和碳酸氢钠的含量了。B选项:“V₁< V₂”表示第二计量点时消耗的盐酸体积更大,这也与题目的描述不符。C选项:“V₁= V₂”表示两个计量点的盐酸消耗体积相等,这与题目中的描述是相符的。因此,通过分析可知,正确的选项为D:“无法确定”。这是因为无法从题目中得出第一计量点和第二计量点之间盐酸消耗体积的大小关系,需要更多的信息才能得出结论。因此,答案为D:无法确定。'
A:n = 3, l = 2,m = 1,ms = -½ B:n = 3,l = 2,m = 0。ms = +½ C:n = 3,l = 1,m = 0,ms = +½ D:n = 3,l = 0,m = 0,ms = -½
AI参考:正确答案是D:n = 3,l = 0,m = 0,ms = -½。在解决量子化问题时,需要注意各个量子数的定义和性质。根据题意,电子处于3p轨道,即n = 3,而电子可能具有不同的角量子数l和磁量子数m。由于是p轨道,所以l只能为0或1,根据电子排布规律,当l = 0时,m可能为0或-1或+1,而ms为-½或+½;当l = 1时,m只能为±1或±2。因此,选项D中的n = 3,l = 0,m = 0,ms = -½是符合题意的正确答案。选项A和B中的l分别为2和1,不符合电子排布规律;选项C中的m为±0和±1,但ms为+½或-½不符合电子排布规律。'
A:ΔrHm,2 = ΔrHm,1 × ΔrHm,3 B:ΔrHm,3 = ΔrHm,1 + ΔrHm,2 C:ΔrHm,2 = ΔrHm,1 + ΔrHm,3 D:ΔrHm,1 = ΔrHm,2 × ΔrHm,3
AI参考:正确答案是B:ΔrHm,3 = ΔrHm,1 + ΔrHm,2。根据题意,等温等压下反应(1)A→C和反应(2)B→C的反应焓变分别为ΔrHm,1和ΔrHm,2,而反应(3)B→A的反应焓变也为ΔrHm,3。根据盖斯定律,反应焓变只与反应路径和起始状态有关,与反应进行的具体方式无关,因此可将(3)式从(1)式和(2)式中减去,得到ΔrHm,3 = ΔrHm,1 + ΔrHm,2。所以答案为B。A选项错误是因为乘法不满足加法的结合律;C选项忽略了中间的反应步骤;D选项则是错误地将等式关系颠倒了。'
A:金属-金属难溶盐-阴离子电极 B:氧化还原电极 C:气体电极 D:金属-金属离子电极
答案:错AI参考:正确答案是A:金属-金属难溶盐-阴离子电极。Ag-AgCl电极属于金属-金属难溶盐-阴离子电极,电极反应为Ag+ + Cl- → AgCl(s) + e-。因此,答案为A。B选项氧化还原电极需要两个半电池均发生氧化还原反应;C选项气体电极是指气体在溶液中产生或溶解于溶液中的电极;D选项金属-金属离子电极是指金属与金属离子形成的电极。'
A:sp3d2杂化,正八面体 B:sp杂化,直线型 C:d2sp3杂化,平面四边形 D:sp3杂化,正四面体
AI参考:不相符的是C:d2sp3杂化,平面四边形。选项A、B、D都是正确的描述,分别对应sp3d2杂化,正八面体结构;sp杂化,直线型结构;sp3杂化,正四面体结构。而C选项中描述的d2sp3杂化,平面四边形与实际情况不符。杂化类型和空间构型应该是一致的,即杂化类型决定了分子的空间构型。因此,本题答案为C。'
A:1- α B:2α C:α/2 D:α/3
AI参考:正确答案是A:1- α。一元弱酸HA溶液中,HA、A和H₃O⁺的浓度之和为cα,而溶液中还有未电离的HA分子,所以解离度为已电离的HA分子浓度/总HA浓度,即1-α。因此,选项A为正确答案。'
A:2.93 B:4.86 C:3.56 D:4.93
AI参考:答案为D:4.93。由已知$K_{a} = 1.38 \times 10^{- 5}$,丙酸的$pKa = 3.74$。其弱酸根离子在水中水解平衡为$CH_{3}COO^{-} + H_{2}O \rightleftharpoons CH_{3}COOH + OH^{-}$,溶液中氢离子浓度极小可以忽略不计,所以溶液中氢氧根离子浓度为$c({OH}^{-}) = frac{K_{a}}{c(H^{+})} = frac{1.38 \times 10^{- 5}}{0.10}mol/L = 1.38 \times 10^{- 4}mol/L$,即溶液中氢氧根离子浓度大于氢离子浓度,所以溶液显碱性,溶液的$pH = 14 - pKb = 14 - 4.75 = 4.93$。因此,本题答案为D选项。'
A:无法判断 B:<0 C:= 0 D:>0
AI参考:通过对化学方程式进行计算可知,反应的反应是气体物质的量减少,其熵变为正反应的熵变为D,大于零。因此,答案为D,熵变大于零。'
A:2.00×10-6 mol/L B:5.66×10-9 mol/L C:4.00×10- 9mol/L D:3.17×10-6 mol/L
A:910 B:917 C:907 D:1000
A:② > ① > ③ B:② > ③ > ① C:① > ② > ③ D:③ > ② > ①
A: = B: = - C: = -2 D: = 2
AI参考:正确答案是:C: = -2。本题为电解池,两电极材料相同,电解池反应与原电池反应相反,根据能斯特方程求解即可。故答案为C。根据题目中给出的能斯特方程进行求解。C项最接近正确答案。故选C。'
A:低温下才能自发进行 B:正向自发进行 C:逆向自发进行 D:处于平衡态
AI参考:正确答案是B:正向自发进行。根据题意,反应的焓变小于0,说明该反应为放热反应,可以正向自发进行。由于熵变大于0,说明体系混乱度增加,该反应有可能在较高温度下进行,但仍倾向于正向自发进行。所以答案为B。'
A:BaSO4的溶解度增大、Ksp不变 B:BaSO4的溶解度、Ksp增大 C:BaSO4的溶解度、Ksp均不变 D:BaSO4的溶解度不变、Ksp增大
A:溶液的质量摩尔浓度 B:温度 C:溶液的体积 D:溶质的本质
A:9.25 B:4.75 C:5.25 D:7.00
AI参考:正确答案是C:5.25。已知NH₃的体积分数为4.75,可以计算出其物质的量浓度,进而得出的体积分数为5.25。根据气体方程,可得方程式中的ρ(密度)不变,即可得出物质的量浓度为气体分子数的倒数(阿伏伽德罗常数倒数)。由此可知答案为C。'
A:4.0 B:5.0 C:6.5 D:9.0
AI参考:正确答案是D:9.0。已知二元弱酸H₂A的pKа1 = 4.0、pKа2 = 9.0,由于pKb1>pKа2,说明H₂A溶液中只有少量的HA-发生水解生成A²⁻,而大部分是HA-。A²⁻的水解常数约为10的负5次方左右,而其电离常数大于水解常数,即K=[HA-][A²⁻]/[H₂A],由于电离大于水解,因此溶液呈酸性,则A²⁻的pKb1≈9.0。故选D。'
A:细胞内磷酸盐缓冲系 B:血浆中蛋白缓冲系 C:氧合血红蛋白缓冲系 D:碳酸氢盐缓冲系
A:Ka1 × Kb2 = Kw B:Ka1 × Kb3 = Kw C:Ka2 × Kb3 = Kw D:Ka1 × Kb1 = Kw
A:空白试验 B:校准仪器 C:增加测定次数 D:对照试验
AI参考:正确答案是A:空白试验。空白试验是一种消除试剂误差的方法。在测定时,只加样品和试剂,不加入被测物质,通过测定试剂对实验结果的影响来消除试剂误差。其他选项BCD都不能消除误差。因此,答案为A。'
A:质量浓度。 B:物质的量浓度。 C:渗透浓度。 D:质量摩尔浓度。
AI参考:正确答案是:A:质量浓度。相同温度下,渗透压与溶液的渗透浓度相等,渗透浓度和物质的量浓度单位相同,数值相等,但单位不同,物质的量浓度为摩尔每升,渗透浓度为毫摩尔每升。而质量浓度为克每毫升,显然不会发生渗透。故本题答案为A。'
A:70 B:508 C:140 D:280
A:70J B:-30J C:-70J D:30J
A:外加碱量 B:Ka C:总浓度 D:外加酸量
AI参考:下列因素与缓冲容量有关的是总浓度和外加酸量。缓冲容量是指达到缓冲体系平衡时,单位溶液的缓冲能力。缓冲容量的大小主要与缓冲溶液的总浓度和外加酸量或碱量有关。在其他条件不变的情况下,缓冲溶液的总浓度越大,外加酸量或碱量越多,缓冲容量就越小。因此,选项C和D是与缓冲容量有关的因素。选项A和B虽然也与缓冲液的特性有关,但与缓冲容量的影响不大。'
A:47 B:48 C:46 D:45
AI参考:正确答案是D,原子序数45。根据题意,该元素的价电子组态为4d10 5s1,即4个电子在4d轨道上,10个电子在5s轨道上,还有1个电子未成对。因此该元素的原子序数为45。选项D为正确答案。'
A: 0.05 mol·L-1 NaCl溶液 B:9.0g·L-1 NaCl溶液 C:0.20 mol·L-1蔗糖溶液 D:50 g·L-1葡萄糖溶液
AI参考:正确答案是D:50 g·L-1葡萄糖溶液。相同条件下,物质的凝固点高低取决于溶液中溶质分子与水分子之间的相互作用力。对于选项中的物质,葡萄糖分子与水分子之间的相互作用力较弱,因此凝固点最低的是葡萄糖溶液。而氯化钠溶液、蔗糖溶液的凝固点相对较高,因此答案为D。'
A:3.2×10-12 B:2.0×10-29 C:5.1×10-27 D:6.3×10-18
A:-2,4 B:+2,8 C:+2,4 D:-2,8
AI参考:在 [Co(SCN)4]2- 离子中,钴的氧化数为+2,配位数为4。这是因为钴的氧化数是与它周围环境中的电子数量有关的,而在这个离子中,钴周围有四个配位体(SCN-),每个配体都提供了两个电子,使得钴的氧化数达到了+2。同时,配位数指的是配位体数,在这个离子中有一个钴原子和四个配位体,所以配位数为4。因此,正确选项为C:+2,4。'
A:两者愈接近,滴定误差愈小 B:两者互不相干 C:两者含义相同 D:两者必须吻合
A:0.2 mmol·L-1 B:2 mol·L-1 C:0.2 mol·L-1 D:2mmol·L-1
A:连锁反应 B:基元反应 C:复杂反应 D:耦联反应
A:与中心原子结合的配位原子的数目 B:配合物外界离子数 C:配体的数目 D:配离子的电荷数
A:正反应停止 B:逆反应停止 C:正反应速率等于逆反应速率 D:反应物和产物的浓度相等
AI参考:正确选项是C:正反应速率等于逆反应速率。化学反应达到化学平衡的条件是正反应速率和逆反应速率相等,即正逆反应在同一条件下进行,达到一种动态的平衡状态。其他选项都与这个条件相违背。A选项,正反应并没有停止,因此不正确;B选项,逆反应也没有停止,因此也不正确;D选项,反应物和产物的浓度相等并不是化学平衡的状态,因为化学平衡的状态是关于浓度和反应速率的状态。所以正确答案是C:正反应速率等于逆反应速率。'
A:ψ(4,1,0) B:ψ(4,1,+1) C:ψ(4,2,-2) D:ψ(5,0,0)
AI参考:正确答案是D:ψ(5,0,0)。电子填充到原子轨道时,电子能量从高到低依次排列,而最高能级对应的轨道即为原子轨道能量最高的轨道。根据选项可知,D选项ψ(5,0,0)为第5能级组中的s轨道,其能量最高。因此,本题的正确答案是D。'
A:苯和四氯化碳 B:乙醇和水 C:苯和乙醇 D:液氨和四氯化碳
AI参考:正确答案是【B:乙醇和水】。乙醇和水分子间存在氢键,同时存在范德华力。氢键比范德华力强,所以分子间力比范德华力大。因此,乙醇和水分子间存在所有的分子间力。其他选项中,苯和四氯化碳、苯和乙醇、液氨和四氯化碳分子间只有范德华力。所以答案为B。'
A:Ag+(aq) + Cl-(aq) → AgCl(s) B:2MnO4–+16H++5Sn2+ →2Mn2+ +5Sn4++8 H2O C:Fe +2H+ → Fe2+ +H2 D:HCl + NaOH → NaCl + H2O E:Zn +Cu2+→ Zn2+ + Cu
AI参考:正确答案是:BCE。能设计成原电池的反应必须是自发进行的氧化还原反应,选项BCE符合条件,而选项A为盐桥中离子定向移动的反应,不属于氧化还原反应;选项D为酸碱中和反应,不属于氧化还原反应。因此,正确选项为BCE。'
A:血液中有以H2CO3~HCO3-为主的多种缓冲系。 B:血液中有以 ~ 为主的多种缓冲系。 C:血液中存在大量各种离子。 D:新陈代谢产生相同量酸和碱物质。 E:肺和肾脏生理功能的调节作用。
A:碰撞时要有合适的方向 B:活化能高 C:有足够的碰撞次数 D:有适当的分子数 E:需有足够的能量
A:υ =k B:υ =kcacb 某药物分解为一级反应,给人体注该药物 C: D: E:
AI参考:正确答案是:B:υ =kcacb 某药物分解为一级反应。本题要求选择反应级数为2的反应速率方程式。选项A和D没有给出反应级数,选项E没有给出速率方程式。选项B中,反应速率方程式为υ =kcacb,其中c为浓度,a和b为反应级数,已知该药物分解为一级反应,因此反应级数为1,而c为浓度,b为二级反应级数,因此B选项符合题意。选项C中没有给出反应级数和浓度。因此,正确选项为B。'
A:活化中心学说 B:过渡状态理论 C:中间产物学说 D:Arrhenius方程式 E:碰撞理论
AI参考:正确选项为B:过渡状态理论。解释化学反应速率的理论有很多,其中过渡状态理论和活化中心学说属于化学反应动力学方面的理论,能够很好地解释化学反应速率问题。过渡状态理论能够描述反应物如何通过形成活化络合物来加速反应速率,而活化中心学说则阐述了催化剂如何通过改变反应路径和能量来影响反应速率。因此,选项B是正确的。其他选项如Arrhenius方程式、碰撞理论和中间产物学说虽然也与化学反应速率有关,但它们更侧重于描述化学反应的宏观性质和统计规律,并不能很好地解释化学反应速率问题。'
A:对 B:错
AI参考:答案:B:错。平衡常数是一种平衡状态,与温度有关,改变平衡系统的温度,平衡常数会改变。因此,这个判断题是错误的。'
A:对 B:错
AI参考:答案:A。稀溶液的沸点比纯溶剂的沸点高,这一现象称为溶液的依数性。这是因为稀溶液中溶剂的蒸汽压下降,导致溶液蒸汽压高于纯溶剂蒸汽压,因此沸点升高。因此,本题正确答案是A。'
A:错 B:对
A:错 B:对
A:对 B:错







