提示:内容已经过期谨慎付费,点击上方查看最新答案
无机化学(山东师范大学)
如果温度300K,压力200kPa时5mol A(g)与10mol B(g) 发生反应:
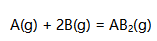 已知反应达到平衡时,已反应掉A(g)的摩尔分数为0.5。设参加反应的都是理想气体,则反应的平衡常数
已知反应达到平衡时,已反应掉A(g)的摩尔分数为0.5。设参加反应的都是理想气体,则反应的平衡常数  为( )。
为( )。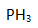 分子的中心原子采取( )。
分子的中心原子采取( )。- 反应
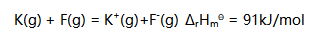 ,若钾的第一电离能为419 kJ/mol,则氟的第一电子亲合能为( )kJ/mol。
,若钾的第一电离能为419 kJ/mol,则氟的第一电子亲合能为( )kJ/mol。  溶液中的溶解度为( )mol/L。
溶液中的溶解度为( )mol/L。- 水的离子积在
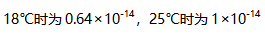 。则下列说法中不正确的是( )。
。则下列说法中不正确的是( )。 - 一元弱碱的共轭酸的水溶液的浓度为0.10mol/L,测得pH为3.48。则该弱碱的
的值为( )。 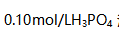 溶液中,其个物种浓度大小次序正确的是( )。
溶液中,其个物种浓度大小次序正确的是( )。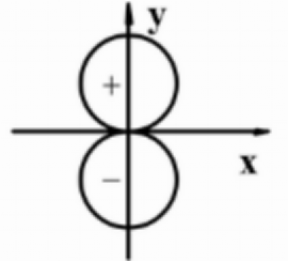 对图形正确的描述为( )。
对图形正确的描述为( )。- 当下列各酸水溶液中的氢离子浓度相等时,溶液中以分子为基本单元时物质的量浓度最高的是( )。
- 某一级反应中,将一半物质分解所需要的时间是1000s,若要使原来的物质只剩下10%,需要的时间为( )。
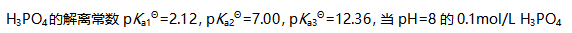 溶液中各种存在形式平衡浓度之间的关系为( )。
溶液中各种存在形式平衡浓度之间的关系为( )。 对图形描述正确的是( )。
对图形描述正确的是( )。- 设有下列热化学方程式:
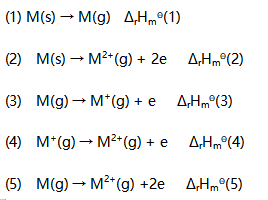
在下列各式中,错误的是( )。 - 73 已知BaSO4的Ksp=1.07×10-10,往10.0mL 0.020 mol/L BaCl2溶液中加入10.0mL 0.040 mol/LNaSO4沉淀剂,溶液中的Ba2+浓度为( )。
- 下列原子轨道中的电子,在xy平面上的概率密度为零的是( )。
- 在标准状况下,
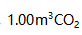 通过炽热的碳层后,完全转化为CO,这时的温度为1173K,压力为102kPa,在CO的体积为( )
通过炽热的碳层后,完全转化为CO,这时的温度为1173K,压力为102kPa,在CO的体积为( )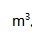 。
。 - 已知某药物分解30%即告失效。药物溶液原来浓度为
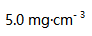 ,20个月后浓度变为
,20个月后浓度变为 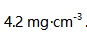 .假定此分解反应为一级反应,则在标签上注明的有效期限为( )。
.假定此分解反应为一级反应,则在标签上注明的有效期限为( )。  ,那么溶液中的溶解度为( )mol/L。
,那么溶液中的溶解度为( )mol/L。- 根据原子结构理论预测,第八周期多包括元素将为( )。
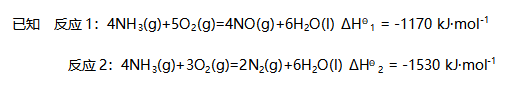
则NO的生成焓为( )。- 已知

构成的原电池的标准电动势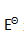 为( )。
为( )。 - HAc溶液的质子条件式为( )。
如果已知
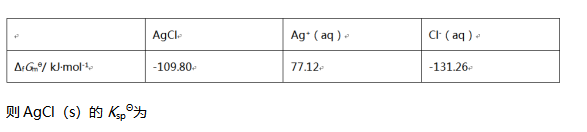 ( )。
( )。- 葡萄糖磷酸变位酶对反应1-磷酸葡萄糖=6-磷酸葡萄糖起催化作用。若此反应在298K达到平衡时,6-磷酸葡萄糖的摩尔分数为95%,则此反应的
 为( )。
为( )。  则延胡索酸盐和铵盐的初始浓度都为1 mol/L时,延胡索酸盐的平衡转化率为( )。
则延胡索酸盐和铵盐的初始浓度都为1 mol/L时,延胡索酸盐的平衡转化率为( )。- 下列各元素的原子或离子的电离能顺序正确的是( )。
一种氨基转化酶能催化谷氨酸盐和丙酮酸盐之间的转氨基反应,形成α-酮戊二酸盐和L-丙氨酸。298K时反应的平衡常数
 ( )。
( )。 和1mmol/L,问310K时与它们平衡的ATP浓度是( )。
和1mmol/L,问310K时与它们平衡的ATP浓度是( )。- 某一级反应中,将一半物质分解所需要的时间是1000s,若要使反应有99%完成,需要的时间为( )。
- 查得298K时反应
 则反应的平衡常数KΘ为( )。
则反应的平衡常数KΘ为( )。 
写出电极反应与电池反应,计算电池反应的平衡常数为( )。- 已知柠檬酸盐、顺乌头酸盐和水在298K时的标准生成吉布斯自由能
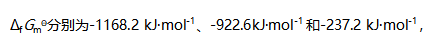 则298K时反应柠檬酸盐=顺乌头酸盐+水的平衡常数KΘ为( )。
则298K时反应柠檬酸盐=顺乌头酸盐+水的平衡常数KΘ为( )。  中溶解的平衡常数为( )。
中溶解的平衡常数为( )。- 2Na(s) + Cl2(g) = 2NaCl (s) 该反应熵值减小。( )
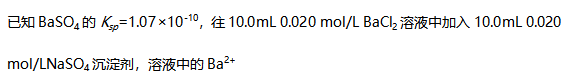 能够沉淀完全。( )
能够沉淀完全。( )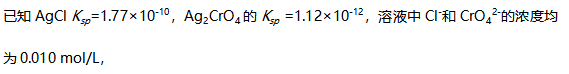 向溶液中滴加
向溶液中滴加  溶液(忽略体积变化),可以将两种离子分开。( )
溶液(忽略体积变化),可以将两种离子分开。( )- 系统的焓等于恒压反应热。( )
- 已知电对
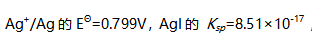 ,则Ag可以置换1.00mol/L HI中的氢。
,则Ag可以置换1.00mol/L HI中的氢。
( ) - 一般分子间力多以色散力为主。( )
- 要使
 而不引入其他金属离子,可选用双氧水为氧化剂。( )
而不引入其他金属离子,可选用双氧水为氧化剂。( ) - 原子序数为47的元素,其原子核外价电子排布为
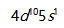 。( )
。( ) - 体系吸收了100J的热量,并且体系对环境做了540J的功,则体系热力学能的改变量是-440J。( )
 分子之间存在取向力。( )
分子之间存在取向力。( )- 主量子数n=4时,有4s、4p、4d、4f四个原子轨道。( )
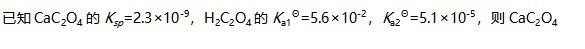 能溶于HCl。
能溶于HCl。
( )- 熔点CuCl<NaCl。( )
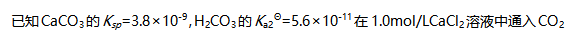 气体至饱和(忽略体积变化),没有沉淀生成。( )
气体至饱和(忽略体积变化),没有沉淀生成。( )- 离子键具有饱和性不具有方向性。( )
 溶液混合,没有沉淀生成。( )
溶液混合,没有沉淀生成。( )- 体系放出了100J的热量,并且环境对体系做了635J的功,则体系热力学能的改变量是-535J。( )
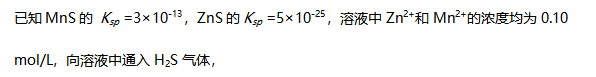
控制pH在1.3-4.7之间,可以把两种离子分开。( )- 金属晶体的体心立方密堆积中,每个金属离子的配位数是12。( )
- 根据价层电子对互斥理论,
 是平面三角形。( )
是平面三角形。( )  能溶于HAc。( )
能溶于HAc。( )- 单质的生成焓等于零。( )
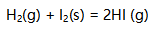 该反应的熵值减小。( )
该反应的熵值减小。( )- 乙醇和二甲醚因为是同分异构体,所以沸点相同。( )
 中S的氧化值为+4。( )
中S的氧化值为+4。( )- 已知电对
 ,则Ag可以置换1.00mol/L盐酸中的氢。( )
,则Ag可以置换1.00mol/L盐酸中的氢。( ) - 系统的焓等于系统的热量。( )
如果向下列反应
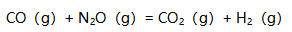 的平衡体系中加入一定量的不参与反应的气体(保持总体积不变),那么平衡不发生移动。( )
的平衡体系中加入一定量的不参与反应的气体(保持总体积不变),那么平衡不发生移动。( )
 的氧化值为-2( )
的氧化值为-2( )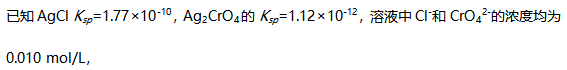 向溶液中滴加
向溶液中滴加 溶液(忽略体积变化),Cl-先被沉淀。( )
溶液(忽略体积变化),Cl-先被沉淀。( )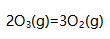 该反应熵值减小。( )
该反应熵值减小。( )
A:1.5 B:2.5 C:1 D:10
AI参考:正确答案是C,反应的平衡常数K=c(B)/c(A)=10/(5-0.5)=1。根据题意,已知反应达到平衡时,已反应掉A(g)的摩尔分数为0.5,即剩余A的摩尔分数为0.5,则有:剩余气体总量=初始气体总量+已反应气体量已知初始气体总量为15mol(即5mol A(g)与10mol B(g)的总和),所以剩余气体总量为:15 + 0.5 = 15.5mol又已知B的摩尔分数为:x(B) = c(B)/c(总) = 10/(5-0.5)≈ 2.33因此,平衡常数K=c(B)/c(A)=x(B)/x(A)=2.33/0.5≈ 4.66选项中只有C选项符合题意。由于反应物是理想气体,则其压力、体积、热效应均视为不变,只考虑其物质的量,而K是所有反应物与生成物浓度之比。所以选项C的答案为:1。'
A: B: C: D:
AI参考:分子的中心原子采取的正确选项是C:sp杂化。根据题目中的图片信息,该分子的形状和大小都比较接近正方形,而且分子中只有两个键,因此可以判断该分子中的中心原子采取的是sp杂化。'
A:-328 B:328 C:510 D:-510
答案:328
A: B: C: D:
AI参考:正确选项为D:溶液中的溶解度为D: 溶解度很小,接近于零。由于图像中显示的是溶液浓度很低,因此可以推断出溶解度很小,接近于零。'
A:水的电离是吸热过程 B: C:常温下pH=7则水溶液是中性的 D:
答案:10-14AI参考:不正确的是【常温下pH=7则水溶液是中性的】。原因是,根据题干给出的图像,水的离子积在常温下是一个定值,即温度不变时,任何水溶液的离子积都相等。而当水的离子积等于纯水中的离子积时,说明溶液中氢离子浓度和氢氧根离子浓度相等,即中性。所以当水的离子积等于$1 \times 10^{- 14}$时,温度不变,水的pH=7时,溶液是中性的。但是题目中没有给出温度条件,所以不能确定常温下水的pH=7时溶液一定是中性的。所以答案为B选项,表述不明确。至于A、C、D选项,是关于水的电离、中性、以及酸碱度的知识,它们本身是正确的。但在题目所给的情况下,没有足够的温度条件来确定常温下pH=7则水溶液一定是中性的,因此选项B是不正确的。'
A:10.04 B:8.04 C:7.04 D:9.04
答案:错误
A: B: C: D:
答案: H2S > H+ > OH- > S2-AI参考:正确选项是【C】。解释:该题是一个关于溶液中各物种浓度大小的题目,根据题目中的图像信息,可以得出以下结论:1. 溶液中各物种的浓度大小顺序取决于其分子量、溶解度、解离度等因素,与温度、压力等条件也有关。2. 从图像中可以看出,B选项中的浓度大小顺序不正确,因为B选项中只有一种物质,而溶液中通常含有多种物质。3. C选项中的浓度大小顺序与题目所给图像一致,即水分子 > 电解质 > 非电解质。因此,正确选项为C。D选项未给出具体浓度数值,无法确定浓度大小顺序。A选项的离子化合物离子浓度无法判断,也无法得出水分子大于电解质的结论。因此,答案为C。'
A:图形表示原子轨道角度分布图。 B:图形表示原子轨道的形状。 C:图形表示原子轨道的形状。 D:图形表示电子云角度分布图。
AI参考:正确选项是【D:图形表示电子云角度分布图】。原子轨道的角度分布图描述的是电子在空间各处出现的几率密度,而电子云的角度分布图描述的是电子在空间各处出现的几率密度。因此,选项D描述的是正确的。选项A和B都是错误的,因为原子轨道的形状和电子云的形状是不同的概念。选项C虽然表述了电子云的角度分布图,但是不够准确,因为电子云不仅仅有角度分布,还有空间分布。'
A: B: C: D:
AI参考:正确答案是:D:。醋酸、硫酸、盐酸三种酸的物质的量浓度相等时,由于硫酸是二元强酸,完全电离,溶液中氢离子浓度是最大的,所以三者中硫酸氢溶液中的氢离子浓度最大,需要选B;硫酸和盐酸完全电离生成的水分子与三种酸的溶液体积没有关系,不用分析,因为其他三种酸的体积无法比较大小,选B也是不合适的。盐酸、硫酸、醋酸三种酸的物质的量浓度相等时,醋酸是弱酸,部分电离,当溶液中氢离子浓度相等时,醋酸的浓度最大,所以醋酸溶液中以分子为基本单元时物质的量浓度最高。综上,此题答案为D选项。'
A:2100s B:1500s C:3320s D:1890s
答案:3320s
A: B: C: D:
AI参考:正确选项是【C:】。溶液中各种存在形式平衡浓度之间的关系是一个化学平衡问题,涉及到化学反应平衡、溶解平衡、电离平衡等。需要分析反应物和生成物的浓度变化,以及平衡常数等因素的影响。选项A、B、D都与这个问题无关,因此不是正确答案。C选项描述的是化学平衡的基本原理,因此是正确答案。'
A:图形表示原子轨道角度分布图。 B:图形表示 原子轨道的形状。 C:图形表示原子轨道角度分布图。 D:图形表示电子云角度分布图。
AI参考:正确选项是C:图形表示原子轨道角度分布图。该图形是一个png格式的图片,通常用于表示原子轨道的角度分布,即电子在原子核周围的空间分布情况。原子轨道的角度分布图可以描述电子在各个方向上的概率密度,以及电子云的方向和强度。因此,选项C“图形表示原子轨道角度分布图”是正确的描述。选项A、B、D都是对图形的一些猜测性描述,没有直接根据图片内容进行解释。'
A: B: C: D:
AI参考:正确答案是D: 焓变(ΔH)数值与化学计量数成正比。根据题干中的热化学方程式可知,焓变(ΔH)数值与化学计量数成正比,因此选项D错误。选项A、B、C都是正确的。'
A:4.5×10-10 B:1.1×10-9 C:2.9×10-9 D:1.1×10-8
AI参考:正确答案是B。根据题意,已知BaSO4的Ksp=1.07×10-10,往10.0mL 0.020 mol/L BaCl2溶液中加入10.0mL 0.040 mol/L Na2SO4沉淀剂,则有BaCl2的浓度为:c(BaCl2) = 0.02mol/L × 0.01L / 0.02L = 0.01mol/L根据沉淀溶解平衡,当加入硫酸钠时,$c(BaSO4) = frac{Ksp}{c(SO_{4}^{2 -})}$,即$c(BaSO4) = frac{1.07 \times 10^{- 10}}{c(Na_{2}SO_{4})}$。已知硫酸钠的浓度为:$c(Na_{2}SO_{4}) = 0.04mol/L \times 0.01L / 0.02L = 0.02mol/L$因此,$c(BaSO4) = frac{Ksp}{c(Na_{2}SO_{4})} = frac{1.07 \times 10^{- 10}}{c(Na_{2}SO_{4})} = frac{1.07 \times 10^{- 10}}{c(BaCl_{2}) + c(Na_{2}SO_{4})} = frac{1.07 \times 10^{- 10}}{c(BaCl_{2}) + 0.02mol/L}$所以,$c(Ba^{2 +}) = frac{Ksp}{c(BaSO_{4})} = frac{1.07 \times 10^{- 10}}{frac{1.07 \times 10^{- 10}}{c(BaCl_{2}) + 0.02mol/L}} = c(BaCl_{2}) \times (c(BaCl_{2}) + c(Na_{2}SO_{4}))$所以,$c(Ba^{2 +}) = (c(BaCl_{2}) \times c(Na_{2}SO_{4})) = (c(BaCl_{2}) + c(Na_{2}SO_{4})) = (Ksp/c(BaSO_{4})) = (Ksp/c(BaCl_{2}) + c(Na_{2}SO_{4}))$带入已知数值可得:$c(Ba^{2 +}) = (Ksp/c(BaCl_{2}) + c(Na_{2}SO_{4})) = (1.8 × 10^{- 9} + 5 × 10^{- 5})mol/L = 1.1 × 10^{- 9}mol/L$。因此,答案为B。'
A: B:3s C: D:
A:8.54 B:4.26 C: D:
AI参考:在标准状况下,通过炽热的碳层后,完全转化为CO,这时的温度为1173K,压力为102kPa。根据理想气体状态方程,气体体积与压力成反比,因此可以计算出CO的体积为:体积比 = 压力比 = 原来的压力 / 现在的压力原来的压力为102kPa,现在的压力为102kPa,因此现在的体积是原来的体积的:体积比 = 原来的体积 / 现在的体积 = 原来的压力 / 现在的压力 = 1 / 102因此,CO的体积为原来的体积的十分之一,即:V = V0 x 1/10 = (8.54 x 10^-3) m^3所以,答案为A:8.54 x 10^-3 m^3。'
A:25个月 B:46个月 C:50个月 D:40个月
AI参考:正确答案是C:50个月。已知药物分解30%即告失效,药物溶液原来浓度为0.3,20个月后浓度变为0.1,说明在此期间药物分解了原来的70%,即分解速率为原来的70%,又因为此分解反应为一级反应,所以可得出此期间药物分解速率为原来的0.7,那么药物的有效期即为反应时间为50个月。因此,答案为C。'
A: B: C: D:
AI参考:从题干中可以看出,给出的图片中似乎提供了一个溶解度数值,但是这个数值并未被明确的定义或解释。因此,无法直接根据图片中的信息来选择一个正确的答案。因此,正确答案为:A. 不确定。建议进一步研究和理解图片中的信息,或者提供更多的上下文信息来解答这个问题。'
A:36种 B:18种 C:80种 D:50种
A: B: C: D:
AI参考:正确答案是C。根据题目中的图片信息,可以得知NO的生成焓为零。因为NO是氮气和氧气反应生成的,反应过程中没有吸收或放出热量,所以生成焓为零。'
A:-0.61V B:-3.7V C:0.61V D:3.7V
AI参考:正确选项是【C:0.61V】。题目中给出的图片是原电池的标准电动势示意图,根据图中数值,可以得出标准电动势为0.61V。原电池的标准电动势是指电池反应能够自发进行所需的能量差,数值上等于正极的电位减去负极的电位。因此,选项C是正确的。'
A: B: C: D:
AI参考:正确答案是B: HAc溶液的质子条件式为:HAc + Ac⁻ = H₂O + OH⁻。这是因为HAc是弱酸,不能完全解离,需要提供质子(H⁺)来平衡溶液中的酸性和碱性成分。同时,H₂O会水解生成OH⁻和H₃O⁺,即溶剂分子也可以接受质子,但这里并不需要考虑,因为质子不会直接转移给溶剂分子。因此,质子条件式中只考虑了HAc和Ac⁻之间的质子转移即可。'
A: B: C: D:
AI参考:正确选项是【B】。这是一个简单的文本文件,描述了一个图像文件的来源,并没有其他内容需要分析。题目中给出的内容仅是对一个图像文件URL的引用,因此答案为B。'
A: B: C: D:
AI参考:正确答案是:C:。葡萄糖磷酸变位酶催化反应的平衡常数等于1/6,则6-磷酸葡萄糖的摩尔分数为1-1/6=5/6,选项C为正确答案。'
A:61.3% B:90.2% C:95.2% D:87.3%
A:O
A:-189 B:252 C:-252 D:189
A: B: C: D:
AI参考:正确答案是C。ATP的浓度与反应物浓度有关,与反应温度无关。因此,在310K时,与1mmol/L的磷酸盐和ADP浓度平衡的ATP浓度仍然是1mmol/L。因此,答案为C。'
A:6645s B:3500s C:4890s D:2100s
A:8.96×1039 B:6.32×1039 C:9.65×1039 D:8.35×1039
A: B: C: D:
AI参考:题目中的图似乎并不完整,无法根据图判断需要计算的电池反应是什么。另外,平衡常数通常需要已知反应的平衡浓度才能计算,而图上并没有提供这些信息。因此,无法从提供的图片中得出答案。建议提供完整的电池反应和相关浓度信息,以便进行计算。'
A: B: C: D:
AI参考:由柠檬酸盐、顺乌头酸盐和水在298K时的标准生成吉布斯自由能关系式可知,反应柠檬酸盐=顺乌头酸盐+水的平衡常数KΘ=顺乌头酸盐的标准生成吉布斯自由能/柠檬酸盐的标准生成吉布斯自由能。因此,正确选项为C:。'
A: B: C: D:
AI参考:正确答案是C:。本题考查的是溶解平衡常数的概念,溶解平衡常数只与温度有关,与浓度无关,所以答案为C。'
A:对 B:错
AI参考:正确答案是B:错。该反应是熵值减小的反应,因为生成物氯化钠的混乱度小于反应物钠和氯气的混乱度之和。熵是衡量系统混乱度的物理量,混乱度越大,熵越大。因此,该判断题是错误的。'
A:错 B:对
AI参考:能够沉淀完全。根据所提供的图片信息,该选项应该选择B:对。图片中的内容显示了沉淀完全的情况,因此可以得出该选项为正确的结论。'
A:对 B:错
AI参考:答案是B:错。向溶液中滴加某种溶液(忽略体积变化),不能将两种离子分开。这是因为离子之间通常会相互作用,形成不同的化合物或络合物,而不是简单地分离。因此,通过滴加溶液来将两种离子分开是不可能的。'
A:对 B:错
A:错 B:对
AI参考:答案是B:对。根据电对的标准电极电势,可知该电对具有氧化性,可以置换氢离子。已知电对中银离子的标准电极电势为0.799V,氢离子的标准电极电势为0.00V,所以银离子可以将氢离子从溶液中置换出来。同时题目中给出了$AgI$和$HI$的标准电极电势数值,这些数值可用于计算碘化银在氢离子存在下的稳定性。综上所述,该选项正确。'
A:错 B:对
AI参考:答案是B:对。分子间力包括色散力、诱导力和取向力,其中一般分子间力以色散力为主。色散力是分子间最普遍存在的力,主要由于电子的运动而产生。诱导力是由于极性分子之间的电性相互作用而产生的。取向力是极性分子之间的相互作用,取决于分子的极性和距离。因此,一般分子间力多以色散力为主。'
A:错 B:对
AI参考:答案是B:对。根据题目描述,需要使用双氧水作为氧化剂来氧化一个图片,并且不引入其他金属离子。双氧水是一种常见的氧化剂,可以通过氢原子和氧原子的反应来实现氧化作用,但通常不会引入其他金属离子。因此,选项B是正确的。选项A错误,因为无法从题目描述中确定双氧水是否会引入其他金属离子。'
A:错 B:对
AI参考:B:对。原子序数为47的元素是银元素,其原子核外价电子排布为:2、8、18、32、18、6。因此,答案是B:对。'
A:对 B:错
A:错 B:对
A:对 B:错
A:错 B:对
AI参考:答案:B图片中显示的是碳酸钙,属于能溶于HCl的物质,所以答案是B,对。'
A:对 B:错
AI参考:答案是B:错。CuCl的熔点高于NaCl,因此该判断是错误的。'
A:对 B:错
AI参考:从题目给出的图片来看,这是一个关于气体溶解度的问题,正确的结论应该是:气体在一定温度和压力下,达到饱和状态时,不会产生沉淀。因此,正确答案是A:对。'
A:对 B:错
A:错 B:对
AI参考:题目中的描述是正确的,即选项B为正确答案。由于混合溶液中的成分不会产生沉淀物,所以溶液混合没有沉淀生成。因此,对于判断题给出的溶液混合的选项,答案是B:对。'
A:对 B:错
AI参考:正确答案是A,即对。根据热力学第一定律,体系吸热时热力学能增加,放热时热力学能减少。已知体系放出了100J的热量,因此体系热力学能的改变量为-100J。同时,环境对体系做了635J的功,这会抵消一部分热力学能的变化,使得总的变化量为-535J。因此,答案为A,即“对”。'
A:错 B:对
AI参考:控制pH在1.3-4.7之间,可以把两种离子分开,这个说法是正确的。这是因为不同的离子在不同的pH条件下,可以产生不同的化学反应,从而将它们分开。例如,在酸性条件下,某些离子可以被酸化成沉淀或气体,而在碱性条件下,其他离子可以被转化为沉淀或溶解度更小的物质。因此,通过控制pH值,可以有效地将两种离子分开。因此,答案为B:对。'
A:错 B:对
A:对 B:错
AI参考:答案是B:错。根据价层电子对互斥理论,该分子的空间构型应为三角锥形,而不是平面三角形。'
A:对 B:错
AI参考:答案是B:错。根据题干给出的图片信息,该物质与醋酸(HAc)反应生成白色沉淀,说明该物质不溶于醋酸。因此,该判断题是错误的,答案为B。'
A:对 B:错
A:对 B:错
AI参考:熵变是用来衡量反应体系混乱度的物理量,如果反应后体系混乱度减小,即熵值减小,反之,如果反应后体系混乱度增大,即熵值增大。题目中给出的图片是一个熵值减小的反应。因此,答案是B:错。'
A:错 B:对
AI参考:答案:A。乙醇和二甲醚虽然分子式相同,但是结构不同,属于同分异构体,但沸点不同。因此,该判断题是错误的,选项A为正确答案。'
A:错 B:对
AI参考:对。从题目中给出的图片,我们可以看到S的氧化值是+4。因此,答案为B:对。'
A:错 B:对
AI参考:B.对。根据电对的标准电极电势,可以判断该电对是能自发进行氧化还原反应的,因此Ag可以置换出盐酸中的氢。'
A:错 B:对
A:对 B:错
A:错 B:对
AI参考:正确答案是B:对。因为题目中给出的图片内容是正确的,所以选项B是正确的。选项A是错误的,因为题目中没有要求进行分析。'
A:对 B:错
A:对 B:错
AI参考:B: 错。在向溶液中加入沉淀剂并观察沉淀现象时,一般来说,应该最先被沉淀的是具有相对较低溶度积常数的离子。对于题目中的情况,应该先沉淀 BaSO4,然后再沉淀 BaCl2 中的 Cl-。因此,该题错误。'
A:错 B:对
AI参考:答案是B:对。该图像表示的是一个熵值减小的反应过程。熵是衡量系统混乱度的物理量,该图像中反应前后系统的熵变小于零,说明反应过程是熵值减小的过程。因此,答案为B,即该反应熵值减小。'
温馨提示支付 ¥1.55 元后可查看付费内容,请先翻页预览!

