1.根据原子结构理论预测,第八周期多包括元素将为( )。
A:36种
B:18种
C:80种
D:50种
答案:50种
2.2Na(s) + Cl2(g) = 2NaCl (s) 该反应熵值减小。( )
A:正确
B:错误
答案:正确
3.能够沉淀完全。( )
A:错误
B:正确
答案:错误
4.系统的焓等于恒压反应热。( )
A:正确
B:错误
答案:正确
5.已知电对,则Ag可以置换1.00mol/L HI中的氢。( )
A:错误
B:正确
答案:错误
6.一般分子间力多以色散力为主。( )
A:错误
B:正确
答案:正确
7.要使 而不引入其他金属离子,可选用双氧水为氧化剂。( )
A:错误
B:正确
答案:正确
8.体系吸收了100J的热量,并且体系对环境做了540J的功,则体系热力学能的改变量是-440J。( )
A:正确
B:错误
答案:正确
9.分子之间存在取向力。( )
A:错误
B:正确
答案:错误
10.主量子数n=4时,有4s、4p、4d、4f四个原子轨道。( )
A:对
B:错
答案:错
11.能溶于HCl。( )
A:错
B:对
A:正确 B:错误 13.离子键具有饱和性不具有方向性。( )
A:对 B:错 14.体系放出了100J的热量,并且环境对体系做了635J的功,则体系热力学能的改变量是-535J。( )
A:正确 B:错误 15.控制pH在1.3-4.7之间,可以把两种离子分开。( )
A:错误 B:正确 16.金属晶体的体心立方密堆积中,每个金属离子的配位数是12。( )
A:错误 B:正确 17.根据价层电子对互斥理论, 是平面三角形。( )
A:正确 B:错误 18.能溶于HAc。( )
A:正确 B:错误 19. 该反应的熵值减小。( )
A:正确 B:错误 20.乙醇和二甲醚因为是同分异构体,所以沸点相同。( )
A:错误 B:正确 21.系统的焓等于系统的热量。( )
A:错 B:对 22.如果向下列反应 的平衡体系中加入一定量的不参与反应的气体(保持总体积不变),那么平衡不发生移动。( )
A:正确 B:错误 23.的氧化值为-2( )
A:正确 B:错误 24.向溶液中滴加溶液(忽略体积变化),Cl-先被沉淀。( )
A:正确 B:错误 25. 该反应熵值减小。( )
A:错 B:对 26.
如果温度300K,压力200kPa时5mol A(g)与10mol B(g) 发生反应: 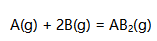 已知反应达到平衡时,已反应掉A(g)的摩尔分数为0.5。设参加反应的都是理想气体,则反应的平衡常数
已知反应达到平衡时,已反应掉A(g)的摩尔分数为0.5。设参加反应的都是理想气体,则反应的平衡常数  为( )。
为( )。
A:1.5 B:2.5 C:1 D:10 27.
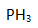 分子的中心原子采取( )。
分子的中心原子采取( )。A: B: C: D: 28.
 溶液中的溶解度为( )mol/L。
溶液中的溶解度为( )mol/L。A: B: C: D: 29.水的离子积在
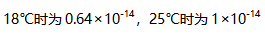 。则下列说法中不正确的是( )。
。则下列说法中不正确的是( )。A:水的电离是吸热过程 B: C:常温下pH=7则水溶液是中性的 D: 30.
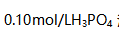 溶液中,其个物种浓度大小次序正确的是( )。
溶液中,其个物种浓度大小次序正确的是( )。A: B: C: D: 31.
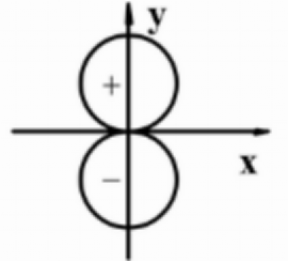 对图形正确的描述为( )。
对图形正确的描述为( )。
A:图形表示原子轨道角度分布图。 B:图形表示原子轨道的形状。 C:图形表示原子轨道的形状。 D:图形表示电子云角度分布图。 32.当下列各酸水溶液中的氢离子浓度相等时,溶液中以分子为基本单元时物质的量浓度最高的是( )。
A: B: C: D: 33.
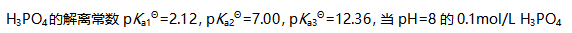 溶液中各种存在形式平衡浓度之间的关系为( )。
溶液中各种存在形式平衡浓度之间的关系为( )。A: B: C: D: 34.设有下列热化学方程式:
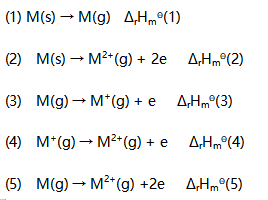
在下列各式中,错误的是( )。
A: B: C: D: 35.73 已知BaSO4的Ksp=1.07×10-10,往10.0mL 0.020 mol/L BaCl2溶液中加入10.0mL 0.040 mol/LNaSO4沉淀剂,溶液中的Ba2+浓度为( )。
A:4.5×10-10 B:1.1×10-9 C:2.9×10-9 D:1.1×10-8 36.在标准状况下,
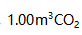 通过炽热的碳层后,完全转化为CO,这时的温度为1173K,压力为102kPa,在CO的体积为( )
通过炽热的碳层后,完全转化为CO,这时的温度为1173K,压力为102kPa,在CO的体积为( )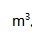 。
。A:8.54 B:4.26 C: D: 37.已知某药物分解30%即告失效。药物溶液原来浓度为
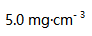 ,20个月后浓度变为
,20个月后浓度变为 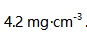 .假定此分解反应为一级反应,则在标签上注明的有效期限为( )。
.假定此分解反应为一级反应,则在标签上注明的有效期限为( )。A:25个月 B:46个月 C:50个月 D:40个月 38.
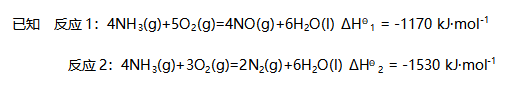
则NO的生成焓为( )。
A: B: C: D: 39.已知

构成的原电池的标准电动势
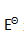 为( )。
为( )。A:-0.61V B:-3.7V C:0.61V D:3.7V 40.HAc溶液的质子条件式为( )。
A: B: C: D: 41.
如果已知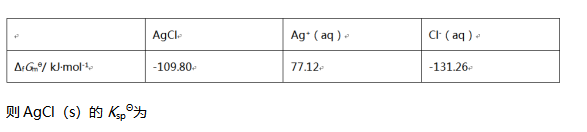 ( )。
( )。
A: B: C: D: 42.葡萄糖磷酸变位酶对反应1-磷酸葡萄糖=6-磷酸葡萄糖起催化作用。若此反应在298K达到平衡时,6-磷酸葡萄糖的摩尔分数为95%,则此反应的
 为( )。
为( )。A: B: C: D: 43.
 和1mmol/L,问310K时与它们平衡的ATP浓度是( )。
和1mmol/L,问310K时与它们平衡的ATP浓度是( )。A: B: C: D: 44.

写出电极反应与电池反应,计算电池反应的平衡常数为( )。
A: B: C: D: 45.已知柠檬酸盐、顺乌头酸盐和水在298K时的标准生成吉布斯自由能
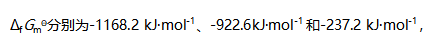 则298K时反应柠檬酸盐=顺乌头酸盐+水的平衡常数KΘ为( )。
则298K时反应柠檬酸盐=顺乌头酸盐+水的平衡常数KΘ为( )。A: B: C: D: 46.
 中溶解的平衡常数为( )。
中溶解的平衡常数为( )。A: B: C: D: 47.
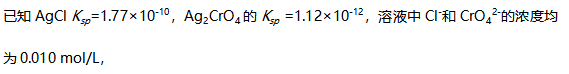 向溶液中滴加
向溶液中滴加  溶液(忽略体积变化),可以将两种离子分开。( )
溶液(忽略体积变化),可以将两种离子分开。( )A:对 B:错 48.已知电对
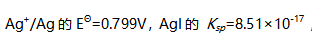 ,则Ag可以置换1.00mol/L HI中的氢。
,则Ag可以置换1.00mol/L HI中的氢。( )
A:错 B:对 49.原子序数为47的元素,其原子核外价电子排布为
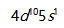 。( )
。( )A:错 B:对 50.
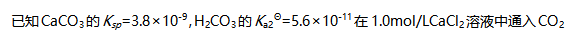 气体至饱和(忽略体积变化),没有沉淀生成。( )
气体至饱和(忽略体积变化),没有沉淀生成。( )A:对 B:错 51.
 溶液混合,没有沉淀生成。( )
溶液混合,没有沉淀生成。( )A:错 B:对 52.
 中S的氧化值为+4。( )
中S的氧化值为+4。( )A:错 B:对
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!

