1.稀土是重要的战略资源,稀土元素总共有( )个。
A:15
B:14
C:17
D:16
答案:17
2.某A2B型难溶强电解质,在一定温度下,其溶度积常数为3.2×10-8,则其溶解度为( )mol•L-1。
A:1.8×10-4
B:3.2×10-3
C:2.0×10-4
D:2.0×10-3
答案:2.0×10-3
3.下列分子中化学键键级等于零的是( )。
A:H2
B:H2+
C:He2
D:O22-
答案:He2
4.下列基态原子的价电子构型中,对的是( )。
A:3d104s1
B:3d94s2
C:3d104s0
D:3d44s2
答案:3d104s1
5.298K时,在AgI的饱和水溶液中,已知I-的浓度为s mol/L,则其溶度积等于( )。
A:S
B:S-2
C:S2
D:4S2
答案:S2
6.量子数n,l和m不能决定( )。
A:原子轨道的能量
B:原子轨道的形状
C:原子轨道的数量
D:电子数量
答案:电子数量
7.在浓度均为0.01 mol•L-1的Cl- 和I- 混合溶液中,不断逐滴加入稀硝酸银溶液,对于生成沉淀的说法正确是( )。
A:只生成AgI沉淀
B:先生成AgCl沉淀
C:先生成AgI沉淀
D:同时生成AgCl和AgI沉淀
答案:先生成AgI沉淀
8.下列所列的基态原子电子构型中,对的是( )。
A:1s22s32p1
B:[Ar]3d104s1
C:[Ar]3d94s2
D:[Ar]3d5
答案:[Ar]3d104s1
9.d轨道是花瓣型的,dxy的花瓣处于( )。
A:z轴上
B:无法判断
C:xy轴夹角平分线上
D:xy轴上
答案:xy轴夹角平分线上
10.已知,298K时AgCl和Ag2CO3的溶度积分别为1.8×10-10和8.1×10-12,在等浓度的氯离子和碳酸根离子的混合溶液中,逐滴加入硝酸银,则( )。
A:AgCl先沉淀
B:都不沉淀
C:同时产生沉淀
D:Ag2CO3先沉淀
答案:AgCl先沉淀
11.下列物质间不是共轭酸碱对的有( )。
A:HAc、Ac-
B:H2S、S2-
C:NH3、NH2-
D:H2O、OH-
A:不发生渗透现象 B:渗透方向为葡萄糖→氯化钠 C:渗透方向为氯化钠→葡萄糖 D:达渗透平衡状态,半透膜两边液面一样高 13.描述电子出现的最大概率区域距离原子核的平均距离的量子数是( )。
A:角量子数 B:自旋磁量子数 C:磁量子数 D:主量子数 14.已知,E(Cl2/Cl-)>E(MnO2/Mn2+)>E(Ag+/Ag)>E(Cu2+/Cu),则上述最强的还原剂是( )。
A:Cl- B:Ag C:Cu D:Mn2+ 15.298K时,PbI2的溶度积常数为7.1×10-9,若将等体积的0.0010 mol·L-1的Pb(NO3)2溶液和0.0010 mol·L-1KI溶液混合,则( )。
A:饱和溶液 B:不产生沉淀 C:无法判断 D:产生沉淀 16.配离子[Ca(C2O4)2]2-中心原子的配位数是( )。
A:2 B:6 C:8 D:4 17.除去ZnSO4溶液中的CuSO4,最好选用的试剂是( )。
A:Zn B:氨水 C:NaOH D:H2S 18.下列关于硫化氢说法错误的是( )。
A:H2S是无色、具有臭鸡蛋气味的有毒气体 B:H2S具有较强的还原性 C:H2S能溶于水,形成二元强酸 D:H2S的分子构型是V型,是极性分子 19.量子力学中,原子轨道是指( )。
A:波函数 B:电子云 C:波尔理论中的原子轨道 D:径向分布函数 20.下列浓度表示方法中,浓度数值随温度而变的有( )。
A:bB B:cB C:ωB D:XB 21.某一氧化还原反应A+B2+=B+A2+,该反应的标准电动势为0.296 V,其标准平衡常数为( )。
A:1.0×105 B:1.0×1010 C:1.0×10-10 D:1.0×10-5 22.MnO2中Mn的氧化值等于4,关于MnO2的说法正确的是( )。
A:只具有氧化性 B:只具有还原性 C:既具有氧化性,又具有还原性 23.最早提出微观粒子运动时具有波粒二象性的是( )。
A:薛定谔 B:玻尔 C:卢瑟福 D:爱因斯坦 24.最先成功解释氢光谱的学者是( )。
A:波尔 B:鲍林 C:汤姆逊 D:海森堡 25.下列离子或分子中采取等性杂化的是( )。
A:BeCl2 B:H3O+ C:H2O D:NH3 26.屏蔽效应使外层电子能量( )。
A:无法判断 B:无影响 C:降低 D:增大 27.已知0.1 mol/L某一元弱酸的 的水溶液中有3%的一元弱酸电离,它的电离平衡常数等于( )
A:9×10-4 B:9×10-5 C:3×10-4 D:3×10-2 28.对于pH等于7的溶液的酸碱性的描述正确的是( )。
A:碱性 B:酸性 C:无法判断 D:中性 29.羟基氧化铁FeOOH中Fe的氧化值为( )。
A:+2 B:0 C:+6 D:+3 30.高锰酸根离子在碱性介质中和亚硫酸根离子反应生成锰酸根离子,该反应配平后,OH-的系数为( )。
A:1 B:5 C:6 D:2 31.下列分子中采取不等性杂化的有( )。
A:BeCl2 B:CH4 C:NCl3 D:BF3 32.298K时,0.10mol•L-1的某一元弱酸溶液,测其pH=3.5,则该酸的标准电离平衡常数为( )。
A:1.0×10-5 B:1.0×10-8 C:1.0×10-7 D:1.0×10-6 33.下列分子中,空间构型不是直线形的是( )。
A:HgCl2 B:CO2 C:CHΞCH D:H2O 34.下列各组原子轨道中,对称性不匹配的轨道有( )。
A:s-pX B:pX-pz C:py-py D:pz-pz 35.下列离子反应方程式中,对的是( )。
A: B: C: D: 36.已知:
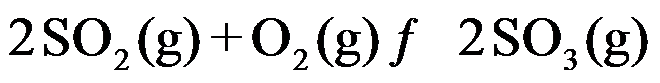 的标准平衡常数为
的标准平衡常数为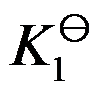 ,
,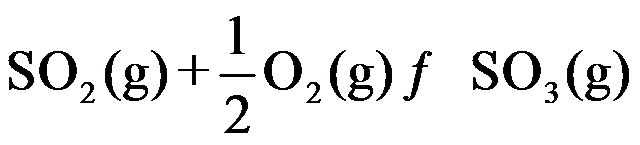 的标准平衡常数为
的标准平衡常数为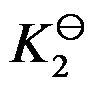 ,则两者关系为( )。
,则两者关系为( )。A: B: C: D: 37.分子中含有极性键,该分子有可能是非极性分子。( )
A:错 B:对 38.配合物的中心原子和配体、內界和外界均是以配位键结合。( )
A:对 B:错 39.基态原子的电子层结构中,最外层电子数不超过8,次外层电子数不超过18,是由于”能级交错“造成的。( )
A:错 B:对 40.叶绿素与血红素都是配合物,而且是具有环状结构的螯合物。( )
A:对 B:错 41.医药上常用于胃肠道X射线造影检查的钡盐是BaSO4。( )
A:错 B:对 42.电极电势越大,则对应的电对氧化态在标准态下的氧化性越强。( )
A:对 B:错 43.标准平衡常数越大,反应速率越快。( )
A:错 B:对 44.只有金属原子和阳离子才可以作为配合物的形成体。( )
A:对 B:错 45.波函数绝对值的平方的空间图像是电子云。( )
A:错 B:对 46.金属的活泼性次序或金属电位序,实质上是描述金属还原性强弱的次序。( )
A:对 B:错 47.中性溶液的pH=7。( )
A:错误 B:正确 48.相同原子间的双键键能等于单键键能的两倍。( )
A:对 B:错 49.极性分子中的化学键都是极性键。( )
A:对 B:错 50.配位平衡与酸碱平衡的影响是配合剂与沉淀剂共同争夺金属离子的过程,配合物的稳定常数越大、沉淀的溶度积越大,越易生成配合物,反之,越易生成沉淀。( )
A:对 B:错 51.沉淀溶解的方法不包括氧化还原。( )
A:错 B:对 52.基态原子有几个成单电子就能形成几个共价单键。( )
A:错 B:对 53.从理论上讲,任何一对共轭酸碱对的溶液都可以组成缓冲溶液;高浓度的强酸、强碱溶液也是缓冲溶液。( )
A:错 B:对 54.在缓冲溶液中加入适量水稀释时,缓冲溶液的pH值完全不变 。( )
A:错 B:对 55.关于[Cu(NH3)4]2+溶液,下列说法正确的是( )。
A:加入高浓度HCl,溶液变为淡蓝色 B:加入适量乙醇将析出深蓝色晶体 C:该离子为深蓝色 D:加入少量NaOH没有沉淀生成 56.在BaSO4饱和溶液中,加入少量下列哪些物质会使BaSO4的溶解度减小。( )
A:BaCl2 B:H2O C:Na2SO4 D:NaCl 57.下列对于氢卤酸描述对的是( )。
A:还原性:HI>HBr>HCl>HF B:酸性:HI>HBr>HCl>HF C:稳定性:HI
A:减小生成物分压 B:降低温度 C:升高温度 D:增大总压力 59.向配合物[Ag(NH3)2]Cl中加入强酸,则会发生下列那种情况。( )
A:配合物稳定性增强 B:配合物稳定性降低 C:产生水解效应 D:产生酸效应 60.下列关于依数性的描述错误的是( )。
A:稀溶液的某些性质只与溶质的粒子数有关,而与溶质的本性无关,称依数性 B:浓度越小,溶液的凝固点越低 C:稀溶液的依数性包括蒸气压下降、沸点升高、凝固点降低 D:溶剂相同、溶质质量摩尔浓度相同的稀溶液,其依数性数值相同 61.下列分子形成过程可以用sp3杂化解释的是( )。
A:NH3 B:C6H6 C:CH4 D:H2O 62.在0.1 mol/L的氨水中加入少量NH4Cl,下列描述对的是( )。
A:溶液的pH减小 B:同时也存在盐效应 C:氨水的电离度减小 D:产生同离子效应 63.下列影响盐类水解因素中,描述对的是( )
A:水解程度大小与盐的本性有关 B:水解显碱性的,加碱抑制水解 C:温度升高,水解程度增大 D:对于强酸弱碱盐和强碱弱酸盐,浓度越小,水解程度越大 64.关于硫酸铁,下列说法正确的是( )。
A:在稀硫酸溶液中溶解硫酸铁,可以防止铁离子水解 B:溶解于稀硫酸溶液后,加入KSCN溶液,形成血红色配合物 C:溶解于稀硫酸溶液后,铁离子以水合态存在 D:溶解于稀硫酸溶液后,铁离子以配离子形式存在 65.下列化学键或分子间力具有方向性和饱和性的是( )。
A:金属键 B:共价键 C:离子键 D:氢键 66.已知:
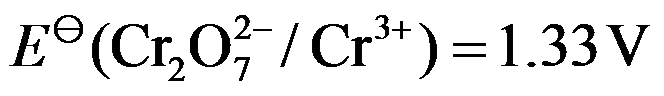 ,关于下列说法对的是( )。
,关于下列说法对的是( )。A:增大浓度,电对的电极电势将小于1.33 V B:增大浓度,电对的电极电势将大于1.33 V C:减小浓度,电对的电极电势将大于1.33 V D:增大浓度,电对的电极电势将大于1.33 V 67.将反应
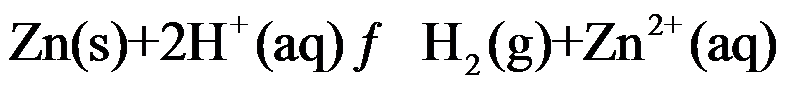 设计成电池,不需要加入惰性电极。( )
设计成电池,不需要加入惰性电极。( )A:错 B:对

