1.在 HCl溶液中,已知
HCl溶液中,已知 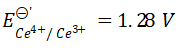 ,当
,当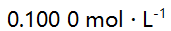 的
的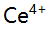 有99.9%被还原成
有99.9%被还原成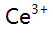 时,该电对的电极电势为( )。
时,该电对的电极电势为( )。
A:0.90 V
B:1.22 V
C:1.28 V
D:1.10 V
答案:AI参考:根据题目描述,已知$HCl$溶液中$,99.9\\%$的$H^{+}$被还原成$H_{2}$,此时电对中的其他物质(如$H_{2}O$、$Cl^{-}$等)可能发生电化学反应,因此无法直接使用标准电极电势进行计算。但根据题目的描述,可以推测出该电对可能是$Cl_{2} \rightleftharpoons {Cl}^{-} + {e}^{-}$。标准电极电势对于这个电对为${Cl}^{-}$对${Cl_{2}}$的电极电势为$1.36V$。所以该电对的电极电势应该在$1.36V$左右,因此选项C是正确答案。\n\n需要注意的是,由于题目中没有给出其他电化学反应的具体情况,因此无法得出更精确的数值。同时,对于某些电对,标准电极电势可能需要进行修正才能得到更准确的数值。因此,在实际应用中,需要结合具体的情况进行分析和计算。'
2. ( )。
( )。
A:6.00
B:12.00
C:10.00
D:5.00
答案:AI参考:正确答案是D:5.00。\n\n根据题干中的图片信息,可以得知该图片的宽度为415.2pt,高度为43.15pt。由于题目要求选择一个选项,因此需要将图片的宽度和高度进行比较,找到最接近的数值。选项A、B、C的数值都比图片的宽度和高度大,只有选项D的数值接近图片的宽度和高度,因此答案为D。'
3.络合滴定中,若T E≤0.1%、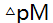 =±0.2,被测离子M浓度为干扰离子N浓度的1/10,欲用控制酸度滴定M,则要求1gK(MY)-lgK(NY)大于 ( )。
=±0.2,被测离子M浓度为干扰离子N浓度的1/10,欲用控制酸度滴定M,则要求1gK(MY)-lgK(NY)大于 ( )。
A:5
B:6
C:7
D:8
答案:AI参考:正确答案是C:7。\n根据络合滴定原理,当控制酸度滴定M时,要求lgK(MY)-lgK(NY)大于7,即lg[M(NH4+)]/c(N)大于7,所以干扰离子N浓度越小越好。题目中干扰离子N浓度为被测离子M浓度的1/10,所以干扰离子N浓度越小,干扰越小。因此,答案为C。'
4.现有同体积的四种溶液
(1) 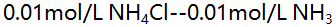
(2) 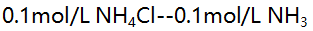
(3) 0.01mol/L HAc--0.01mol/L NaAc
(4) 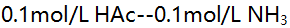
分别加入0.05mL 1mol/L HCl引起pH值变化最大的是( )。
A:(1)和(3)
B:(4)
C:(2)和(4)
D:(2)
答案:AI参考:正确答案是:C:(2)和(4)。\n(1)与HCl发生中和反应;(2)的离子积大于水的离子积,加入HCl引起水解平衡向逆反应方向移动,(2)溶液酸性增强;(4)中醋酸根离子水解平衡也向逆反应方向移动,溶液酸性增强。\n\n因此,加入HCl引起pH值变化最大的是(2)和(4),答案为C。'
5.测定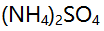 中的氮时,不能用NaOH标准溶液直接滴定,这是因为( )。
中的氮时,不能用NaOH标准溶液直接滴定,这是因为( )。
A:
B:
C:
D:
答案:AI参考:正确答案是D:测定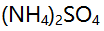 中的氮时,不能用NaOH标准溶液直接滴定是因为亚硝酸盐的性质极不稳定。\n\n根据题干中给出的图片,需要用NaOH标准溶液来测定氮含量。然而,亚硝酸盐的性质极不稳定,在酸性条件下容易分解成氮气和水,无法进行直接滴定。因此,不能使用NaOH标准溶液直接滴定该物质中的氮含量。\n\n综上,本题答案为D。'
中的氮时,不能用NaOH标准溶液直接滴定是因为亚硝酸盐的性质极不稳定。\n\n根据题干中给出的图片,需要用NaOH标准溶液来测定氮含量。然而,亚硝酸盐的性质极不稳定,在酸性条件下容易分解成氮气和水,无法进行直接滴定。因此,不能使用NaOH标准溶液直接滴定该物质中的氮含量。\n\n综上,本题答案为D。'
6.某溶液含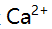 ,
,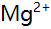 及少量
及少量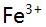 ,
,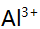 今加入三乙醇胺,调至p=10,以铬黑T为指示剂,用EDTA滴定,此时测定的是( )。
今加入三乙醇胺,调至p=10,以铬黑T为指示剂,用EDTA滴定,此时测定的是( )。
A:,,, 总量
B:量
C:,总量
D:量
答案:AI参考:答案:C。\n由题意可知,溶液中含有的金属离子为钙离子和镁离子,在溶液pH值为10时,铬黑T指示剂可以准确滴定溶液中的钙离子,因此加入三乙醇胺调节溶液pH值为10后,可以测定溶液中的钙离子总量。因此,答案为C。'
7.已知乙二胺(L)与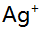 形成络合物的
形成络合物的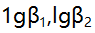 分别为4.7与7.7,当AgL络合物为主要存在形式时,溶液中游离L的浓度范围是( )。
分别为4.7与7.7,当AgL络合物为主要存在形式时,溶液中游离L的浓度范围是( )。
A:
B:
C:
D:
答案:AI参考:答案:C\n推理过程:\n根据题意,$L$与$Ag^{+}$形成的络合物类型为配位化合物,且已知$L$与$Ag^{+}$形成络合物的稳定常数分别为$K_{1} = 4.7$和$K_{2} = 7.7$。\n当$AgL$络合物为主要存在形式时,溶液中游离$L$的浓度范围为$K_{1} \times K_{2} < c(L) < K_{1}$。\n因此,本题答案为C选项。\n注:由于配位化合物的稳定常数与温度有关,因此本题答案仅供参考,实际浓度可能因温度变化而变化。'
8.用0.1 mol/L HCl滴定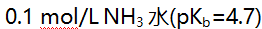 的pH突跃范围为6.3-4.3,若用0.1 mol/L HCl滴定0.1 mol/L
的pH突跃范围为6.3-4.3,若用0.1 mol/L HCl滴定0.1 mol/L 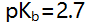 的某碱,pH突跃范围为( )。
的某碱,pH突跃范围为( )。
A:8.3-2.3
B:8.3-4.3
C:4.3-6.3
D:6.3-2.3
答案:AI参考:正确答案是C:4.3-6.3。\n根据题意,用0.1mol/LHCl滴定某碱的pH突跃范围为6.3-4.3,若用同样浓度的盐酸滴定该碱,因为滴定前后的氢离子浓度相同,因此碱的pH值将整体向上移动一个数量级,即4.3-6.3。因此,答案为C。'
9.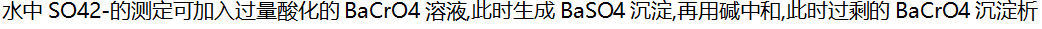
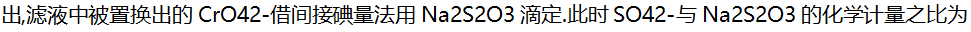 ( )。
( )。
A:1:6
B:1:2
C:1:3
D:1:1
答案:AI参考:正确答案是C:1:3。\n两个图片宽度相同,高度不同,说明它们的长度与宽度比不同,题目要求比例一致,只有选项C 1:3符合条件。'
10.将等体积的pH=3的HCl溶液和pH=10的NaOH溶液混合后,溶液的pH区间是( )。
A:3-4
B:6-7
C:1-2
D:11-12
答案:AI参考:正确答案是B:6-7。\n混合后溶液的pH值取决于溶液中氢离子和氢氧根离子的相对浓度。将等体积的pH=3的HCl溶液和pH=10的NaOH溶液混合后,氢离子和氢氧根离子的浓度大约都变成了原来的一半。因为HCl的酸性更强,混合后的溶液中的氢离子浓度应该接近氢氧化钠中氢氧根离子浓度的1/2。因为中性溶液中氢离子和氢氧根离子的浓度相等,所以混合后的溶液应该在pH接近7的位置。因此,选项B是正确答案。'
11.在下列溶液中,用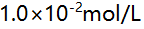 EDTA 滴定
EDTA 滴定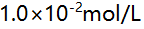 Zn2+至化学计量点时,
Zn2+至化学计量点时, 值最小的是( )。
值最小的是( )。
A:
B:
C:
D:
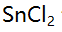 溶液10 mL与0.10 mol/L
溶液10 mL与0.10 mol/L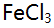 溶液 20 mL 相混合,平衡时体系的电位是( )。(已知此条件时
溶液 20 mL 相混合,平衡时体系的电位是( )。(已知此条件时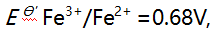
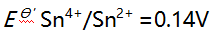 )
)A:0.14V B:0.32V C:0.50V D:0.68V 13.对Ox-Red电对, 25
 时条件电位
时条件电位 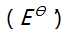 等于 ( )。
等于 ( )。A: B: C: D: 14.用NaOH标准溶液滴定浓度均为0.1mol/L的
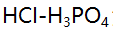 混合液,在滴定曲线上出现几个突跃( )。
混合液,在滴定曲线上出现几个突跃( )。A:2 B:3 C:1 D:4 15.有一组平行测定所得的数据,要判断其中是否有可疑值,应采用 ( )。
A:F检验 B:Q检验 C:t检验 D:检验 16.欲配制pH=9的缓冲溶液,可取下列两种物质中的哪一种加入盐酸来配制 ( )。
A: B: 17.配制以下标准溶液必须用间接法配制的是( )。
A:NaCl B: C:NaOH D: 18.磺基水扬酸(L)与
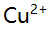 络合物的
络合物的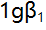 为9.5,
为9.5,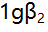 为16.5,[CuL]达最大的pL值当为( )。
为16.5,[CuL]达最大的pL值当为( )。A:16.5 B:8.3 C:9.5 D:7.0 19.已知
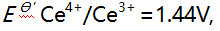
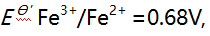 则下列反应
则下列反应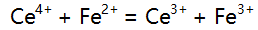 在化学计量点时,溶液中
在化学计量点时,溶液中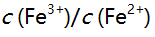 值为 ( )。
值为 ( )。A: B:92.5 C: D:36.2 20.用EDTA滴定
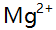 ,采用铬黑T指示剂,少量
,采用铬黑T指示剂,少量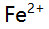 的存在将导致( )。
的存在将导致( )。A:与指示剂形成沉淀,使其失去作用 B:终点颜色变化不明显以致无法确定终点 C:在化学计量点前指示剂即开始游离出来,使终点提前 D:使EDTA与指示剂作用缓慢,终点延长 21.以下表述正确的是 ( )。
A:铬黑T指示剂只适用于酸性溶液 B:铬黑T指示剂适用于弱碱性溶液 C:二甲酚橙可适用于酸性也适用于弱戚性溶液 D:二甲酚橙指示剂只适于pH>6时使用 22.
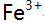 与
与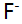 形成络合物的
形成络合物的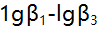 分别为5.3,9.3和12.1,已知在某一pH值时溶液中游离F-的浓度为
分别为5.3,9.3和12.1,已知在某一pH值时溶液中游离F-的浓度为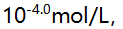 则溶液中铁络合物的主要存在形式是( )。
则溶液中铁络合物的主要存在形式是( )。A: B: C: D: 23.用
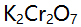 滴定
滴定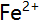 ,在化学计量点时,有关离子浓度的关系是 ( )。
,在化学计量点时,有关离子浓度的关系是 ( )。A: B: C: D: 24.在pH=5.0时,用EDTA溶液滴定含有
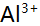 ,
,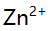 ,
,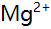 和大量
和大量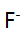 等离子的溶液,已知lgK(AlY)=16.3,JgK(ZnY)=16.5,1gK(HgY)=8.7,
等离子的溶液,已知lgK(AlY)=16.3,JgK(ZnY)=16.5,1gK(HgY)=8.7,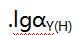 =6.5,则测得的是( )。
=6.5,则测得的是( )。A:Zn的含量 B:Zn和Mg的总量 C:Al,Zn,Mg总量 D:Mg的含量 25.以下试剂能作为基准物的是( )。
A:分析纯 B:99.99%金属铜 C:干燥过的分析纯CaO D:光谱纯三氧化二铁 26.1.0 moI/L
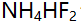 溶液的pH值是( )。(
溶液的pH值是( )。( 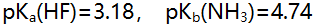 )
)A:9.26 B:6.22 C:1.59 D:3.18 27.已知甲胺的
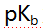 为3.38,苯胺
为3.38,苯胺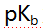 为9.38,甲酸的
为9.38,甲酸的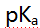 为3.74,以下混合液(浓度均为0.1mol/L)能用中和法准确滴定画线组分的是( )。
为3.74,以下混合液(浓度均为0.1mol/L)能用中和法准确滴定画线组分的是( )。A: B:NaOH - 苯胺 C:HCl - 甲酸 D:NaOH - 甲胺 28.已知
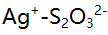 络合物的
络合物的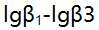 分别是9.0,13.0,14.0。以下答案不正确的是 ( )。
分别是9.0,13.0,14.0。以下答案不正确的是 ( )。 A: B: C: D: 29.含0.10mol/L HCl和0.20mol/L
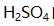 的混合溶液的质子条件式是( )。
的混合溶液的质子条件式是( )。A: B: C: D: 30.已知乙二胺(L)与
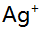 络合物的
络合物的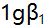 ,
,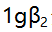 分别是4.7与7.7,则当[AgL]=
分别是4.7与7.7,则当[AgL]=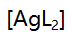 时的pL值是( )。
时的pL值是( )。A:3.0 B:4.7 C:6.2 D:7.7 31.在一定酸度和一定浓度
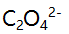 存在下,
存在下,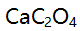 的溶解度计算式为 ( )。
的溶解度计算式为 ( )。A: B: C: D: 32.
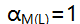 表示( )。
表示( )。A:[M]=[L] B:M的副反应较小 C:M与L的副反应相当严重 D:M与L没有副反应 33.实验中出现以下情况引起偶然误差的是 ( )。
A:滴定管最后一位估计不准 B:重量法测定硫时,加HCl过多 C:砝码受腐蚀 D:天平两臂不等长 34.测定铁矿中Fe的百分含量,求得置信度为95%时平均值的置信区间为35.21±0.10。对此区间的正确理解是 ( )。
A:在此区间内包括总体平均值的把握有95% B:若再作测定有95%将落入此区间内 C:总体平均值落入此区间的概率为95% D:在已测定的数据中有95%的数据在此区间内 35.按正态分布
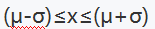 出现的概率为 ( )。
出现的概率为 ( )。A: B: C: D: 36.含有
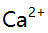 ,
, 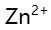 、
、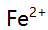 混合离子的弱酸性试液,若以
混合离子的弱酸性试液,若以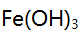 形式分离
形式分离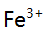 ,应选择的试剂( )。
,应选择的试剂( )。A: B: C:NaOH D: 37.下列各项定义中不正确的是( )。
A:相对误差是绝对误差在真值中所占的百分比 B:总体平均值就是真值 C:绝对误差是测定值与真值之差 D:偏差是指测定值与平均值之差 38.分析测定中偶然误差的特点是 ( )。
A:数值无规律可循 B:正负误差出现的概率相同 C:大小误差出现的概率相同 D:数值有一定范围 39.下列哪种说法违背非晶形沉淀的条件 ( )。
A:沉淀应放置过夜使沉淀陈化 B:沉淀应在热溶液中进行 C:沉淀应在不断搅拌下迅速加入沉淀剂 D:沉淀应在浓的溶液中进行 40.在定量分析中,精密度与准确度之间的关系是( )。
A:精密度高,准确度必然高 B:精密度是保证准确度的前提 C:准确度高,精密度也就高 D:准确度是保证精密度的前提 41.用邻苯二甲酸氢钾为基准物标定0.1 mol/L NaOH溶液,每份基准物的称取量宜为( )。(Mr( KHC8H8O4)=204.2)
A:0.2 g左右 B:0.8 g-1.6 g C:0.4 g- 0.8 g D:0.2 g-0.4 g 42.在络合滴定中有时采用辅助络合剂,其主要作用是( )。
A:作指示剂 B:将被测离子保持在溶液中 C:控制溶液的酸度 D:掩蔽干扰离子 43.在重量分析中对无定形沉淀的洗涤,洗涤液应选择 ( )。
A:冷水 B:热的电解质稀溶液 C:沉淀剂稀溶液 D:有机溶剂 44.用挥发法测定某试样的吸湿水时,结果偏高,可能是由于 ( )。
A:加热后的称量时间过长 B:试样加热后没有冷到室温就称量 C:加热时间不足 D:加热的温度过低 45.下列有关偶然误差的论述中不正确的是 ( )。
A:偶然误差是由一些不确定的偶然因素造成的 B:偶然误差具有单向性 C:偶然误差具有随机性 D:偶然误差在分析中是无法避免的 46.下列各组溶液中可用作标准缓冲溶液的是( )。
A:邻苯二甲酸氢钾--HCl B:甲酸--NaOH C: D:0.05mol/L 邻苯二甲酸氢钾 47.下列表述中,最能说明系统误差小的是( )。
A:高精密度 B:标准偏差大 C:与已知含量的试样多次分析结果的平均值一致 D:仔细校正所用砝码和容量仪器等 48.将等体积的pH=3的HCl溶液和pH=10的NaOH溶液混合后,溶液的pH区间是( )。
A:3-4 B:6-7 C:1-2 D:11-12 49.以下关于偶然误差的叙述正确的是( )。
A:负误差出现的概率大于正误 B:正误差出现的概率大于负误差 C:正负误差出现的概率相等 D:大小误差出现的概率相等 50.多元酸分步滴定时,若浓度均增加10倍,滴定突跃大小变化的pH单位是( )。
A:10个单位 B:1个单位 C:不变化 D:2个单位 51.以甲基红为指示剂,能用Na0H标准溶液准确滴定的酸是( )。
A:硫酸 B:草酸 C:甲酸 D:乙酸 52.若醋酸的pKa = 4.74,则其有效数字位数为 ( )。
A:四位 B:二位 C:三位 D:一位 53.做滴定分析遇到下列情况时,会造成系统误差的是( )。
A:移液管转移溶液后管尖处残留有少量溶液 B:确定终点的颜色略有差异 C:称样用的双盘天平不等臂 D:滴定管读数时最后一位估计不准 54.某有色络合物的透光率T=9.77%,则吸光度值lg (1/T)为 ( )。
A:1.010 B:1.0101 C:1.01 D:1.0 55.能消除测定方法中的系统误差的措施是 ( )。
A:称样量在0.2 g以上 B:认真细心地做实验 C:增加平行测定次数 D:用标准样品进行对照试验 56.EDTA与金属离子络合时,一分子的EDTA可提供的配位原子数是( )。
A:4 B:8 C:2 D:6 57.表示一组数据离散特性的最好标志是 ( )。
A:标准偏差 B:全距 C:偏差 D:平均偏差 58.若两电对的电子转移数均为2,为使反应完全度达到99.9%,两电对的条件电势差至少应大于( )。
A:0.27V B:0.36V C:0.09V D:0.18V 59.用NaQH标准溶液滴定一元弱酸时,若弱酸和NaOH的浓度都比原来增大十倍,则滴定曲线中( )。
A:化学计量点前后0.1%的pH均减小 B:化学计量点前0.1%的pH减小,后0.1%的pH增大 C:化学计量点前0.1%的pH不变,后0.1%的pH增大 D:化学计量点前后0.1%的pH均增大 60.将酚酞指示剂加到某无色溶液中,溶液仍无色,表明溶液酸戚性为( )。
A:碱性 B:酸性 C:中性 D:不能确定其酸碱性 61.对置信区间的理解正确是 ( )。
A:一定置信度下以真值为中心的可靠范围 B:一定置信度下以真值为中心包括测定平均值的区间 C:真值落在某一可靠区间的概率 D:一定置信度下以测定平均值为中心包括真值的范围 62.二甲酚橙可以在什么酸度的溶液中使用( ) 。
A:8~11 B:弱酸性、中性、弱碱性 C:>12 D:pH<6 63.在MnO4- 滴定Fe2+时,Cl-的氧化被加快,该反应属于 ( )。
A:副反应 B:自催化反应 C:诱导反应 D:催化反应 64.用NaOH滴定HCl,用酚酞做指示剂,由于终点与计量点不一致,所导致的误差( )。
A:方法误差 B:随机误差 C:试剂误差 D:主观误差 65.用0.1000mol/L NaOH滴定0.10mol/L HAc (pKa= 4.7)的pH突跃范围为7.7~9.7,由此可推算用0.01000mol/L NaOH滴定pKa为3.7的0.010mol/L 某一元弱酸的突跃范围为( )。
A:6.7~8.7 B:6.7~10.7 C:7.7~10.7 D:6.7~9.7 66.下列关于吸附指示剂说法错误的是( )。
A:吸附指示剂能用于沉淀滴定法中的法扬司法 B:吸附指示剂指示终点是由于指示剂结构发生了改变 C:吸附指示剂本身不具有颜色 D:吸附指示剂是一种有机染料 67.一般情况下,EDTA与金属离子形成配位化合物的配位比是( )。
A:2:1 B:1:3 C:1:1 D:1:2 68.佛尔哈德法可直接测定下列哪种离子( )。
A:F- B:Ag+ C:Cl- D:I- 69.在Ca2+和Mg2+共存时,可不加掩蔽剂用EDTA滴定Ca2+的pH条件是( )。
A:pH=12 B:pH=5 C:pH=2 D:pH=10 70.KMnO4法使用的强酸性介质是( )。
A:磷酸 B:硫酸 C:盐酸 D:硝酸 71.同离子效应使得沉淀的溶解度( )。
A:没有影响 B:减小 C:不一定 D:增大 72.计算Na2HPO4~Na3PO4缓冲溶液的pH值时,将用到H3PO4的( )。
A:Ka1 B:Ka2 C:Ka3 D:三个Ka均能用到 73.在下列杂质离子存在下,以Ag+沉淀Cl-,沉淀首先吸附( )。
A:NO3- B:Ba2+ C:Cl- D:Zn2+ 74.在pH=10.0的氨性缓冲溶液中,以0.020 mol/L EDTA滴定同浓度的Zn2+,已知lgKZnY=16.5,lgαY(H)=0.5, lgαZn (NH3)=5.0 , lgαZn(OH)=2.4,则化学计量点时pZn’为( ) 。
A:11.5 B:10.0 C:8.0 D:6.5 75.用HCl溶液滴定NaOH和Na2CO3混合液,以酚酞为指示剂,耗去HCl溶液V1mL,以甲基橙为指示剂继续滴定,又耗去HCl溶液V2mL,则V1与V2的关系是( )。
A:V1=V2 B:V1<V2 C:没关系 D:V1>V2 76.用双指示剂法测定某含有NaOH或NaHCO3或Na2CO3或某任意混合物的样品,若V2>V1>0,则溶液组成为( )。
A:NaOH B:Na2CO3+NaHCO3 C:NaHCO3 D:NaOH+Na2CO3 77.Na2S2O3标准溶液在保存过程中吸收了CO2而发生分解作用,若用此Na2S2O3滴定I2,使测定结果( )。
A:偏低 B:偏高 C:不变 D:不确定 78.已知某酸的浓度为0.1mol/L ,而其酸度大于0.1mol/L ,则这种酸为 ( )。
A:H3PO4 B:H2SO4 C:HCl D:HNO3 79.配制pH=9.0的缓冲溶液,缓冲体系最好选择( )。
A:醋酸(pKa= 4.74)-盐 B:六亚甲基四胺(pKb=8.85)-盐 C:一氯乙酸(pKa=2.86)-盐 D:氨水(pKb= 4.74)-盐 80.莫尔法测定氯离子时,铬酸钾的实际用量为( )。
A:0.1mol/L B:0.005mol/L C:0.02mol/L D:0.001mol/L 81.按照测定原理分类,分析方法可分为仪器分析和( )。
A:滴定分析 B:容量分析 C:重量分析 D:化学分析 82.EDTA的pKa1~pKa6分别是0.9,1.6,2.0,2.67,6.16和10.26。EDTA二钠盐(Na2H2Y)水溶液pH约是( )。
A:2.34 B:1.25 C:4.42 D:1.8 83.配位滴定终点时,溶液呈现的是( )。
A:MIn的颜色 B:M的颜色 C:In与MY的混合色 D:MY的颜色 84.下列哪种缓冲溶液的缓冲容量最大( )。
A:0.2mol/L NH3与0.2mol/L NH4Cl溶液 B:0.05mol/L NH3 与0.15mol/L NH4Cl溶液 C:0.1mol/L NH3 与0.1mol/L NH4Cl溶液 D:0.1mol/L NH3与0.3mol/L NH4Cl 溶液 85.下列有关Na2CO3在水溶液中质子条件的叙述,哪个是正确的?( ) 。
A:[H+]+2[H2CO3] +[HCO3-]=[OH-] B:[H+]+ [HCO3-]=[OH-]+2[CO32-] C:[H+]+2[Na+]+[HCO3-]=[OH-] D:[H+]+[H2CO3] +[HCO3-]=[OH-] 86.已知Fe3+/Fe2+ 的ψθ=0.77V,Sn4+/Sn2+ 的ψθ=0.15V,当用Sn2+还原Fe3+时,反应的平衡常数lgK等于( )。
A:11 B:21 C:12 D:36 87.莫尔法测定Cl-含量时,要求介质在pH=6.5~10.0范围内,若酸度过高,则会( )。
A:Ag2CrO4沉淀不生成 B:形成Ag2O沉淀 C:AgCl吸附Cl- D:AgCl沉淀不完全 88.下列那种物质的亲水性最大( )。
A:Ni2+ B:CH3OH C:CH3Cl D:C2H5OH 89.在pH=5.0的醋酸缓冲液中用0.002 mol/L的 EDTA 滴定同浓度的Pb2+。已知: lgKPbY=18.0,lgαY(H)=6.6,lgαPb(Ac)=2.0, 化学计量点时溶液中pPb应为 ( ) 。
A:5.2 B:3.2 C:6.2 D:8.2 90.用佛尔哈德法测定Ag+,滴定剂是( )。
A:Na2S B:NH4SCN C:NaBr D:NaCl 91.关于随机误差,下列叙述错误的是( )。
A:随机误差可大可小 B:同一分析人员平行实验的结果不完全相同,其原因是随机误差的存在 C:随机误差不可避免 D:随机误差没有任何规律 92.有一组平行测定所得的数据,要判断其中是否有可疑值,应采用( ) 。
A:t检验 B:Q检验法 C:格鲁布斯法 D:F检验法 93.与计量点的pM'有关的因素是( )。
A:M的总浓度 B:Y的平衡浓度 C:MY的条件稳定常数 D:M的平衡浓度 94.M与L发生副反应,其副反应系数的大小取决于( )。
A:L的平衡浓度 B:L的总浓度 C:M与L络合物的稳定性 D:M的总浓度 95.下列措施可使置信区间变窄的是( ) 。
A:提高置信度 B:提高结果的精密度 C:增加平行测定的次数 D:消除系统误差 96.影响条件形成常数的因素有( )。
A:共存离子的平衡浓度 B:温度 C:溶液的酸度 D:配位剂的平衡浓度 97.下列关于KMnO4标准溶液的配制过程描述正确的是( )。
A:将配好的KMnO4溶液加热至沸,并保持微沸约1小时,然后放置2~3天 B:将过滤后的KMnO4溶液储存于棕色瓶中,并存放于暗处 C:称取稍多于理论量的KMnO4,溶解在规定体积的蒸馏水中 D:用滤纸过滤,除去析出的沉淀 98.如下物质或离子可以采用KMnO4法进行测定的是( )。
A:C2O42- B:H2O2 C:MnO2 D:Ca2+ 99.由弱酸和其共轭碱组成的缓冲溶液,在下列哪些情况下可以稳定溶液的酸度( )。
A:加入少量酸 B:适度稀释 C:无限稀释 D:加入少量碱 100.下列哪种因素与沉淀的溶解度有关( )。
A:温度 B:溶剂 C:时间 D:颗粒大小 101.下列哪些因素导致随机误差( )。
A:多次平行滴定,终点颜色稍有不同 B:实验所用试剂纯度不高 C:移液管转移溶液后残留量稍有不同 D:称量过程中天平零点稍有变动 102.盐效应和同离子效应都可以增大沉淀的溶解度。( )
A:错误 B:正确 103.准确度用误差衡量。( )
A:正确 B:错误 104.离子的电荷数越高,活度系数越小。( )
A:错 B:对 105.HCl和NaOH都不是基准物质。( )
A:错 B:对 106.物质的颜色是吸收光互补色光的颜色。( )
A:正确 B:错误 107.间接碘量法必须在中性或弱酸性环境中使用。( )
A:错 B:对 108.对照试验可以检验系统误差。( )
A:错 B:对 109.随机误差决定结果的精密度,系统误差决定结果的准确度。( )
A:正确 B:错误 110.单色光指的是同种颜色的光。( )
A:正确 B:错误 111.在消除系统误差的前提下,总体平均值即为真值( )。
A:对 B:错


