鲁东大学
- 理想液态混合物各组分分子间没有作用力。( )
- 常见的溶胶制备方法可以分为分散法和凝聚法。( )
- A、B二组分组成的液态部分互溶系统相图中,三相线表示纯A、纯B和气体三相平衡共存。( )
- 当一个化学反应处于平衡状态时,该反应的 = 0。( )
- 一个已达平衡的化学反应,只有当标准平衡常数改变时,平衡才会移动。 ( )
- 在等温可逆膨胀过程中,系统对外做功时损失的能量最小 。( )
- 水在正常相变温度下的相变过程是可逆过程,所以ΔS等于零。( )
- 电动电势ζ的大小反映了胶粒带电荷的程度,ζ电势越高表明胶粒带电荷越多,扩散层也越厚。( )
- 对于一切强电解质溶液lnγ±=-A|z+ z-|
 均能使用。 ( )
均能使用。 ( ) - 物理化学中对一个物理量的表示需要包括数值和单位,但在作图列表时使用纯数来表示。( )
- 下列哪个不是二级反应的特征( )
- 涉及焓的下列说法中正确的是 ( )
- 常压下的二组分液态部分互溶的系统中,气液两相平衡共存,若气相组成介于两液相组成之间,下列说法正确的是( )。
- 关于链反应,下列说法正确的是 ( )
- 单组分系统相图可以根据克拉佩龙方程来绘制,下列过程中满足克拉佩龙方程的是( )。
- 对As2S3水溶胶,当以H2S为稳定剂时,下列电解质中聚沉能力最强的是( )。
- 已知 298.15 K 及 101325 Pa 压力下,反应 A(s) + 2BD(aq) = AD2(aq) + B2(g)在电池中可逆地进行,反应进度为1mol时,系统做电功 150 kJ,放热 80 kJ,该反应的摩尔等压反应焓变ΔH为多少? ( )
- 过饱和蒸汽的存在可以用以下哪个公式或方程解释?( )
- 体系经历一个不可逆循环后,( )
- 用同一滴管,分别滴下1 cm3的NaOH水溶液,水,乙醇的水溶液,各自的滴数多少的次序为:( )
- 在相距1m、电极面积为1m2的两电极之间和在相距10m、电极面积为0.1m2 的两电极之间,分别放入相同浓度的同种电解质溶液,则二者( )
- 若某液体能在某固体表面铺展,则铺展系数S一定:( )
- 液态完全互溶的A、B二组分组成的气液平衡系统,在T-x图上有最高点(该点温度比A组分和B组分的沸点都高),则该系统对拉乌尔定律产生( )。
- N2和H2合成NH3, 在400℃下, 动力学实验测定结果表明没有催化剂时, 其活化能为334.9 kJ·mol-1 ,用Fe催化时, 活化能降至167.4kJ·mol-1。 假定催化和非催化反应的指前因子相等, 则两种情况下,反应速率常数之比值kcat/k0 = ( )
- 为了测定电极的电极电势,需将待测电极与标准氢电极组成电池,这个电池的电动势就是待测电极电势的数值。按照目前惯用的电池符号书写方式和IUPAC对电极电势符号的规定,待测电池符号应是 ( )
- 在N2和O2混合气体的绝热可逆压缩过程中,系统的热力学函数的变化值在下列结论中正确的是( )。
- 对复杂反应 可用平衡近似处理时,K=k1/k-1=cB/cA。为了不扰乱快速平衡,①B→C必为慢步骤;②B→C必为快步骤;③ k1= k-1;④ k-1>> k2;⑤k-1<< k2,其中正确的是( )
- 电解质溶液的离子强度与其浓度的关系为( )
- 下面的叙述中违背平衡移动原理的是 ( )
- 理想气体在恒温条件下反抗恒定外压膨胀,变化过程中系统的熵变ΔS1与环境的熵变ΔS2应分别为( )。
- 高分子溶液分散相粒子的线尺寸为( )。
- 毛细管凝结现象可以用以下哪个公式或方程解释?( )
- 法拉第于1834年根据大量实验事实总结出了著名的法拉第电解定律。它说明的问题是( )
- 一定温度下,分散在气体中的小液滴,半径越小则饱和蒸气压:( )
- 对于反应A→P,如果反应物浓度减少一半,反应物的半衰期也下降一半,则该反应的级数为( )
- 化学反应的反应级数是一宏观概念、实验的结果,其值( )
- 一定量的理想气体从同一始态出发,分别经 (1) 等温可逆压缩,(2) 绝热可逆压缩到具有相同 压力的终态,以H1,H2分别表示两个终态的焓值,则有: ( )。
- 溶胶的基本特征可归纳为( )。
- 由A、B二组分组成一理想液态混合物,B的饱和蒸气压比A大,则系统总蒸气压( )。
- 反应 C(s) +O2(g) = CO2(g),2CO(g) +O2(g) = 2CO2(g)和C(s) +1/2O2(g) = CO(g)的平衡常数分别为K1θ,K2θ和K3θ,三个平衡常数之间的关系是 ( )
- 电解质溶液的摩尔电导率随溶液浓度的增加而( )
- 对于任何宏观物质,其焓H一定 _______ 热力学能U。( )。
- 等温等压条件下的润湿过程是:( )
- 某反应条件下,反应SO2(g) + 1/2O2(g) = SO3(g)的标准平衡常数K1θ = 0.54。保持反应条件不变,反应2SO2(g) +O2(g) = 2SO3(g)的标准平衡常数K2θ 应该等于 ( )
- 某反应在500K时,测得其速率常数为0.0462min-1,反应物的初始浓度为0.1mol·dm-3,则该反应的半衰期为 ( )
- 实际的电池工作时( )
- 在温度T时,反应A(g) +2B(g)=2C(g) 达到平衡,标准平衡常数Kpθ=1。现在在一个温度为T的真空容器中引入这3种气体,使它们的分压都等于100kPa,这时反应将 ( )
- 胶体有三个最基本的特性,下列不属于其中的是( )。
- 用对消法测定可逆电池的电动势时,主要为了 ( )
- 将两个活化能不同的反应在同一升温区间内升温,若Ea,1>Ea,2,则反应速率常数随温度变化的关系为( )
- 某电池电动势与温度的关系为:E/V = 1.01845 - 4.05×10-5 (t/℃ - 20) - 9.5×10-7(t/℃ - 20)2 298 K 时,该电池可逆放电,则 ( )
- A和B形成理想液态混合物,在这个气液平衡系统中,液相中A和B的物质的量都是2mol,纯A和纯B的饱和蒸气压分别为90kPa和30kPa,则气相摩尔分数之比yA : yB为( )。
- 对于带正电的Fe(OH)3溶胶和带负电的Sb2S3溶胶系统的相互作用,下列说法正确的是( )。
- 对平行反应,下列说法中不正确的是 ( )
- 固态部分互溶的二组分凝聚系统如图所示,系统延CF冷却,D→E之间存在的相是( )。
A:错 B:对
答案:错
A:错 B:对
答案:对
A:错 B:对
答案:错
A:对 B:错
答案:错
A:对 B:错
答案:错
A:对 B:错
答案:错
A:对 B:错
答案:错
A:错 B:对
答案:对
A:对 B:错
答案:错
A:对 B:错
A:反应物浓度与反应时间呈线型关系 B:消耗75%反应物所需时间为消耗50%反应物所需时间的三倍 C:半衰期与反应物初始浓度成反比 D:反应速率常数单位为[时间]
A:化学反应中,系统的焓变不一定大于内能变化 B:在等温过程中焓变为零 C:焓的增量只与系统的始态、终态有关 D:在绝热可逆过程中焓变为零
A:系统组成确定时,若升高温度,相组成必然发生变化。 B:无论系统组成如何,系统温度高于共沸温度时,易挥发组分的液相组成都大于气相组成。 C:系统组成、温度位于帽形区范围内时,随着温度升高,两液相组成随之改变。 D:无论系统组成如何,系统温度高于共沸温度时,易挥发组分的液相组成都小于气相组成。
A:只有加热和光照才能诱导自由基的产生 B:当一个自由基的消耗会产生两个或两个以上的自由基时,为支链反应 C:有自由基参加的反应一定是链反应 D:链的引发需要较高的活化能
A:
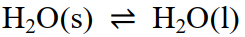 B:
B: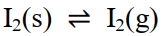 C:
C: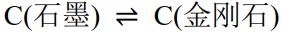 D:
D: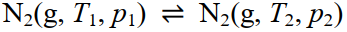
A:AlCl3 B:KCl C:CaCl2 D:NaCl
A:-80 kJ·mol-1 B:70 kJ·mol-1 C:-230 kJ·mol-1 D:-70 kJ·mol-1
A:朗缪尔 B:杨氏 C:拉普拉斯 D:开尔文
A:体系的熵增加 B:环境内能减小 C:体系吸热大于对外所做功 D:环境的熵一定增加
A:三者一样多 B:乙醇水溶液 > 水 > NaOH水溶液 C:NaOH水溶液 > 水 > 乙醇水溶液 D:水 > 乙醇水溶液 > NaOH水溶液
A:电导率相同,电导不相同 B:电导率不相同,电导也不相同。 C:电导率相同,电导相同 D:电导率不相同,电导相同
A:>0 B:不能确定 C:<0 D:=0
A:无法确定 B:负偏差 C:正偏差 D:没有偏差
A:10-13 B:29.929 C:9.95×1012 D:3.34×10-2
A:(-)待测电极‖标准氢电极(+) B:(-)标准氢电极‖待测电极(+) C:(+)待测电极‖标准氢电极(-) D:(+)标准氢电极‖待测电极(-)
A:ΔG=0 B:ΔS=0 C:ΔA=0 D:ΔU=0
A:①⑤ B:②③ C:①④ D:①
A:浓度增大,离子强度增大 B:浓度不影响离子强度 C:浓度增大,离子强度变弱 D:随浓度变化,离子强度变化无规律
A:升高温度平衡向吸热方向移动 B:升高温度平衡向放热方向移动 C:降低压力平衡向增加分子数的方向移动 D:增加压力平衡向体积缩小的方向移动
A:ΔS1<0,ΔS2=0 B:ΔS1<0,ΔS2>0 C:ΔS1>0,ΔS2<0 D:ΔS1>0,ΔS2=0
A:1 nm~1 μm B:比溶胶粒子大很多 C:> 1μm D:< 1nm
A:朗缪尔 B:开尔文 C:杨氏 D:拉普拉斯
A:通过电解池的电量与发生电极反应的物质的量之间的关系 B:通过电解池的电流与电势之间的关系 C:通过电解池的电流与超电势之间的关系 D:电解时电极上析出物质的量与电极面积的关系
A:越小 B:越接近于100 KPa C:无变化 D:越大
A:二级 B:一级 C:零级 D:三级
A:一定是大于1的正整数 B:只能是正整数 C:一定是小于1的负数 D:可以是任意值
A:H1< H2 B:其余选项都不对 C:H1> H2 D:H1= H2
A:多相性和聚结不稳定性 B:不均匀性和热力学不稳定性 C:高度分散和聚结不稳定性 D:高度分散,多相性和聚结不稳定性
A:大于B的饱和蒸气压 B:小于A的饱和蒸气压 C:等于A和B的饱和蒸气压之和 D:介于A和B的饱和蒸气压之间
A:
A:先减小后增大 B:减小 C:增大 D:先增大后减小
A:无法判断 B:小于 C:等于 D:大于
A:表面积缩小的过程 B:表面吉布斯自由能不变的过程 C:表面吉布斯自由能升高的过程 D:表面吉布斯自由能降低的过程
A:0.2916 B:0.54 C:0.735 D:1.08
A:15min B:150min C:216min D:条件不够,无法计算
A:只有能量转换是可逆的 B:只有物质变化是可逆的 C:能量转换肯定不可逆,物质变化可能可逆 D:物质变化和能量转换都是可逆的
A:自发向左进行 B:达到平衡状态 C:无法判断 D:自发向右进行
A:聚结不稳定性 B:多相不均匀性 C:动力稳定性 D:特有的分散程度
A:减少标准电池的损耗; B:在可逆情况下测定电池电动势 C:简便易行 D:消除电极上的副反应
A:无法确定 B:
A:不能确定 B:Q > 0 C:Q = 0 D:Q < 0
A:4 : 1 B:3 : 1 C:8 : 1 D:6 : 1
A:混合后一定发生聚沉 B:聚沉与否取决于Fe和Sb结构是否相似 C:聚沉与否取决于正、负电荷量是否接近或相等 D:混合后不可能聚沉
A:k1/k2的比值不随温度而变 B:反应的总速率等于两个反应速率之和 C:产物B和D的量之比等于两个反应速率常数之比 D:速率方程的微分式和积分式与同级的简单反应的速率方程相似
A:A(s)、α相和液相 B:A(s)和液相 C:A(s)和α相 D:液相和α相
温馨提示支付 ¥5.00 元后可查看付费内容,请先翻页预览!







