第一章 物质结构基础:本章主要呈现电子在核外的运动状态、核外电子分布的一般规律以及周期系与原子结构的关系等内容。介绍化学键、分子间力、分子的空间构型及晶体的基本类型等有关分子结构和晶体结构的基础知识。1.1核外电子运动的特殊性:电子的运动具有波粒二象性、量子化,服从微观统计性规律。[单选题]位于Kr前某元素,当它失去3个电子后,在其角量子数为2的轨道内电子为半充满状态,则该元素是Mn。选项:[对, 错]
1.2原子轨道和电子云:核外电子有轨道运动和自旋运动。ψ与|ψ|2的角度分布的区别与用途,四个量子数的物理意义与取值规律。电子云是一个统计概念,表示在核外空间某点附近电子出现的概率密度。
1.3核外电子分布:多电子原子的核外电子排布规律:遵守泡利不相容原理、能量最低原理和洪德规则。等价轨道全满、半满或全空时比较稳定。
1.4元素周期律:核外电子分布或特征电子构型与元素在周期表中的位置(周期、族、区)密切相关,并且使得元素性质(如原子半径、电离能、电子亲和能及元素电负性)也呈现相应的周期性。
1.5离子键与金属键:正负离子间通过静电作用力而形成的化学键叫离子键。自由电子与正离子之间的作用力将金属原子黏合在一起而成为金属晶体,这种作用力称为金属键。离子键和金属键都没有饱和性,没有方向性。
1.6共价键:价键理论认为,原子间自旋方向相反的未成对电子,轨道匹配重叠,可以形成稳定的化学键,这种化学键称为共价键,共价键具有饱和性和方向性。共价键分为σ键和π键。表征化学键的键参数有键能、键长和键角。
1.7价层电子对互斥理论:AXn型分子或离子,总是取电子对相互排斥最小的几何构型。若中心原子价层电子对全部成σ键,电子对的空间分布就是该分子的空间构型;若有孤对电子,则分子的空间构型将不同于电子对的空间分布。
1.8杂化轨道理论:杂化轨道理论认为,原子中能量相近的轨道可以混杂成相同数量的等价轨道。杂化轨道理论可以很好地说明分子的空间构型并解释分子极性。
1.9分子间力与氢键:分子间作用力包含色散力、诱导力、取向力和氢键等。分子间普遍存在色散力,色散力随相对分子质量增加而增大。氢键只存在于特定分子间。分子间作用力越大,物质的凝聚程度越大,沸点和熔点越高。
1.10晶体结构:晶体具有规则的几何外形、固定的熔点以及各向异性的特征。按照晶格点阵粒子间相互作用的类型,可以将晶体分为离子晶体、原子晶体、金属晶体和分子晶体。各种偏离晶体结构质点周期性重复排列的因素称为晶体的缺陷。
[单选题]下列过程需要克服的作用力为共价键的是( )选项:[
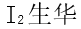 , HF溶于水, 电解水, 雪融化]
, HF溶于水, 电解水, 雪融化] [单选题]多原子分子中,键能就是各个共价键的离解能之和。选项:[对, 错]
[单选题]分子中键的极性可以根据电负性差值判断,电负性差值越大,则键的极性越大。选项:[错, 对]
[单选题]金属键和共价键一样,都是通过自由电子而成键的。选项:[错, 对]
[单选题]非金属元素间的化合物为分子晶体。选项:[对, 错]
[单选题]下到分子中电偶极矩为零的是( )选项:[
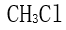 ,
, 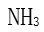 ,
, 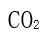 ,
, 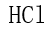 ]
] [单选题]下列化合物中,键的极性最弱的是( )选项:[
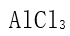 ,
, 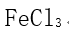 ,
, 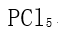 ,
, 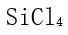 ]
] [单选题]下列各组分子均属于极性分子的是( )选项:[
 ,
,  ,
, 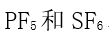 ,
,  ]
] [单选题]
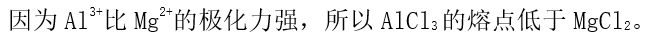 选项:[对, 错]
选项:[对, 错]
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!