第一章 电化学:本章讨论热力学在电化学中的应用,主要分为三部分:电解质溶液、原电池热力学和电极的极化。电解质溶液是原电池和电解池的重要组成部分,其依靠正、负离子的定向运动而导电。利用迁移数表征正、负离子导电能力大小,利用电导、电导率和摩尔电导率表征电解质的导电能力。通过电导的测定,可以计算弱电解质的解离度、解离平衡常数以及难溶盐的溶度积等有用的热力学数据。电解质浓度较高时,引入平均离子活度和平均离子活度因子来进行热力学计算。将化学平衡等温方程用于可逆电池得到能斯特方程,可用于计算不同浓度、不同温度下原电池电动势,也可利用电化学实验数据,借助该方程计算热力学函数、活度因子及化学反应平衡常数等重要的热力学数据。有电流通过时,电极电势会偏离平衡电极电势,即发生极化。掌握极化的分类、产生原因及带来的影响等。1.1电池、电解质溶液及法拉第定律:了解电化学的研究内容,了解电池的构成和电解质溶液的导电机理,会用法拉第定律进行有关计算。[单选题] H2SO4水溶液平均离子活度因子与离子活度因子的关系为 。选项:[
1.2离子的电迁移与迁移数:了解迁移数的定义,会用希托付方法计算离子的迁移数。
1.3电导、电导率和摩尔电导率:掌握电导、电导率和摩尔电导率的定义及意义,掌握电导的测定方法及应用。理解无限稀释溶液中的离子独立运动定律,会用离子的摩尔电导率计算电解质的摩尔电导率。
1.4电解质溶液的活度、活度因子及德拜-休克尔极限公式:理解平均离子活度和平均离子活度因子的定义,掌握两者之间的关系,会进行有关计算;掌握离子强度的计算;掌握利用德拜-休克尔极限公式,计算稀释溶液中离子活度因子的方法。
1.5可逆电池及其电动势测定:理解可逆电池需满足的条件,会正确书写电池的图式,能熟练地根据电池的图式书写电极反应和电池反应,反之亦然;掌握电池电动势的测定方法。
1.6原电池热力学:掌握利用可逆电池电动势及其温度系数,计算电池反应的摩尔吉布斯函数变、摩尔熵变、摩尔焓变和可逆反应热的方法,能熟练进行有关计算;掌握能斯特方程。
1.7电极电势和液体接界电势:理解电极电势的定义,会由电极电势计算电池电动势,了解液体接界电势的产生原因。
1.8电极的种类:掌握第一、第二、第三类电极的构成及相应电极反应写法,特别注意第二类电极与第一类电极的区别与联系。
1.9原电池设计:掌握将典型化学反应设计成原电池的方法。
1.10分解电压:了解分解电压和析出电势的概念。
1.11极化作用:理解电极极化的分类、产生原因和带来的后果,以及对原电池和电解池的影响。
1.12电解时的电极反应:了解电极上有多个反应可以同时发生时,电极反应的顺序。
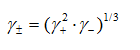 ,
, 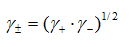 ,
, 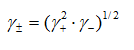 ,
, 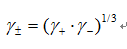 ]
] [单选题]
25℃时,b (NaCl) = 0.01 mol×kg-1的水溶液,g± =0.904, 则阴、阳离子的平均活度a± = 。
选项:[0.904, 0.04,
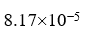 ,
, 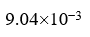 ]
][判断题]
增加电池反应中产物的活度,电池的电动势E将降低。
选项:[错, 对]
[单选题]
无限稀释的HCl、KCl和NaCl三种溶液,在相同温度、相同浓度、相同电位梯度下,溶液中Cl-的迁移速率 ,迁移数 。
选项:[不同,相同, 相同,相同, 相同,不同, 不同,不同]
[单选题]
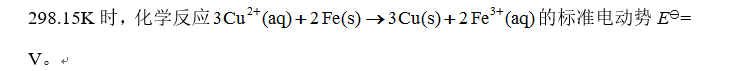 选项:[0.05 , 1.12, 0.308, 0.382]
选项:[0.05 , 1.12, 0.308, 0.382][单选题]25℃时,在一个电导池中盛有电导率k = 0.121 S×m-1的KCl溶液,测得其电阻为612 W。换成浓度为0.004 mol×dm-3的NH3×H2O溶液,测得电阻为1410 W,则此NH3×H2O的摩尔电导率Lm(NH3×H2O) = S×m2×mol-1。选项:[0.0525, 0.21, 0.0131, 13.1 ]
[单选题]
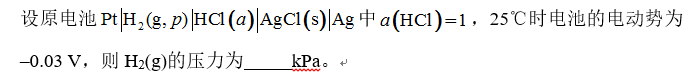 选项:[
选项:[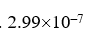 ,
, 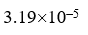 ,
, 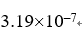 ,
, 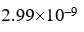 ]
][单选题]
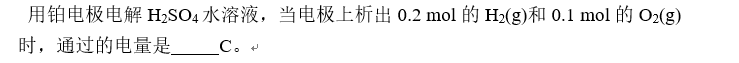 选项:[
选项:[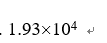 ,
, 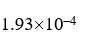 ,
, 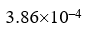 ,
, 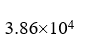 ]
]