第三章测试1.
以下溶液稀释10倍时pH改变最大的是
A: 0.1 mol/L NH4Ac-0.1 mol/L HAc溶液 B: 0.1 mol/L NH4Ac溶液 C: 0.1 mol/L NaAc-0.1 mol/L HAc溶液 D:0.1 mol/L NaAc溶液
答案:C
2.
下表述中错误的是
A:因为HAc的酸性强,故HAc的碱性必弱 B: H2O作为酸的共轭碱是OH- C:HAc的碱性弱,则H2Ac+的酸性强 D:H2O作为碱的共轭酸是H3O+ 3.
在水溶液中共轭酸碱对Ka与Kb的关系是
A:Ka·Kb=1 B:Kb/Ka=Kw C: Ka·Kb=Kw D: Ka/Kb=Kw 4.
影响平衡常数的因素是
A: 催化剂 B:温度 C:反应物和产物的浓度 D: 溶液的酸度 5.
用NaOH溶液滴定H3PO4溶液至pH = 4.7时,溶液的简化质子条件为
(H3PO4的pKa1~pKa3分别是2.12、7.20、12.36)
A:[H2PO4-] = [HPO42-] B: [H3PO4] = [H2PO4-] C:[H3PO4] = [HPO42-] D: [H3PO4] = 2[PO43-] 6.
右图是HAc的分布曲线,可以看出 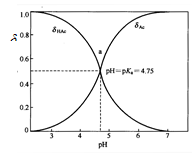
A:
随着pH值的增大,溶液中的主要存在形式由Ac-变为HAc
B:pH=3.0时溶液中Ac-为主要的存在形式 C:pH=6.0时溶液中HAc为主要的存在形式 D:在两条曲线交点处 [HAc]= [Ac-]
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!

