- 通过多相催化反应动力学的学习,可以达到以下哪些目的: ( )。
- 理想气体从状态I等温自由膨胀到状态II,可用哪个状态函数的变量来判断过程的自发性。( )
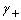
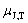
- 蓄电池在充电和放电时的反应正好相反,则其充电时正极和负极、阴极和阳极的关系为:( )。
- H2和O2以2:1的摩尔比在绝热的钢瓶中反应生成H2O,在该过程中( )是正确的。
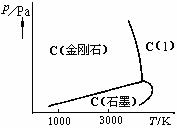
- 化学吸附的吸附力是:( )。
- 物质的量为n的理想气体等温压缩,当压力由p1变到p2时,其G是:( )。
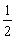
- 在等温等压下影响物质的表面吉布斯函数的因素:( )
- 一定量的某理想气体等容下由T1升温到T2,相同量的该气体等压下也由T1升温到T2,则两个过程热量的关系和热力学能变化的关系为:( )。
- 对于实际气体玻意耳温度TB是一个重要的性质参数,当温度高于实际气体的TB时,比值pVm /RT随压力p增加的变化特征是:( )。
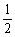
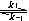
- 在高温高压下一种实际气体若其分子所占有的空间的影响可用体积因子b来表示,则描述该气体的较合适的状态方程是:( )。
- 在温度T时,若电池反应1/2Cu+1/2Cl2===1/2Cu2++Cl-的标准电池电动势为E1,Cu + Cl2=== Cu2+ +2Cl- 的标准电池电动势为E2,则E1和E2的关系为:( )。
- 已知298 K及100 kPa压力下, 0.5 mol C2H4(g) 完全燃烧时放出的热为705 kJ, C2H4(g)完全燃烧时的标准摩尔热力学能变化值为:( )。
- 科尔劳施离子独立运动定律适合于:( )。
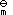
- 下列各式属于偏摩尔量的是:( )。
- 若某反应的活化能为80 kJ·mol-1,则反应温度由20℃增加到30℃,其反应速率系(常)数约为原来的:( )。
- 在等温等压下,化学反应达平衡时,下列诸式中何者不一定成立?( )
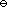
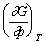
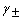
- 当计算1 mol理想气体从始态p1,V1,T1经历可逆的绝热过程至终态p2,V2,T2的体积功时,下列哪一式子是不适用的?( )。
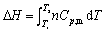
- 附加压力产生的原因是:( )。
- pVγ = 常数(γ = Cp,m/CV,m)适用的条件是:( )
- 强弱电解质性质上的差别是( )。
- 1 mol某理想气体,与温度恒定为400 K的热源相接触进行恒温膨胀时吸热40kJ,而所作的体积功仅为变到相同终态最大体积功的20 % ,则系统的熵变∆S为( )。
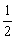
- 在温度T时实验测得某化合物在溶液中分解的数据如下:
则该化合物分解反应的级数为:( )。初浓度 c0/mol·dm-3 0.50 1.10 2.48 半衰期 T1/2/s 4280 885 174 - 在同一温度压力下,一定量某物质的熵值( )。
- 下列关于化学势的定义错误的是:( )。
- 1 mol C2H5OH(l)在298 K和100 kPa压力下完全燃烧,放出的热为1 366.8 kJ,该反应的标准摩尔热力学能变接近于:( )。
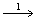
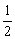
- 理想气体与温度为T的热源相接触,作等温膨胀吸热Q,而所作的功是变到相同终态的最大功的20 % ,则系统的熵变为( )。
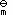
- 温度与表面张力的关系是: ( )。
- 零级反应AB的半衰期t1/2与A的初浓度cA,0及速率系(常)数k的关系是:( )。
- 若反应速率系(常)数k的单位为浓度·时间-1,则该反应为:( )。
- 在298 K恒压下把某化学反应设计在可逆电池中进行可得电功91.84 kJ,该过程的U,S,A和G的值为( )。 (选填表中的(1), (2), C、, D、)U / kJ S / J·K-1 A / kJ G / kJ
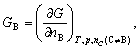
- 今有冰水两相系统,则在一定T,p下H2O(s),H2O(l)两相相转变的条件是:( )。
- 电解质分为强电解质和弱电解质,在于:( )。
- 当气-固相反应为内扩散控速时,反应时间与反应物的转化率呈抛物线关系。( )
- 多相催化不仅涉及表面反应的动力学规律,还涉及吸附、脱附和扩散的动力学规律;其中,催化剂的表面结构和性质是决定动力学规律的关键因素。( )
- 化学反应不可能在液相内部形成气泡,只有在液-固界面的活性气隙中才能发生生成气体的反应。( )
- 多相催化是一个多步骤过程,既包括化学过程又包括物理传质过程。( )
- 从热力学观点看,没有气相或液相参与的固相反应,会随着放热反应而进行到底。( )
- 常用的速率方程确定方法有( )
- 任何反应的半衰期都和( )有关
- 对于大多数化学反应,其反应速率随温度升高而降低。 ( )
- 影响反应速率的主要因素有 ( )
- 根据范特霍夫则,对于均相化学反应,温度每升高10K,反应速率变为原来的2-4倍。( )
- 在水平放置的玻璃毛细管中注入少许汞(汞不润湿玻璃),在毛细管中水平汞柱的两端呈凸液面,当在右端汞凸面处加热,毛细管中的汞向何端移动?( )
- 物理吸附时,吸附剂和吸附质分子间以化学键相互作用;而化学吸附时两者间以范德华力相结合。 ( )
- 质量比表面Am是指:( )
- 高分散度固体表面吸附气体后,可使固体表面的吉布斯函数:( )
- 今有反应 CaCO3(s) = CaO(s)+CO2(g) 在一定温度下达到平衡,现在不改变温度和CO2 的分压力,也不改变CaO(s)颗粒的大小,只降低CaCO3(s)颗粒的直径,增加分散度,则平衡将( )。
- 弯曲液面产生附加压力的根本原因是液面具有一定曲率。 ( )
- 根据吉布斯相律,双组分平衡系统的最大自由度数为:( )。
- 将克拉贝龙方程用于H2O的液固两相平衡,所以随着压力的增大,则H2O(l)的凝固点将:( )。
- 下列措施中肯定使理想气体反应的标准平衡常数改变的是( )。
- 温度T,压力p时理想气体反应:① 2H2O (g) == 2H2 (g) + O2(g) Kθ1② CO2(g) == CO (g) + O2 (g) Kθ2则反应: ③ CO (g) + H2O (g) = CO2(g) + H2(g) 的 Kθ3 应为( )。
- A,B双组分液态完全互溶系统,若其p-x图上p-x曲线出现极小值,则其t-x图上,t-x曲线:( )。
- 超额性质ME是表示什么之间的差别的?( )
- 四杯含有不同溶质相同质量摩尔浓度(m=1 mol·kg-1)的水溶液,分别测定其沸点,沸点升高最多的是( )
- 温度为273K,压力为1*106下,液态水和固态水的化学势之间的关系为( )
- 剩余性质MR是表示什么之间的差别的?( )
- 在等温、等压下,溶剂A和溶质B形成一定浓度的稀溶液,采用不用浓度表示方法的话( )
- 恒温时,在A-B双液系中,若增加A组分使其分压pA上升,则B组分在气相中的分压pB将( )

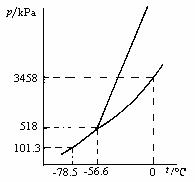
- 已知氢气的临界温度T等于tc = -239.9 ℃,临界压力PC = 1.297x103 kPa。有一氢气钢瓶,在-50 ℃时瓶中氢气的压力为12.16x103 kPa,则H2一定是( )
- 在温度恒定为100 ℃,体积为2.0 dm3的容器中含有0.035 mol的水蒸汽H2O。若向上述容器中再加入0.025 mol的液态水H2O,则容器中的水必然是( )。
- 在一定的T,P下,某真实气体的Vm(真实)大于理想气体的Vm(理想),则该气体的压缩因子Z( )。
- 真实气体在( )的条件下,其行为与理想气体相近。
- 对于理想气体,下列偏微分中,数值小于零的是( )
- 在真空密闭的容器中,1mol100℃,101.325kPa的液体水完全蒸发为100℃,101.325kPa的水蒸气。此过程的∆H(A),∆S(A),∆A(C),∆G( )。
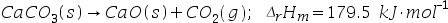
- 刚性容器中有一隔板,板两侧分别是n,T,V相同的氧气与氮气,恒温下将隔板抽去使气体混合均匀,系统的熵变∆S=( )。
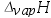
答案:均是
答案:∆S
答案:
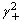
答案:> 0
答案:正负极不变,阴阳极正好相反
答案:∆U = 0
答案:增大压力
答案:化学键力
答案:
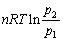
答案:0.4 mol
答案:是表面积A和表面张力σ
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!
