- 缓冲溶液的pH取决于两个因素,一是组成缓冲溶液的共轭酸的解离平衡常数,二是缓冲比。( )
- 缓冲溶液的缓冲容量越大,溶液的缓冲能力越大。( )
- φө(Zn2+/Zn)电极的标准电极电势为0.000V。
- OH-的共轭酸为H2O。
- H2O中的O原子采取不等性sp3杂化,O—H受孤对电子较大的斥力而压缩,偶极矩不为0。
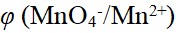
- 某反应的速率方程中各物质浓度的幂次方与总反应方程式中各物质的计量系数不相同,该反应一定是复杂反应。( )
- 难挥发非电解质稀溶液的依数性不仅与溶质种类有关,而且与溶液的浓度成正比。( )
- 化学热力学中,系统传递的能量有热和功两种形式。( )
- 水分子与二氧化碳分子间存在取向力、诱导力、色散力及氢键。( )
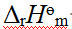
- 角量子数l=3的电子亚层上最多能够容纳14个电子。( )
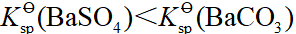
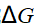
- 根据稀释定律,醋酸溶液浓度增大,其解离度减小,则其H+浓度也越小。
- 下列化合物中,含有氢键的是( )
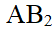
- 当以KMnO4作基本单元时,c(KMnO4) = 0.1 mol·L-1,若以KMnO4为基本单元,则c(KMnO4)是
- 对Li2+离子来说,其原子核外轨道能级顺序是
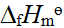
- 下列命题,正确的是:( )
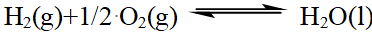
- 升高相同温度,通常化学反应速率加快倍数大的是:( )
- 根据酸碱质子理论,下列物质不属于酸的是( )。
- AB2型难溶电解质的Kϴ sp=1.6×10-16,则在0.01 mol·L-1 B-溶液中相对溶解度为()。
- 已知[Co(NH3)6]3+ 配离子的μ = 0,则配离子的中心原子Co3+的未成对电子数、杂化轨道类型和配合物类型分别为
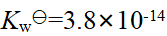
- 具有下列价电子构型的元素中,第一电离能最大的是( ) 。
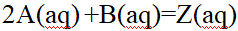
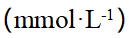
- 相同温度下,下列四种化合物中,饱和蒸气压最高(沸点最低)的为( )。
- 下列方法不能使硅酸溶胶聚沉的是( )。
- CaF2的溶解度2×10-4 mol×L-1,它的溶度积Kϴ sp=()。
- 0.4mol·L-1氨水中OH-浓度是0.1mol·L-1 氨水中OH-浓度的
- 某一可逆反应,其正反应为吸热反应,降低反应体系温度时( )
- 在相同温度下,下列溶液渗透压最大的是( )。
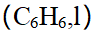
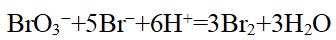
- 下列叙述,正确的是( )。
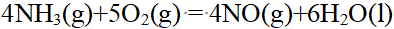
- 能够形成内轨型配合物的杂化轨道有( )
- 通过生成弱电解质使沉淀溶解的方法中,生成的弱电解质的解离平衡常数越小,沉淀越容易溶解。( )
- MgF2在MgCl2溶液中的溶度积比在水中的溶度积大。
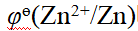
- 所有内轨型配合物都呈反磁性,所有外轨型配合物都呈顺磁性。( )
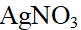
- 下列哪种是原子的基态结构?( )
- 第三电子层,有3s、3p、3d三个能级。
- 化学反应速率随温度升高而加快的主要原因是分子运动速度加快,增大了分子接触碰撞的频率。 ( )
- 催化剂通过参加反应,改变反应机理,改变反应活化能,进而改变反应速率。( )
- 电子的波性,是大量电子运动表现出来的统计性规律的结果。( )
- ΔrHөm 及ΔrSөm 受温度的影响比较小,但ΔrGөm 受温度的影响较大。
- 0.01mol氯化铬( CrCl3·6H2O )在水溶液中用过量AgNO3处理,产生0.02molAgCl沉淀,此氯化铬最可能为
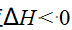
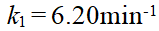
- Co(Ⅲ)的八面体配合物CoClm . nNH3,若1mol配合物与AgNO3作用能生成1mol AgCl沉淀,则m和n的值分别是
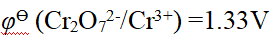
- 已知φӨ(Ag+/Ag)=0.799V, φӨ(Zn2+/Zn)= -0.76V,原电池(-)Zn|Zn2+(1.0mol·L-1)∥Ag+(0.01mol·L-1)|Ag(+)的电动势为()。
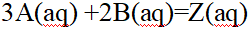
- 某原子基态时,次外层中包含有3d7,该元素的原子序数为
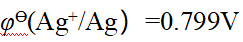
- 下列四种电解质对AgCl溶胶的聚沉值(mmol·L-1)分别为:NaNO3(300),Na2SO4(295),MgCl2(25),AlCl3(0.5),则该溶胶胶粒所带电荷的电性和溶胶类型分别是
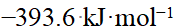
- 某反应ΔH < 0>
- 硫酸铜有不同水合物,其各级脱水反应K ϴ值分别为:CuSO4 · 5H2O (s) = CuSO4 • 3H2O (s) + 2H2O (g) K1ϴ CuSO4 •3H2O (s) = CuSO4 • H2O (s) + 2H2O (g) K2ϴ CuSO4 •H2O (s) = CuSO4 (s) + H2O (g) K3ϴ ,为了使CuSO4• H2O晶体保持稳定( 既不风化也不潮解) , 容器中水蒸气相对压力 pr (H2O) 应 为
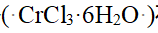
- 下列哪种浓度表示方法与温度有关( )。
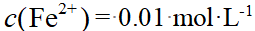
- 下列反应中,其标准摩尔焓变等于AgBr(s)的DfHmө的反应是
- 相同温度相同体积的三杯葡萄糖(C6H12O6)溶液,A杯溶液浓度为1 mol·kg-1,B杯溶液浓度为1 mol·L-1,C杯溶液质量分数为0.1,则各杯中葡萄糖的质量
- 速率常数k及标准平衡常数Kϴ都与反应温度相关,而与反应物起始浓度无关。
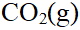
- 使溶液中某种离子沉淀,并非所加沉淀剂过量越多,沉淀就越完全。( )
- 一定温度下,两个化学反应的标准摩尔自由能变化值 ΔrGmϴ(2)= -ΔrGmϴ(1) ,则两反应的标准平衡常数的关系为 K2ϴ=(K1ϴ)-1。( )
- 化学反应速率随温度升高而加快的主要原因是分子运动速度加快,增大了分子接触碰撞的频率。( )
- 将浓溶液和稀溶液用半透膜隔开,欲阻止稀溶液的溶剂分子进入浓溶液,需要加到浓溶液液面上的压力,称为浓溶液的渗透压。( )
- 宏观物体不具有波粒二象性的运动属性。( )
- 绝对零度,任何完美有序晶体,其标准熵均为零。( )
- 不同反应,从同一温度起点开始升高相同温度,活化能小的反应速率常数增大的倍数大。( )
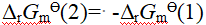
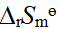
- 水分子与二氧化碳分子间存在诱导力、色散力。( )
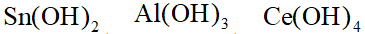
- 313K时,水的Kwy =3.8×10-14;在313K时,pH=7的溶液为
- Cr2O72-中Cr的氧化数为( )。

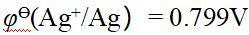
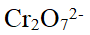
- 如果体系经过一系列变化 , 最后又回到初始状态 ,下列关系准确的是( )。
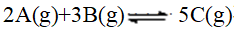
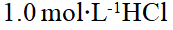
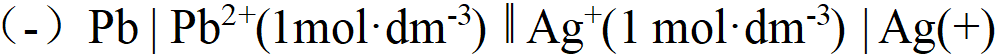
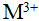
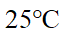
- 已知Zn(OH)2的溶度积常数为1.2×10-17,则Zn(OH)2在水中的溶解度为()。
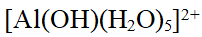
- 难溶电解质不一定是弱电解质。( )
- 系统吸收了100 J能量,并且对环境做了540 J的功,则系统的内能为-440 J。( )
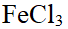
- 如果一个反应的DrHmө>0,DrSmө<0,则此反应在任何温度下都是非自发的。
- FeCl3在沸水中水解制得氢氧化铁溶胶,用该溶胶进行电渗实验时,阴极一边液面升高。( )
- 配位数是中心离子(或原子)接受配位体的数目。( )
- 为提高反应物的转化率,要加正催化剂而不是加负催化剂。( )
- 第三电子层,有3s、3p、3d三个能级。( )
- 在[Cu(NH3)4]2+溶液中,存在下列平衡: [Cu(NH3)4]2+==Cu2+ + 4NH3,向该溶液中分别加入以下试剂,能使平衡左移的是
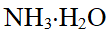
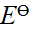
- 下列关于配合物的说法,错误的是( )
- BF3分子几何构型是平面三角形,B与F所成键是
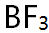
- 在严寒的季节里,为了防止仪器中的水结冰,可在水中加入甘油(C3H8O3),要使凝固点降低3.0 K,在500 g的水中应加入甘油(水的kf = 1.86 K·kg·mol-1)
- Mg(OH)2和MnCO3的Kϴ sp数值相近。在Mg(OH)2和MnCO3两份饱和溶液中:()
- 下列叙述,正确的是:( )
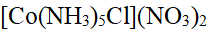
- 已知M3+的3d轨道上有5个电子,则M原子的价电子层结构式为( ),其元素名称为( )。
- BeCl2分子是直线形,而H2O分子是角形,这是因为中心原子的轨道杂化形式不同,分别是
- 一定温度下,下列四种化合物中,饱和蒸气压最低的为( )。
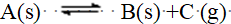
- 下列说法,正确的是。( )
- s电子绕核运动,其轨道为一个圆圈,而p电子是走∞的。( )
- 0.3 mol·kg-1的蔗糖溶液和0.3 mol·kg-1的甘油溶液的渗透压相等。
- 氯化铵的加入会使氨水的解离度变大。( )
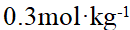
- 每个能级组对应一个周期,每周期中元素的数目就是该能层中最多容纳的电子数。( )
- 基态氮原子中,磁量子数等于0的电子最多不超过7个。( )
- 分子间氢键的形成将使该物质的熔点和沸点升高。( )
- 难容电解质不一定是弱电解质。( )
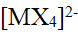
- 由总浓度一定的NH3×H2O(PKϴ b=4.75)与NH4Cl组成的缓冲液,缓冲能力最大时溶液的pH是()。
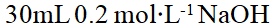
- 增大反应物浓度,反应速率加快的原因是:( )
- 已知,φө(Sn4+ / Sn2+) = 0.14 V,φө(Fe3+ / Fe2+) = 0.77 1V,则不能共存于同一溶液中的一对离子是(B)
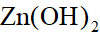
- 对于反应2A(aq) +B(aq)=Z(aq),下列速率方程,正确的是
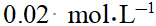
- φӨ(Pb2+/Pb)=-0.126V,KӨ(PbCi2)=1.6×10-5,则φӨ(Pb2+ / Pb)为:()
- 25℃,对于电极反应O2 + 4H+ + 4e- = 2H2O 来说,当p(O2)=100kPa时,酸度与电极电势的关系是 ( )
- 有利于配合物转化为难溶物质的条件是( )
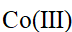
- 下列分子或离子中,不能作为配体的是( )
- 、向NaCl溶液中滴加AgNO3溶液,生成白色AgCl沉淀,离心后往所得沉淀中加一定浓度的氨水,沉淀溶解,又加入KBr溶液,会生成淡黄色AgBr沉淀,通过上述实验,可知Kϴ sp(AgCl)≥Kϴ sp(AgBr)。
- 每个电子层中最多容纳的电子数为2n2。
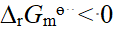
- 液态苯(C6H6,l)燃烧生成CO2 (g)和H2O(l),在298.15K时的定容燃烧热为-3204 kJ/mol,则苯在298.15K时的定压燃烧热为 ( )kJ/mol
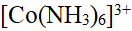

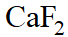
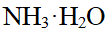
- 某一可逆反应,其正反应为吸热反应,降低反应体系温度时 ( )
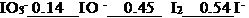
- 某元素最高氧化数为+6,基态原子最外层电子数为1,其原子半径为同族元素中最小的,则该元素为Mn。
- 产物分子的分子数比反应物的分子数多,该反应的DrSmө必是正值。

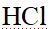
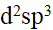
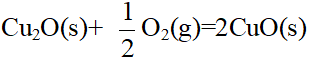
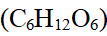
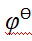
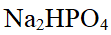
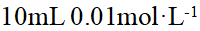
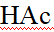
- 在标准压强、pH = 10.0时,氢电极的电极电势是 ( )
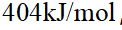
- 电对中氧化型形成的配合物越稳定,其电极电势( )
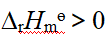
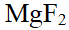
- 氮气分子中的化学键为两条σ键和一条π键。( )
- φ (MnO4-/Mn2+)的大小与溶液的酸度无关。
- 有利于沉淀转化为弱酸弱电解质的条件是( )
- PH3的分子量比NH3高,沸点却低于NH3,这是因为

- 某反应在716K时,k1 = 6.20min-1,745K时,k2=13.56min-1,则该反应的级数和活化能分别为
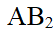
- 反应的吉布斯自由能ΔG值越大,则反应速率也越大,平衡常数越大。
- 已知φӨ (Cr2O72- / Cr3+) =1.33V,φӨ(Br2 / Br -) = 1.066V,φӨ(Fe3+/ Fe2+) = 0.77V,φӨ (I2/I-) = 0.54V,由此可知上述物质中,最强的氧化剂是
- 已知HAc的PKϴ a=4.75,HNO2的PKϴ a=3.37,HClO的PKϴ a=7.50,NaAc、NaNO2、NaClO中碱性最强的是()。
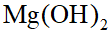
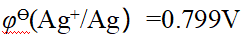
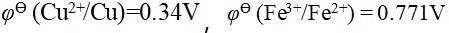
- 关于溶剂的凝固点降低常数,下列哪一种说法是正确的( )。
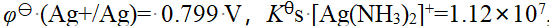
- 向1.0 mol·L-1HCl溶液中通H2S气体至饱和(0.1mol·L-1),溶液中S2-浓度为()。(H2S的Kϴ a,1=9.1´10-8, Kϴ a,2=1.1´10-12)
- 298K时:4NH3(g)+5O2(g) = 4NO(g)+6H2O(l) Δr= -1170 kJ×mol-1 4NH3(g)+3O2(g) = 2N2(g)+6H2O(l) Δr= -1530 kJ×mol-1 则NO(g)的Δf为: (D) /kJ×mol-1。
- 已知反应 Cu2O(s)+ O2(g)=2CuO(s) 的 ΔrGөm(300K)=-107.9kJ·mol-l , ΔrGөm(400K)= -95.3kJ·mol-l ,则 ΔrHөm/KJ·mol-1 和ΔrSөm /J·K-1·mol-1 各为
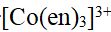
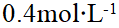
- 分步沉淀时,应分别计算出刚好产生各沉淀时所需沉淀剂的最低浓度,按所需沉淀剂最低浓度由高到低的顺序形成各个沉淀。( )
- 已知Kϴ sp(BaSO4)
- 配位数相同,同一中心离子所形成的螯合物比普通配合物要稳定。( )
- 极性分子中只有极性共价键,非极性共价键构成的分子一定是非极性分子。( )
- 一定温度下,溶液的浓度越大,其渗透压越高。( )
- AB2难溶电解质溶液加入到0.1 mol·L-1 的B-溶液中,AB2难溶电解质的溶度积减小。
- [Al(OH)(H2O)5]2+的共轭酸为[Al(H2O)6]3+。
- 配合物的内界和外界之间主要以共价键相结合。( )
- 碱性溶液中,碘元素标准电极电势图为IO- 30.14 IO-0.45 I20.54 I-,I2在碱性溶液中能发生歧化反应。
- 氯化钠的加入会增加醋酸溶液中氢离子的浓度。( )
- 若某元素原子的价电子排布式为4d15s2,则下列说法正确的是
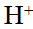
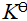
- 某原子能形成共价键的数目一定等于自由气态原子中未成对电子数目。( )
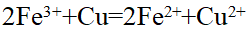
- DrGmө < 0>
- 氢键是一种比化学键更强的相互作用。( )
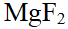
- 某元素最高氧化数为+6,基态原子最外层电子数为1,其原子半径为同族元素中最小的,则该元素为Mn。( )
- 已知反应BrO3−+5Br−+6H+=3Br2+3H2O,(对)Br−、BrO3−均为一级反应,(对)H+为二级反应,设该反应在酸性缓冲溶液中进行,若向该反应体系加入等体积的水,其速率变为原来的多少倍?
- 下列化合物分子间不存在氢键的是( )
- 下列哪个电子亚层可以容纳最多电子( )。
- 关于熵,下列叙述正确的是 ( )
- 下述各对物质,其对应的标准摩尔生成焓/标准摩尔燃烧焓取值相等的是 ( )
- 周期表中各周期元素数目是由什么决定的?( )
- 根据酸碱质子理论,下列物质不属于两性物质的是( )。
- 下列配合物中,在水溶液中解离度最小的是 ( )
- 配离子[Co(en)3]3+的下列说法中,正确的是
- 根据φӨ(Ag+/Ag)=0.799V, φӨ(Cu2+/Cu)=0.34V,标准态下能还原Ag+但不能还原Cu2+的还原剂与其对应的氧化态组成的电对的标准电极电势φӨ值所在范围为
- 乙烯分子中,碳和碳之间的化学键为( )。
- 将少量FeCl3(s)加到沸水中制备氢氧化铁溶胶,胶体粒子带什么电
- Na2HPO4溶液氢离子浓度计算公式的最简式为
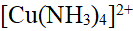
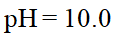
- 下列物质不是共轭酸碱对的一组物质是( )。
- 欲使0.02 mol×L-1的Mg2+离子在含有c(NH+ 4)=1.8 mol×L-1的氨水中刚好不会生成沉淀,则c(NH3)应该是 [Kϴ sp{Mg(OH)2}=5.6´10-12, Kϴ b(NH3)=1.8´10-5]。()
- 一氧化碳分子中的化学键为( )
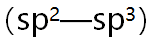
- 实验测得配离子[MX4]2-的磁矩小于简单离子M2+的磁矩,则下列关于[MX4]2-的中心离子轨道杂化类型和配离子空间构型的叙述中正确的是
- 向含有c(Fe2+)= 0.01 mol·L-1的Fe2+溶液中,滴加NaOH溶液<不考虑溶液体积变化>,欲不使Fe(OH)2沉淀生成,溶液的pH应控制在() [Kϴ sp{Fe(OH)2}=1.64×10-14]
- 醋酸钠溶液中氢离子或氢氧根离子浓度计算公式的最简式正确的有( )。
- Cr2O72-氧化 H2SO3 到SO42-的反应,增加酸度,则化学反应
- 两个半电池,电极相同,电解质溶液中物质也相同,但溶液的浓度不同。将这两种半电池用盐桥和导线联接起来,该电池的电动势符合( )。
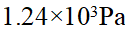
- 由总浓度一定的H2PO- 4/HPO2- 4缓冲对组成的缓冲溶液,缓冲容量最大时的pH是()。PKϴ a,1(H3PO4)=2.12,PKϴ a,2(H3PO4)=7.20,PKϴ a,3(H3PO4)=12.36
- 标准态下,石墨的标准摩尔燃烧焓为−393.6 kJ·mol−1,金刚石的标准摩尔燃烧焓为−395.6 kJ·mol−1,则石墨转变成金刚石反应的标准摩尔焓变值为(C)
- 以下能级符号不正确的是( )。
- 在下列的电子组态中激发态的是( )。
- 区分度是选拔考试的重要目标之一。
- 水平考试的目标是考查学生对课程基本概念、基本理论、基本知识的掌握程度,主要关注学生是否达到课程教学的基本要求。
- 课程期末考试和硕士研究生考试是同类型的考试。
- 下列学习方法,不够科学的是
- 下列知识,不属于无机及分析化学1课程的传统考点的是( )
- 下列关于配合物键价理论,说法正确的是( )
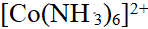
- 下列说法,正确的是 ( )
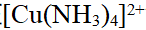
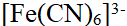
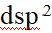
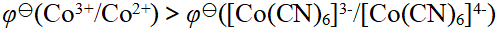
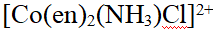
- 下列化合物,属于配合物的是( )。
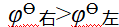
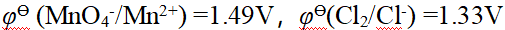
- 氧化数为0的物质没有氧化性,也没有还原性。
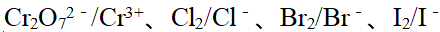
- 自身氧化还原反应就是歧化反应。
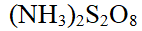
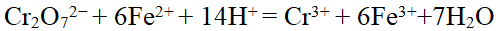
- 下列氧化剂中,哪一种氧化剂随着溶液的氢离子浓度增加而氧化性增强( )
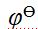
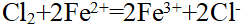
- 在有AgCl固体存在的AgCl饱和溶液中,当加入等体积的下列溶液时,能使AgCl的溶解度增大的是 ( )。
- [removed]iVBORw0KGgoAAAANSUhEUgAAAB8AAAAfCAYAAAAfrhY5AAAABHNCSVQICAgIfAhkiAAAAAlwSFlzAAASdAAAEnQB3mYfeAAADy5JREFUSA0BIw/c8AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAABAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAP8AAAAAAAAAAAAAAAAAAAABAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAP8AAAD/AAAAAAAAAAAAAAAAAAAAAAAAAP8AAAD/AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA/wAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAP8AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAP8AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAP8AAAAAAAAAAAAAAAAAAAAAAAAAAAQAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAP8AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAABAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAD/AAAAAAAAAAAAAAABAAAAAAAAAP8AAAAAAAAAAAAAAAEAAAAAAAAAAQAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAD/AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAD/AAAAAAAAAAAAAAAAAAAA/wAAAAAAAAAAAAAAAAAAAP8AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAP8AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA/wAAAAAAAAAAAAAA/wAAAP8AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAP8AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAD/AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAgAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAP8AAAABAAAAAQAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAP8AAAAAAAAAAAAAAAAAAAAAAAAA/wAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAABAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAP8AAAAAAAAAAQAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAP8AAAAAAAAAAAAAAAAAAAABAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAD/AAAA/wAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAP8AAAAAAAAA/wAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA/wAAAAAAAAAAAAAA/wAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAP8AAAAAAAAAAAAAAAAAAAAAAAAA/wAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA/wAAAP8AAAD/AAAAAAAAAP8AAAD/AAAAAAAAAP8AAAD/AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAD/AAAA/wAAAP8AAAAAAAAAAAAAAP8AAAD/AAAA/wAAAP8AAAAAAAAAAAAAAP8AAAAAAAAAAAAAAP8AAAAAAAAAAAAAAP8AAAD/AAAAAAAAAAAAAAD/AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA/wAAAP8AAAAAAAAAAAAAAAAAAAAAAAAA/wAAAAAAAAAAAAAAAAAAAP8AAAAAAAAAAAAAAAAAAAAAAAAAAAQAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAABAAAAAAAAAP8AAAAAAAAAAQAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAgAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAP8AAAAAAAAAAQAAAAAAAAAAAAAAAAAAAAAAAAD/AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAEAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAP8AAAAAAAAAAQAAAAAAAAAAAAAAAAAAAAEAAAD/AAAAAAAAAAEAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAD/AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAgAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAABAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAD/AAAAAAAAAAAAAAABAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAADhdA6Mm2yr0AAAAASUVORK5CYII=
- 难溶电解质的溶度积受温度和溶液中的离子浓度影响。
- 分步沉淀时,应分别计算出刚好产生各沉淀时所需沉淀剂的最低浓度,按所需沉淀剂最低浓度由低到高的顺序形成各个沉淀。
- 已知AgCl的为1.8×10-10,AgBr的为5.0×10-13,AgCl转化为AgBr比AgBr转换为AgCl容易。
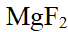
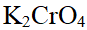
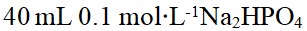
- 下列溶液不能组成缓冲溶液的是( )。
- 缓冲溶液的配制的第一步是确定共轭酸碱的浓度。
- 向缓冲溶液加入大量的强酸溶液或者强碱溶液,溶液的pH保持不变。
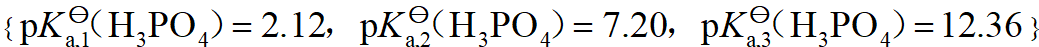
- 中和pH相等的相同体积的NaOH和NH3溶液,所需盐酸的量相等。
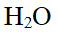
- 室温下0.1mol/LH2S 水溶液的pH为()
- 的共轭酸为
- 根据稀释定律,氨水溶液浓度增大,其解离度减小,则其OH-浓度也变小。
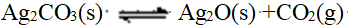
- 某反应ΔH >0,当反应达到平衡后升高温度,则在新的平衡建立之前( )。
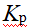
- 改变下列那一种情况,对任何已达到平衡的反应可使其产物增加( )。
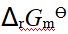
- 分子间氢键的形成将使该物质的熔点和沸点降低。
- 下列化合物中,含有氢键的是( )
- 氮气分子中的化学键为( )
- NH3的沸点(-33℃)比膦PH3的沸点(-87.7℃)高,这是因为( )
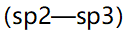
- 相同温度下,下列四种化合物中,饱和蒸气压最低(最不容易沸腾)的为( )。
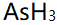
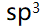
- 水分子与氨分子间存在取向力、诱导力、色散力及氢键。
- n=2,l=0的电子层上有两条自旋方向相反的原子轨道。
- 角量子数 l=1的电子亚层上最多能够容纳3个电子。
- 对钾原子来说,其原子核外轨道能级顺序是( )。
- 下列各组量子数组合,合理的一组是( )
- 原子序数为35的元素,其原子在n=3,l=1,m =+1的轨道上的电子个数为:( )。
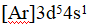
- 某元素基态原子,在n=5的轨道中仅有2个电子,则该原子n=4的轨道中含有电子( )个。
- 电离能递增顺序正确的是( )
- 氢原子的电离能为( )eV。
- 下列原子或离子核外未成对电子数目为5的是( )
- 化学反应速率随温度升高而加快的主要原因是增大了活化分子百分数。
- 某反应的速率方程中各物质的方次与总反应方程式中各物质的计量系数相同,该反应也不一定是简单反应。
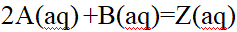
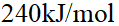
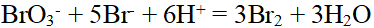
- 某一可逆反应,其正反应为吸热反应,降低反应体系温度时 ()
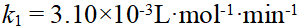
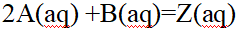
- 一级反应肯定是简单反应( )
- 同一反应,在低温区和高温区升高相同值的温度,高温区反应速率加快的倍数大。
- 在同一反应中,用反应物和产物表示反应进度,在同一时刻的ξ值是不同的。
- Q、W、U、H都是过程量,都不是状态函数。
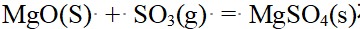
- 下述反应中,在298K,100kPa下是非自发的,在高温下可变成自发的是 ( )。
- 下列物质,标准摩尔熵最大的是( )
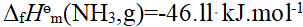
- 同一反应,正逆反应的热效应的数值相等,符号相反。
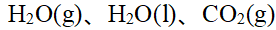
- 水变为水蒸气,其大于零。()
- 溶剂中加入难挥发溶质后,溶液的蒸气压总是降低,沸点总是升高。 ( )
- 一封闭钟罩中放一小杯纯水A和一小杯糖水B,放置足够长时间后发现 ( )
- 溶液在达到凝固点时,溶液中的溶质和溶剂均以固态形式析出,形成冰。
- 活性炭对色素苯溶液的脱色效果要优于对色素水溶液的脱色效果。
- 在相同温度下,下列溶液凝固点最小的是()。
- 质量摩尔浓度相等的葡萄糖水溶液和葡萄糖酒精溶液具有相同的依数性数值。
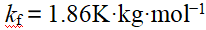
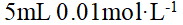
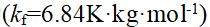
- 施肥过多会导致土壤溶液渗透压过高,造成植物失水过多而死亡。 ( )
- 学习化学系列课程,要实现的素质目标是( )
- 下列内容,属于有机化学研究内容的是( )
- 作为农业与生命科学专业的学生,不仅要掌握化学的基本原理、基本知识及基本操作技术,更重要的是要将所学知识运用到专业学习和专业研究中,努力做到知行合一。
- 化学的传统分支包括无机化学、分析化学、有机化学、物理化学。
- 无机及分析化学1课程将重点学习物质结构、化学的基本原理、溶液通性及水溶液中的四大化学平衡。
- 化学是研究物质,包括实物与场的变化的科学。
- 下列原理,不属于化学基本原理的是( )
- 下列研究内容,不属于化学研究范畴的是( )
- 下列各因素的变化,对化学平衡体系的平衡组成及转化率没有影响的是( )
- 分子中相邻原子间强烈的相互作用力称为化学键。
- 化学热力学主要研究化学反应热、反应方向及反应限度。
- 根据化学原理,一个反应进行得越完全,则其反应速率也越快。
- 下述常数,不能反映化学反应进行的完全程度的是( )
- 任何一个反应,无论其进行得是否完全,无论其进行得快还是慢,最终总是会达到平衡态。
- 下列诺贝尔化学奖项中,不能归属于生物学领域的标志性奖项是( )
答案:对
答案:对
答案:错
答案:对
答案:对
答案:错
答案:对
答案:错
答案:对
答案:错
答案:对
温馨提示支付 ¥5.00 元后可查看付费内容,请先翻页预览!

