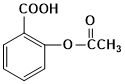
- 除去甲苯中的少量苯酚可用氢氧化钠溶液。( )
- 共价键的键长等于成键原子共价半径之和。( )
- 苯的结构中有三个独立的双键,易发生加成反应。( )
- 主量子数n=3,有3s,3p,3d三条轨道。( )
- 下列说法中不正确的是( )
- 卤化氢HCl(I),HBr(II),HI(III)与烯烃加成时,其活性顺序为( )
- 被高锰酸钾氧化后生成酮的是( )
- 等质量的下列烃完全燃烧,消耗氧气最多的是( )
- 下列有关溶液的说法中正确的是( )
- 以下哪项属于菜品营销的“四用原则”?( )
- 既能发生加成反应,又能发生酯化反应的是( )
- 下列命名中正确的是( )
- 苯和甲苯相比较,下列叙述中不正确的是( )
- 能说明苯分子的平面正六边形的结构中,碳碳键不是单、双键交替的事实是( )
- 氢键的键能与分子间力相近,因此两者无差别。( )
- 甲苯能使酸性高锰酸钾褪色,也能使溴水褪色。( )
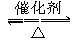
- 将pH=6的某溶液稀释100倍,其pH值为( )
- 离子晶体都是化合物,但原子晶体不一定都是单质。( )
- 电负性越大的元素其非属性越强。( )
- 苯胺的碱性比氨的碱性强。( )
- 所有电子构型为nS1的元素都是碱金属元素( )
- 在BaSO4沉淀中加入盐酸溶液,其溶解度会增大。( )
- 采用SP杂化轨道形成的共价分子,其分子的构型为直线型。( )
- 醇比同碳数目的烷烃的熔沸点高的原因是醇分子之间可以形成氢键。( )
- 乙烯与水作用生成乙醇发生的是加成反应。( )
- 苯与溴苯是同系物。( )
- 烯烃与O3反应再还原可生成( )
- 在酸度较大的水溶液中也不溶解的盐是( )
- 下列有关饱和溶液的说法不正确的是( )
- 下列用水就能鉴别的一组物质是( )
- 下列物质酸性最弱的是( )

- 下列各对物质,( )是共轭酸碱。
- 将浓度为0.1mol/LNaOH溶液稀释10倍后,其质量浓度为( )
- 以下有关氧化还原反应的叙述错误的是( )
- 下列物质属于强电解质的是( )
- 电极反应MnO4- + 8H+ + 5e- = Mn2+ + 4H2O的能斯特方程式为( )。
- CF3CH=CH2与HCl反应的产物主要是( )
- 把10g某物质溶于90g水中,其质量分数是( )
- 关于烷烃、烯烃和炔烃的下列说法,正确的是( )
- 下列物质中,属于饱和烃的是( )
- 烯烃与卤素在高温或光照下进行反应,卤素进攻的主要位置是( )
- 可以用来鉴别甲烷和乙烯,还可以用来除去甲烷中乙烯的操作方法是( )
- 下列分子中的键的极性最强的是( )
- 利用碘仿反应可鉴别( )
- 氢键的键能与分子间力相近,因此两者无差别。( )
- 配位化合物在溶液中的稳定性会受到溶液的酸碱性的影响。( )
- 苯不能使酸性高锰锰酸钾褪色,但甲苯可以,产物为苯甲酸。( )
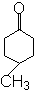
- 名称:对甲基环己酮。( )
- 金属A的电离能小于金属B的电离能,则金属A的活泼性肯定比金属B的大。( )
- 所有醛酮都能与亚硫酸氢钠发生亲核加成反应。( )
- 离子键的实质是正、负离子间的静电作用。( )
- 炔烃与硝酸银溶液作用可生成白色沉淀。( )
- 乙烯分子里各共价键之间夹角为120O( )
- 2-氯乙酸的酸性比乙酸酸性弱。( )
- 乙烷分子中各原子处于同一平面内。( )
- 氢键和分子间力都是一种电性作用力。( )
- 氢键具有方向性和饱和性,因此氢键与共价键均属化学键。( )
- 所有醛中都含醛基和烃基。( )
- 下列有关σ键的说法错误的是( )
- 由电极MnO4-/Mn2+和Fe3+/Fe2+组成的电池。若加大溶液的酸度,原电池的电动势将会。( )
- 下列说法中错误的是( )
- 实验室为防止FeCl3水解,在配制FeCl3溶液时常采用的方法是( )
- 下列分子中,分子间不能形成氢键的是( )
- 属于醇类的是( )
- 在纯水中加入少量的酸或碱,水的离子积常数( )
- 下列改变能使任何反应达到的产物增加的是( )
- 烯烃与HCl加成,当有H2O2存在时,得到反马氏产物,此描述( )
- 在酸性溶液中,下列叙述正确的是( )
- 与链烃相比,苯的化学性质的主要特征为( )
- 下列物质酸性最强的是( )
- 能鉴别丙烯和丙烷的试剂为( )
- 某化合物的分子式为AB2,A为ⅥA族元素,B为ⅦA族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98,已知AB2分子的键角为103.3°。下列推断不正确的是( )
- 配制0.1mol/LNaOH溶液200mL,需称取固体NaOH( )
- 下列化合物中与托伦试剂反应产生银镜的是( )
- 三氟化硼是平面正三角形,因此是非极性分子,推断三氯甲烷(碳原子位于分子结构中心)的结构和分子的极性情况是( )
- 下列不可能是乙烯加成产物的是( )
- 提高氧化还原反应的速度可采取的措施是( )
- 下列有关氧化还原反应的叙述,哪个是不正确的( )
- 烃类分子中的碳原子与其他原子的结合方式是( )
- 烷烃的同系物符合( )
- 下列化合物中可形成分子间氢键的是( )
- 氧化还原反应平衡常数K值的大小( )
- 常温下,已知Mg(OH)2的溶度积常数为1.8×10-11mol3·L-3,则Mg(OH)2的饱和溶液的pH最接近于( )
- pH=2的溶液比pH=6的溶液氢离子浓度高( )
- 有关化学用语不正确的是( )
- 下列叙述中错误的是( )
- 下列关于沉淀溶解平衡的说法不正确的是( )
- 客人在点餐时,服务人员应提醒客人菜量以免客人点菜过量。( )
- 乙二胺四乙酸可以用于分析化学中的配位滴定。( )
- 苯胺与溴水反应可以生成白色沉淀。( )
- 客人在餐厅跌倒,服务员应立即主动上前扶起。( )
- 含氮有机化合物是指含有碳氮键的有机化合物,它们在生物体中起重要的作用。( )
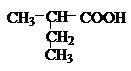
- HCOOH能与银氨溶液发生银镜反应。( )
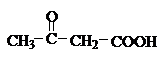
- 脂肪胺碱性强度为:叔胺>伯胺>仲胺。( )
- 消费者的性别、年龄、受教育程度、生活方式、经济状况等因素都会影响消费者的绿色消费行为。( )
- 苯的分子式为C6H6,它不能使KMnO4酸性溶液退色,属于饱和烃( )。
- 所有醛酮都能与亚硫酸氢钠发生亲核加成反应。( )
- 绿色营销实质就是市场营销。()
- 下列化合物溶液中加入FeCl3溶液,显紫色的是( )
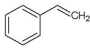
- 使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应,则两个过程中消耗的氯气的总的物质的量是( )
- 市售浓盐酸浓度为12mol/L ( )
- 锌与EDTA可形成螯合物。( )
- [Cu(NH3)4]SO4中中心离子为铜离子,SO42-为外界离子,而氨分子为配位体。( )
- 0.1mol/L氨水溶液的pH值等于13。(kNH3H2O=1.75×10-5)( )
- K3[Fe(CN)6] 中中心离子的配位数为3。( )
- 由于同离子效应,在BaSO4中加入Na2SO4溶液可使BaSO4沉淀完全,因此Na2SO4加入量越多越好。( )
- 同浓度的盐酸溶液中氢离子浓度一定大于醋酸溶液中氢离子的浓度。( )
- 在100mL0.01mol·L-1KCl溶液中,加入1mL0.01mol·L-1的AgNO3溶液会产生AgCl白色沉淀。(AgCl的Ksp=1.8×10-10)( )
- 向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为淡黄色,再滴加一滴Na2S溶液并振荡,沉淀又变为黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系是AgCl<AgI<Ag2S。 ( )
- 已知25℃时BaCrO4在纯水中溶解度为2.91x10-3mol/L,则BaCrO4的溶度积为2.91x10-6。( )

- 氧化还原反应平衡常数K值的大小反应了氧化还原反应进行的程度。( )
- 将AgCl加入到较浓Na2S溶液中,AgCl转化为Ag2S,因为AgCl溶解度大于Ag2S。( )
- 某电对的电位越低,其氧化态的氧化能力越强。 ( )
- 氧化还原反应是基于电子转移或电子对发生偏移的反应。( )
- 温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl沉淀析出。( )
- 稀释可以使醋酸的电离度增大,因而可使其酸性增强.( )
- 在温度不变的条件下,密闭容器中发生如下反应:2SO2+O2 2SO3,反应达平衡时,反应容器中压强不随时间变化。( )
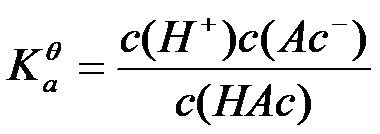
- 在浓度均为0.01 mol/L的HCl,H2SO4,NaOH和NH4Ac四种水溶液中,H+ 和OH-浓度的乘积均相等。( )
- 在温度不变的条件下,密闭容器中发生如下反应:2SO2+O2 2SO3,反应达平衡时,此时容器中SO2、O2、SO3的物质的量之比为2∶1∶2( )
- 丙醛与丙酮不能用下列( )试剂进行鉴别。
- 氨分子呈棱锥形结构,但是伯胺不一定呈类似的棱锥形结构。( )
- 3、下列物质酸性最强的是( )。
- 利用碘仿反应可鉴别( )。
- 下列物质互为同分异构体的是( )
- 对于A+2B(g) nC(g),△H<0。在一定条件下达到平衡后,增压,平衡不移动,当n=2时,A为固态。( )
- 将移液管所取液体放入容器时,应将留在尖端的液滴吹出。 ( )
- 增大压强,活化分子百分数增大,化学反应速率一定增大。( )
- 在配制 SbCl3溶液时,常先用一定量的6mol/L的HCl溶解SbCl3 ,再加水稀释至刻度。 ( )
- 配制溶液过程中,当溶液达到容量瓶的2/3容量时,应将容量瓶拿起,盖上瓶塞,颠倒摇匀使溶液初步混匀。( )
- 溶液可以是气体、固体、液体。( )
- 溶液的酸度越高,其pH值就越大。( )
- 根据酸碱质子理论,H2O既具有酸性也具有碱性。( )
- 碳酸钙在水里溶解度很小,其溶液的导电性很弱,所以碳酸钙是弱电解质。( )
- C(1/6KMnO4)=6(CKMnO4) ( )
- 配制50mL3mol/LH2SO4溶液需取18mol/L浓H2SO4的量是8.4mL。( )
- 有机铵盐易溶于水和乙醇。( )
- 溶液中只有一部分解离,导电能力弱的电解质称为弱电解质。( )
- 某K2Cr2O7溶液浓度为0.1mol/L,那1/6K2Cr2O7溶液浓度为0.6mol/L。( )
- 电负性越大的元素其非属性越强。( )
- 采用SP杂化轨道形成的共价分子,其分子的构型为直线型。( )
- 氢键和分子间力都是一种电性作用力。( )
- 当不对称烯烃与极性试剂发生加成反应时,极性试剂中的负电部分总是加到含氢比较少的双键碳原子上,这个规律称为马氏规则。( )
- 碳氢两元素的质量比为一定值的烃为炔烃。( )
- 相对分子质量为72的饱和链烃的同分异构体有4种。( )
- 核外电子运动状态由以下几个方面描述( )。
- 下列原子中第一电离能最大的是( )。
- 面对客人投诉时,服务人员只需要诚恳道歉就行了。( )
- 利用胺的碱性与成盐的特性,可以来鉴别、分离和提纯胺。( )
- 亚硝酸盐不能鉴定伯、仲、叔胺。( )
答案:对
答案:错
答案:错
答案:错
答案:在原子中,除最外层电子层,每层上的电子数必符合2n2个
答案:III>II>I
答案:2-甲基-2-丙醇
答案:C6H6
答案:溶液中的溶质可以是一种或两种,溶剂只是一种
答案:时令菜及时用
答案:2-丁烯-1-醇
温馨提示支付 ¥5.00 元后可查看付费内容,请先翻页预览!

