第二章单元测试
- 可逆吸热反应的平衡常数随温度升高而增大。( )
- 正催化剂能改变反应历程,降低反应活化能,但不能改变反应的标准吉布斯函数变。( )
- 只要温度不变,可逆反应反应物的平衡转化率就不变。( )
- 复杂反应机理的每一步反应必须是基元反应。( )
- 温度不变,增大浓度,活化分子百分数不变,活化分子浓度增大。( )
- 过渡态理论中,过渡态处于能量面的极大点,而中间体处于能量面的极小点。( )
- 化学反应级数可以是正数、负数或零。( )
- 升高温度,活化分子百分数不变,活化分子浓度增大。( )
- 某物质是某正反应的催化剂,也一定是该反应逆反应的催化剂。( )
- 反应级数和反应分子数不是一个概念。( )
在密闭容器中盛有NO2气体,在等温下建立下列平衡:2NO2(红棕色)= N2O4(无色),
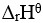 <0,若降低温度,则颜色将( )。
<0,若降低温度,则颜色将( )。- 反应速率的质量作用定律只适用于( )。
- 升高温度加快反应速率的主要原因是( )。
一个化学反应达到平衡时,下列说法中正确的是( )。
- 下列说法错误的是( )。
- 下列说法错误的是( )。
- 下列对于催化剂的描述,错误的是( )。
- 下列说法正确的是( )。
- 已知反应2SO2(g) + O2(g) = 2SO3(g)在某温度下达到平衡时气体的分压,SO2为22.4kPa,O2为33.0kPa,SO3为46.0kPa。则该温度下上述反应的标准平衡常数为( )。
某化学反应在298K时的标准自由能变为负值,则该温度时
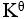 是( )。
是( )。
A:对 B:错
答案:对
A:错 B:对
A:对 B:错
A:错 B:对
A:对 B:错
A:错 B:对
A:错 B:对
A:错 B:对
A:错 B:对
A:对 B:错
A:不变 B:变深 C:变浅 D:不一定
A:实际能进行的反应 B:非基元反应 C:一步完成的简单反应 D:化学反应式中各物质计量系数均为1的反应
A:提高了活化分子百分数 B:降低了反应的活化能 C:增加了分子的碰撞次数 D:使平衡发生移动
A:各反应物和生成物的浓度或分压相等 B:
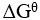 = 0
= 0
A:反应速率的碰撞理论在气体分子运动论基础上提出的理论 B:反应速率的过渡态理论也称绝对反应速率理论 C:反应速率的过渡态理论又称活化配合物理论 D:1918年,Lewis提出反应速率的碰撞理论,Lewis是美国化学家
A:非基元反应多于一个过渡态 B:一个基元反应,只对应一个过渡态 C:对于一个基元反应,根据微观可逆原理,正逆反应经过同一个过渡态 D:非基元反应的表观活化能不可能为负值
A:催化剂具有选择性 B:正催化剂能改变反应途径,降低反应的活化能,从而导致反应速率增大 C:催化剂分正催化剂和负催化剂 D:催化剂能够影响化学反应的热力学性质
A:升高温度,正逆反应速率都增大 B:增加反应物的量,平衡正向移动 C:增大压力,平衡向气体分子数小的方向移动 D:加入催化剂,平衡向吸热反应方向移动
A:7.81 B:0.0622 C:0.128 D:12.9
A:
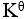 =1
=1
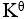 =
=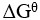
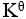 <1
<1
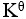 >1
>1
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!


