- 1 mol/L NH3 – 0.1 mol/L NH4Cl可以做标准缓冲溶液。( )
- 同离子效应一定能够降低沉淀的溶解度。( )
- 佛尔哈德法采用的指示剂是铁铵矾。( )
- 5105 mol/L HCl的pH = 4.3。( )
- 在相同的置信度下,平均值的置信区间要比个别测量值的置信区间更窄。( )
- 终点误差是系统误差。( )
- 晶形沉淀沉淀完全后,不需要进行陈化操作。( )
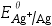
- (CH2)6N4H+/(CH2)6N4是共轭酸碱对。( )
- 精密度高的测量结果,准确度一定高。( )
- 在1 mol/L的H2SO4介质中,Fe(III)/Fe(II)的条件电位为0.68 V,Ce(IV)/Ce(III)的条件电位为1.44 V。用0.1000 mol/L的Ce(SO4)2溶液滴定0.100 mol/L的FeSO4溶液,滴定分数为2.00处的电位为0.68 V。( )
- 在1 molL1的HCl溶液中,用0.200 molL1的Fe3+滴定同浓度的Sn2+,若已知Fe(III)/Fe(II)的条件电位为0.68 V,Sn(IV)/Sn(II)的条件电位为0.14 V,则该滴定反应的条件平衡常数K为2.01018。( )
- 不对称电对就是不可逆电对。( )
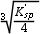
- 某溶液的[H+] = 1.810-5 mol/L,则pH值为4.7。( )
- 碘量法中的主要误差来源( )
- 某二元弱酸H2A,在pH = 2.50时,[H2A] [A2],当pH = 4.30 时,[HA] [A2],则该酸的pKa值为( )
- 关于条件电位,下列描述错误的是( )
- 用H2C2O42H2O标定NaOH溶液,共做4次滴定,分别得到NaOH的浓度为0.2015,0.2018,0.2014,0.2010 (mol/L),其平均值和相对平均偏差分别为( )。
- 磷酸钠盐的混合溶液,其pH > 7.0。当取出此种溶液20.0 mL,用MR为指示剂,以0.500 mol/L HCl标准溶液滴定时,需14.10 mL。另取此种溶液20.0 mL,用PP为指示剂,用0.600 mol/L NaOH标准溶液滴定时,需5.00 mL,则下面说法正确的是( )
- 下列的说法正确的是( )。
- 进行某种离子的鉴定时,怀疑所用试剂已变质,则宜进行( )
- 50 mL(pH=2.00)HCl与50 mL(pOH=5.00)的NaOH混合后,溶液的pH( )。
- 关于滴定突跃,说法不正确的是( )
- 以邻苯二甲酸氢钾为基准物质,标定NaOH溶液的浓度,滴定前,碱式滴定管内的气泡未赶出,滴定过程中气泡消失,则会导致( )。
- 关于滴定管读数所造成的误差,下列说法错误的是( )。
- 某碱液25.00 mL,以0.1000 mol/L HCl标准溶液滴定至酚酞褪色,用去15.28 mL,再加甲基橙继续滴定,又消耗HCl 6.50 mL,此碱液的组成是( )。
- 对于2A + B = C + 2D的氧化还原反应,已知参与反应的两个电对都是对称电对,请问下面哪种表示可能是该体系化学计量点时的电位( )
- 采用沉淀重量法测定SO42时,为保证BaSO4沉淀完全、纯净,下面操作正确的是( )
- 关于沉淀重量法,下列说法正确的是( )
- 10 mol/L的NH4CN溶液的pH( )。已知Ka(HCN)= 6.210-10, Ka(NH4+)=5.6 10-10
- 10 mol/L二氯乙酸的pKa = 1.30,则0.10 mol/L二氯乙酸的pH值为( )
- 分析某铁矿石中的铁含量,所得的结果符合正态分布。根据随机误差的标准正态分布,测定值出现在u > 2的概率为2.27%,若测量了20次,则测定值出现在2 < u>
- 用0.1000 mol/L NaOH滴定同浓度的乳酸(HA)20.00 mL。以下说法不正确的是( )
- 某分析人员用新发展的测氮法测定一标准样品的含氮量。已知标准值为16.62%,4次测定的平均值为16.72%,标准偏差为0.08。则新方法( )
- 某混合碱液25.00 mL(可能含有NaOH、NaHCO3、Na2CO3中的一种或几种),以0.1000 mol/L HCl标准溶液滴定至酚酞褪色,消耗HCl V1 mL,再加入甲基橙指示剂继续滴定,又消耗HCl V2 mL,若V1 < V2>
- 法扬司法是采用吸附指示剂指示终点的银量法,如用AgNO3滴定Cl时,采用荧光黄为指示剂,这是因为AgCl沉淀胶粒对荧光黄的吸附能力比对Cl的吸附能力( )。
- 标定好的NaOH标准溶液在存放的时吸收了少量CO2,则用该溶液测定HCl浓度时,采用甲基橙为指示剂,测得的HCl浓度与真实值比将( )。
- 某同学用总体积为50 mL的滴定管滴定时,消耗的滴定剂为10 mL左右,所造成的读数相对误差约为( )。
- 已知某标准样品中金含量的标准值为12.2 mg/kg, = 0.20,则小于11.7 mg/kg的分析结果出现的概率为(已知u = 2.5时,P = 0.4938)( )。
- 用沉淀重量法测P,得到的沉淀式为MgNH4PO4,称量式为Mg2P2O7,若以P的质量分数表示测定结果,则换算因数(F)的正确表示为 (M为摩尔质量的缩写)( )
- 采用佛尔哈德法测定Cl,用返滴定方式。先加入一定过量的AgNO3,生成AgCl沉淀,若用KSCN直接返滴定未反应的Ag+,则( )。
- 有关莫尔法描述正确的是( )
- 有关溶解度的影响因素,下列说法正确的是( )
- 下列哪些滴定方法可用于测定大理石(主要成分CaCO3)中Ca的含量( )
- 关于氧化还原滴定的化学计量点电位(Esp)的计算,下列说法正确的是( )。
- 在1 molL1的HCl溶液中,Fe(III)/Fe(II)的条件电位为0.68 V,Sn(IV)/Sn(II)的条件电位为0.14 V。用0.200 molL1的Fe3+滴定同浓度的Sn2+,则化学计量点的电位为( )
- 采用草酸钠(Na2C2O4)基准物质标定KMnO4标准溶液,有关反应条件错误的是( )。
- 已知在1 mol/L的H2SO4介质中,Fe(III)/Fe(II)的条件电位为0.68 V,Ce(IV)/Ce(III)的条件电位为1.44 V。用0.1000 mol/L的Ce(SO4)2溶液滴定0.100 mol/L的FeSO4溶液,滴定分数为0.500处的电位为( )。
- 10 mol/L的HCOONa溶液的pH为( )。已知Ka (HCOOH) = 1.810-4
- 50 mL(pH=2.00)HCl与50 mL(pOH=5.00)的NaOH混合后,溶液的pH为( )。
- 如欲配制pH=9.0的缓冲溶液,最好选择( )。
- 10 mol/L的NH4CN溶液的pH为( )。已知Ka(HCN)= 6.210-10, Ka(NH4+)=5.6 10-10
- 某混合碱液25.00 mL(可能含有NaOH、NaHCO3、Na2CO3中的一种或几种),以0.1000 mol/L HCl标准溶液滴定至酚酞褪色,消耗HCl V1 mL,再加入甲基橙指示剂继续滴定,又消耗HCl V2 mL,若V1 < V2>
- 根据随机误差的标准正态分布,测定值出现在u > 2范围内的概率为2.27%,则测定值出现在2 u 2之间的概率是( )。
- 以邻苯二甲酸氢钾为基准物质,标定NaOH溶液的浓度。滴定前,碱式滴定管内的气泡未赶出,滴定过程中气泡消失,则导致( )。
- 用间接碘量法测定某铜铁混合液中的铜离子含量,共做5次,得到的质量浓度分别为30.15,30.18,30.14,30.20和30.10(g/L),其平均值和相对平均偏差分别为( )。
- 平均值的置信区间要比个别测量值的置信区间更窄。( )
- 无水Na2CO3若保存不当,吸有少量水分,对标定HCl溶液浓度将造成( )。
答案:错
答案:错
答案:对
答案:对
答案:对
答案:对
答案:错
答案:对
答案:对
答案:错
答案:错
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!
