- 为了获得纯净的沉淀,洗涤沉淀时洗涤的次数越多,每次用的洗涤液越多,则杂质含量越少,结果的准确度越高。( )
- 二氧化硫和氯气都具有漂白作用,它们的漂白原理是相同的。 ( )
- CaCO3和PbI2的溶度积非常接近,皆约为10-8,故两者饱和溶液中,Ca2+及Pb2+离子的浓度近似相等。( )
- s区元素原子丢失最外层的s电子得到相应的离子,d区元素的原子丢失处于最高能级的d电子而得到相应的离子。 ( )
- 某可逆反应的 ΔrHmΘ < 0>
答案:正反应速率常数增大的倍数比逆反应速率常数增大的倍数小###平衡向逆反应方向移动
- 在周期表中,哪些区的原子有可能出现最外层只有一个l=0的电子?( )
- 关于纯物质的下述说法中,错误的是( )
- 下列原子轨道中,具有π对称性的是( )
- 下列物质属于Lewis 酸的是( )
- 气态的三氧化硫主要是以单分子形式存在,中心原子的杂化,成键及分子的结构为( )
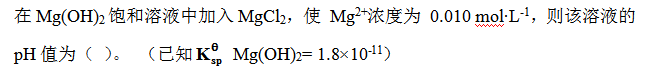
- 100℃,101.3 kPa的H2O(l)在真空容器中蒸发为100℃,101.3 kPa的H2O(g),则下述不正确的是( )
- 镁和铝都应是较活泼的金属元素,它们( )
- 以铁铵矾为指示剂,用返滴定法以NH4SCN标准溶液滴定Cl-时,以下错误的选项是( )。
- P4O6称为三氧化二磷,它可以( )
- 用佛尔哈德法测Cl-时,未加硝基苯保护沉淀会使分析结果( )
- AgCl(s)在水中,在0.01 mol·L-1 CaCl2溶液中,在0.01 mol·L-1 NaCl溶液中和在0.05 mol·L-1AgNO3溶液中的溶解度分别为S0、S1、S2、S3,则有( )。
- 用以检验Fe2+离子的试剂是( )
- 碘量法中使用碘量瓶的目的是( )
- 配制NaOH标准溶液时,必须使用煮沸后冷却的蒸馏水。( )
- 在滴定分析中,化学计量点必须与滴定终点完全重合,否则会引起较大的滴定误差。( )
- 在共轭酸碱体系中,酸、碱的浓度越大,则其缓冲能力越强。( )
- 碱土金属碳酸盐的热稳定性顺序是随原子序数的增加而增加。( )
- 在水溶液中常用φθMn+/M判断金属离子Mn+的稳定性, 也可以从φθ值判断 金属的活泼性 ( )
- 饱和溶液一定是浓溶液。( )
- 碱金属和碱土金属元素的电离能都是自上而下递减,金属性依次增强,它们的水合离子与单质金属所成电对的电极电势也是自上而下依次减小。 ( )
- 碱金属氢氧化物碱性强弱的次序为:LiOH
- 把AgNO3溶液滴入NaCl溶液中,只有当c(Ag+)=c(Cl-)时,才能产生AgCl沉淀。( )
- 对于电对Cu2+/Cu,加入某种配位剂后,对其电极电势产生的影响是逐渐增大。( )
- 无定形沉淀要在浓的热溶液中进行沉淀,加入沉淀剂速度适当快。( )
- 反应物浓度不变时,温度每升高10ºC,反应速率一般增加1倍,则400K时的反应速率是350K时的25倍。 ( )
- 沉淀称量法测定中,要求沉淀式和称量式相同。( )
- 下列反应中,ΔrSmΘ > 0 的是( )
- 下列关于含氧酸酸性的比较结果中正确的是( )
- 下列有关TiCl4的说法中错误的是( )
- 下列式子中,X 是以s p杂化轨道成键的是( )
- 下列关于V2O5的几种说法中错误的是( )
- 熔化下列晶体,需要破坏共价键的是( )
- 氟与水反应很激烈,并有燃烧现象,它的主要产物是( )
- 下列哪一族元素原子的最外层s电子都未占满?( )
- 在重量分析中能使沉淀溶解度减少的因素是( )。
- 用洗涤的方法能有效提高沉淀纯度的是( )。
- 采用均相沉淀法,不能达到的目的是( )。
- 分析测定中,偶然误差的特点是( )
- 下列原子轨道的 n 相同,且各有一个自旋方式相反的不成对电子,则沿X 轴方向可形成 π 键的是( )
- 下列分子或离子中,不存在π34的是( )
- 用来表示核外某电子运动状态的下列各组量子数(n l m ms)中哪一组是合理的?( )
- 下列关于杂化轨道说法错误的有( )
- Na2O2可用作潜水密闭舱中的供氧剂,在下列有关Na2O2的反应中,主要是利用了其中的( )。
- 已知CaSO4的溶度积为2.5×10-5,如果用0.01 mol·L-1的CaCl2溶液与等两的Na2SO4溶液混合,若要产生硫酸钙沉淀,则混合前Na2SO4溶液的浓度(mol·L-1)至少应为( )
- 下列四类化合物中氧化能力最强的是( )
- 57号元素镧的价电子构型是( )。
- 下列哪一或系列元素的原子最外层 s 电子都已占满( )。
- 下列关于镧系和锕系元素的叙述中正确的是( )。
- 被称为镧系元素的下列说法中,正确的是( )。
- 下列关于稀土元素的说法中正确的是( )。
- 下列含氧酸酸性强弱排列次序错误的是( )。
- Hg2SO4见光不分解。( )
- 分离三价铁离子和三价铬离子可选用的试剂是( )。
- 下列各对离子中,均不能与氨水作用生成配合物的是( )。
- 下列离子中,顺磁性最强的是( )。
- 下列氢氧化物中,具有两性的是( )。
- 下列物质中,碱性最强的是( )。
- 自然界中,碱金属元素的存在形态是( )。
- 下列金属在空气中燃烧时,主要生成正常氧化物的是( )。
- 关于金属铝的卤化物,下列说话中正确的是( )。
- NaH2PO4的水溶液呈( )。
- 在硼的化合物中,硼原子的最高配位数不超过4,这是因为( )。
- 下列分子或离子,与N2不是等电子体的是( )。
- 下列硝酸盐分解时,产物中不含有NO2的是( )。
- 石墨中层与层之间的结合力是( )。
- 下列离子或分子中含键的是( )。
- 下列碳酸盐中,在加热时最易分解的是( )。
- 下列硝酸盐受热分解,产生相应亚硝酸盐的是( )。
- 下列碳酸盐中,热稳定性最强的是( )。
- 硅酸盐的热稳定性主要取决于( )。
- 硝酸盐易溶于水,所以常用作配位剂。( )
- 所有固体铵盐的热分解产物中均有氨气。( )
- 固体铵盐受热分解产物因生成铵盐的酸的性质不同而异。( )
- 硼砂的化学式为Na2B2O7。( )
- 铜与浓HNO3反应生成NO2,铜与稀HNO3反应生成NO,所以稀HNO3的氧化性比浓HNO3强。( )
- 硼在自然界主要以含氧化合物的形式存在。( )
- 氮的最高氧化值为+5,可以推断NF5能稳定存在。( )
- Na2CO3比NaHCO3的溶解度大,同理,CaCO3比Ca(HCO3)2的溶解度也大。( )
- HNO3的浓度越大,其氧化性越强。( )
- 硼是非金属元素,但它的电负性比氢小。( )
- 下列氯化物中,能与水反应的是( )。
- 不能发生歧化反应的卤素单质为( )。
- 氯的含氧酸中,酸性最强的是( )。
- 下列反应不能用于在实验室中制取氯气的是( )。
- 氯的含氧酸中,热稳定性最强的是( )。
- 在常温下,易被空气氧化的氢卤酸是( )。
- 在氢卤酸中,由HF到HI酸性逐渐增强,其主要原因是( )。
- 卤素单质分子的解离能最小的是( )。
- 下列关于卤素单质性质的叙述中,正确的是( )。
- 下列能够相互作用产生Cl2的一组物质是( )。
- 卤素分子键能最大的是( )。
- 下列关于氯的含氧酸及其钠盐性质变化规律的叙述中错误的是( )。
- 卤素单质中,与水不发生水解反应的是( )。
- 卤化氢沸点高低的次序为HF
- 人们非常重视高层大气中的臭氧,因为它( )。
- 欲干燥H2S气体,在下列干燥剂中应选用( )。
- 在氯的含氧酸中,随着氯的氧化值增加,其氧化性越来越强。( )
- 在卤素与氧的化合物中,每种卤素都有多种正氧化值。( )
- 硫的熔点、沸点要比氧高得多,其主要原因是( )。
- HClO4是最强的无机酸。( )
- 下列对氧族元素性质的叙述中正确的是( )。
- 在氢卤酸中,由于氟的非金属性强,所以氢氟酸的酸性最强。( )
- 氧族元素氢化物酸性强弱的次序为H2O
- 氧族元素氢化物的沸点高低次序为H2O>H2S>H2Se>H3Te。( )
- H2S溶液放置一段时间变混浊,是因为H2S被空气氧化生成S沉淀。( )
- 在照像行业中Na2S2O3作为定影剂使用是基于它具有还原性。( )
- 氧族元素氢化物还原性强弱的次序为H2O
- 在气相中三氯化铝以双聚分子Al2Cl6的形式存在。( )
- 在KI水溶液中加入NaNO3,再加CCl4萃取,CCl4层显紫红色。( )
- 硫的含氧酸及其盐都是不稳定的,极易分解。( )
- H2S可以被Cl2氧化为H2SO4。( )
- 在所有含氧的化合物中,氧的氧化值都是负的。( )
- 用价层电子对互斥理论推测,I3-的几何形状是( )。
- KCl、CaCl2、FeCl2、FeCl3的熔点大小顺序正确的是( )。
- 下列配离子中,磁矩最大的是( )。
- HCl、HBr、HI的熔、沸点依次升高,其主要原因是( )。
- 下列物质的晶体结构中既有共价键又有大键和分子间力的是( )。
- 在其原子具有下列外层电子构型的元素中,第一电离能最小的是( )。
- 第四周期元素,原子最外层只有一个电子,满足此条件的元素有( )。
- 下列原子中,第一电子亲和能最大的是( )。
- 量子力学的一个轨道指n、l、m三个量子数具有一定数值时的一个波函数。( )
- 某元素原子仅有的2个价电子填充在n=4,l=0亚层上,则该元素的原子序数为( )。
- 在某些金属的难溶盐中,加入含有可与该金属离子配位的试剂时,有可能使金属难溶盐的溶解度增大。( )
- 在pH=10的条件下,用EDTA滴定水中的Ca2+、Mg2+时,Al3+、Fe3+ 、Ni2+ 、Co2+对铬黑T指示剂有什么作用?如何掩蔽?( )。
- 下面哪一个不属于EDTA与金属离子形成螯合物的特点( )。
- 配合物Cu2[SiF6]的正确名称是( )。
- 用EDTA标准溶液滴定金属离子M,若要求测定相对误差小于0.1%,则准确滴定的条件是( )。
- 以重铬酸钾法测定铁矿石中铁含量时,用0.02mol/L重铬酸钾滴定。设试样含铁以三氧化二铁(其摩尔质量为150.7g/mol)计约为50%,则试样称取量应为( )
- 对高锰酸钾滴定法,下列说法错误的是( )
- 在酸性介质中,以高锰酸钾溶液滴定草酸盐时,对滴定速度的要求错误的是( )
- 在碘量法中为了减少碘的挥发,常采用的措施有( )
- 标定碘溶液时,既可以用硫代硫酸钠滴定碘溶液,也可以用碘溶液滴定硫代硫酸钠溶液,且都采用淀粉指示剂。这两种情况下加入淀粉指示剂的时间是相同的。( )
- 甲、乙、丙、丁四种金属,将甲、乙用导线连接,浸在稀硫酸中,在甲表面上有氢气放出,乙逐渐溶解;将含有甲、丙两种金属的阳离子溶液进行电解时,阴极上先析出丙;把丁置于乙的盐溶液中有B析出。则这四种金属还原性由强到弱的顺序是( )
- 在一自发进行的电极反应的方程式中,若诸物质所得(失)电子数同时增大为n倍时,此电极反应的ΔG和的变化各为( )
- 关于标准电极电势的叙述中不正确的是( )
- 下列有关氧化数的叙述中,不正确的是( )
- 在pH=4.0时用莫尔法测定Cl-的含量,分析结果( )。
- 佛尔哈德法用的指示剂是( )。
- 由于混晶而带入沉淀中的杂质通过洗涤是不能除掉的。( )
- 用BaSO4重量法测定Ba2+含量,若结果偏低,可能是由于( )。


- 沉淀的转化只能是由溶解度大的沉淀转化为溶解度小的沉淀。( )

- 下列试剂中能使CaSO4(s)溶解度增大的是( )。
- 酸碱滴定突跃范围为7.0~9.0,最适宜的指示剂为( )。
- 用双指示剂法测定某含有NaOH或碳酸氢钠或碳酸钠或某任意混合物的样品,若V1>V2>0,则溶液组成为( )。
- 用于标定NaOH溶液浓度的H2C2O4·2H2O因保存不当而失去了部分结晶水,用此H2C2O4·2H2O标定NaOH溶液的浓度将( )。
- 硼酸的pKa=5.8×10-10,不能用标准碱溶液直接滴定。( )
- 用双指示剂法测定某含有NaOH或NaHCO3或Na2CO3或混合物的样品,若先以酚酞指示剂耗去盐酸V1 mL,继续以甲基橙指示剂时耗去盐酸V2 mL,已知V1=V2,则溶液中碱的组成为( )。
- 甲醛与铵盐反应生成的酸可用NaOH溶液滴定,其物质的量关系为n(NaOH)∶n(酸)=1∶3。( )
- 下列溶液中,可用直接法配制标准溶液的是( )。
- 常用于标定盐酸的基准物质是( )。
- 下列物质中,可以直接用来标定NaOH溶液浓度的基准物质是( )。
- 用0.10 mol.L-1NaOH 滴定0.10 mol.L-1的pKa=4.0的弱酸,其pH突跃是7.0~9.7,用同样浓度的 NaOH 滴定0.10 mol.L-1的pKa=3.0的弱酸时,其突跃范围是( )。
- 以0.20 摩尔每升HCl 滴定0.20 摩尔每升弱碱一元弱碱( pKb= 2 ),化学计量点pH值为( )。
- 已标定HCl和NaOH溶液常用的基准物质是( )。
- 下列酸碱滴定反应中,其化学计量点pH值等于7.00的是( )。
- 已知用0.1000mol/LNaOH溶液滴定20ml 同浓度的 HCl 溶液的突跃范围是pH为4.30~9.70。如果NaOH和HCl溶液的浓度都为0.01000mol/L,那么突跃范围的pH是( )。
- 氢氧化钠溶液的标签浓度为0.2000 mol/L, 该溶液从空气中吸收了少量的CO2, 现以酚酞为指示剂,用标准盐酸溶液标定,标定结果比标签浓度( )。
- 某酸碱指示剂的解离常数为 1.0乘以10 的-5次方,从理论上推算其pH变色范围是( )。
- 在下列叙述NH4H2PO4溶液的质子条件式中,哪一种说法是正确的( )。
- 下列各组物质中,不能用来制备缓冲溶液的是( )。
- 用纯水将下列溶液稀释10倍,(1)其中pH值变化最小的是( )。
- NaH2PO4水溶液的质子条件为( )。
- 浓度为c mol·L-1的H2C2O4的质子条件式是( )。
- 某二元弱酸H2A的pKa1、pKa2分别为2.28、5.13,则在该酸的分布曲线中dH2A与dA相等点的pH值为( )。
- 组成缓冲溶液的缓冲对一定是具有互为共轭酸碱对关系。( )
- 乙醇胺(HOCH2CH2NH2)和乙醇胺盐配制缓冲溶液的有效pH范围是( )。(乙醇胺的pKb=4.50)
- 下列各混合溶液,不具有缓冲能力的是( )。
- 对反应 HPO42- + H2O = H2PO4- + OH- 来说( )。
- HAc的共轭碱是( )。
- 在NH3.H2O溶液中,加入少量NH4Cl溶液,溶液的pH将( )。
- 按酸碱质子理论,磷酸二氢钠是( )。
- 下将 NH3·H2O稀释一倍,溶液中OH-浓度减少到原来的( )。
- 下列措施能使HAc电离度增大的是( )。
- 已知H3PO4 的pKa1、pKa2、 pKa3分别为1.64、7.20、11.88,则pKb1+ pKb2为( )。
- 把pH =14.00和pH =2.00的强电解质等体积混合后的pH值是( )。
- 在下述各组相应的酸碱组分中,组成共轭酸碱关系的是( )。
- 已知0.01 mol·L-1某弱酸HA有1%解离,它的解离常数为( )。
- 测定中出现下列情况,属于偶然误差的是( )
- 下列有关置信区间的定义中,正确的是( )
- 下列情况将对分析结果产生负误差的有( )
- 在测定过程中出现下列情况,不属于操作错误的是( )
- 两位分析者同时测定某一试样中硫的质量分数,称取试样均为3.5g,分别报告结果如下:甲:0.042%,0.041%;乙:0.04099%,0.04201%。甲的报告是合理的。( )
- 基准物质应具备下列哪些条件( )
- 某反应由于反应前后分子数相等,所以增加压力对平衡移动无影响。( )
- 对零级反应来说,反应速率与反应物浓度无关。( )
- 物质的量增加的反应不一定是熵增加的反应。( )
- 系统经历一个循环,无论有多少步骤,只要回到起始状态,其热力学能和焓变(△u和△H)应为零。( )
- 所有气体单质的标准摩尔生成焓都为零。( )

- 298K时下列物质的标准摩尔生成焓不为零的是( )。
答案:错
答案:错
答案:错
答案:错
答案:s区###d区###ds区
答案:熔化热一定大于蒸发热###蒸发热不一定小于升华热
答案:d yz###pz
答案:BF3###H3BO3
答案:sp2杂化,σ键,∏46键,平面三角形
答案:9.63
温馨提示支付 ¥5.00 元后可查看付费内容,请先翻页预览!
